文章信息
- TOPⅡα、TP53和HER2在胃腺癌中的表达及其临床意义
- Expression of TOPⅡα, TP53 and HER2 in Gastric Adenocarcinoma and Their Clinical Significance
- 肿瘤防治研究, 2018, 45(9): 656-659
- Cancer Research on Prevention and Treatment, 2018, 45(9): 656-659
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0019
- 收稿日期: 2018-01-08
- 修回日期: 2018-05-04
胃腺癌是我国最常见恶性肿瘤之一,严重危害人类健康,其恶性程度高,多数患者死于肿瘤的复发或远处转移。寻找预后评价指标并开展疗效好、毒性小的靶向治疗是目前胃腺癌研究的热点之一。本研究应用免疫组织化学及原位杂交法检测胃腺癌中TOPⅡα、TP53蛋白表达及HER2基因扩增的情况,结合临床病理因素,探讨这些指标的临床意义。
1 资料与方法 1.1 研究对象收集2014年1月至2015年12月郑州大学第一附属医院外科胃腺癌根治术后的136例进展期胃腺癌组织石蜡标本,并选取同期20例远端(距肿瘤5 cm以上)正常胃黏膜组织作为阴性对照,全部患者术前均未行任何辅助治疗(化疗、放疗及靶向治疗)。
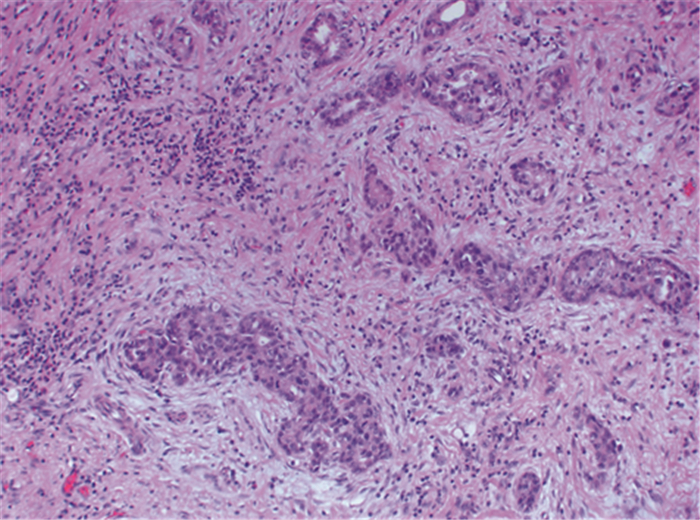
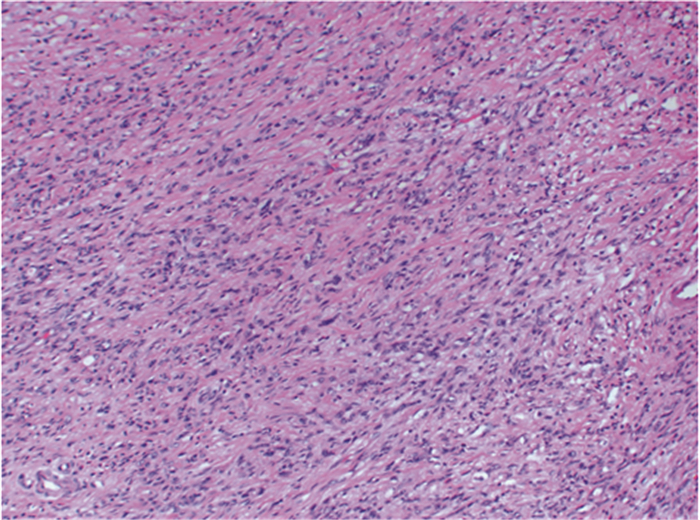
1.2 研究方法 1.2.1 一般资料收集对所有病例的组织病理切片进行复阅。136例胃腺癌患者中,男108例、女28例。年龄28~86岁,平均年龄60.7岁,中位年龄62岁。肿瘤最大径1~9 cm,平均4.7 cm。Lauren病理分型为肠型77例、弥漫型38例、混合型21例,见图 1、2。按照2010版WHO标准划分:高分化2例、中分化76例、低分化58例。淋巴结转移76例、无转移60例,其中有远处脏器转移3例。参照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)病理学分期(pathological TNM classification, pTNM)标准分为Ⅰ期8例、Ⅱ期79例、Ⅲ期46例、Ⅳ期3例。
|
| 图 1 具有明确腺样结构的肠型胃腺癌(HE ×40) Figure 1 Intestinal gastric adenocarcinoma with clear adenoid structure (HE ×40) |
|
| 图 2 未见明确腺样结构的黏附性较差的弥漫型胃癌(HE ×20) Figure 2 Diffuse gastric adenocarcinoma with poor adhesion and no definite adenoid structure (HE ×20) |
所有标本均经10%中性甲醛固定,常规石蜡包埋,4 μm厚切片,均行常规HE及免疫组织化学染色。采用免疫组织化学SP法进行检测,TOPⅡα、突变型P53(TP53)及HER2抗体均为即用型,购自北京中杉金桥生物技术有限公司。以PBS代替一抗作阴性对照,并按照试剂说明书提供阳性标本作阳性对照。
1.2.3 免疫组织化学结果判断标准镜下观察,对细胞膜、细胞质及细胞核出现棕黄色或棕色颗粒的细胞作为阳性细胞;TOPⅡα和TP53的阳性物质定位于细胞核,根据整张切片中阳性肿瘤细胞占全部肿瘤细胞的比例定为:阳性细胞数 < 10%为(-),阳性细胞数10%~25%为(+),阳性细胞数≥25%~50%为(++),阳性细胞数≥50%为(+++)。将(-)归为阴性表达,(+)~(+++)归为阳性表达。HER2的阳性物质定位于细胞膜,参照《胃癌HER2检测指南(2016版)》[1]定为0、+、++、+++,其中+++者为扩增阳性。
1.2.4 HER2基因扩增的原位杂交检测银增强双标记显色原位杂交(silver-enhanced in situ hybridization, SISH)试剂盒购自上海罗氏诊断产品有限公司,对HER2免疫组织化学评分为++者,行HER2基因的SISH检测,实验操作及判读标准严格按照试剂盒说明书进行。
1.2.5 HER2基因扩增原位杂交结果判断标准HER2/ CEP-17(17号染色体着丝粒)≥2.0,视为HER2基因扩增。
1.3 统计学方法采用SPSS20.0软件进行统计分析。采用率/构成比进行统计描述,组间差异采用χ2检验,两指标相关性采用Spearman相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 TOPⅡα、TP53和HER2在胃腺癌和正常胃黏膜中的表达TopⅡα与TP53表达于肿瘤细胞核,见图 3A、3B。阳性细胞胞核呈棕褐色,团簇状或颗粒状分布;肿瘤间质内未见阳性表达。136例胃腺癌标本中,TOPⅡα和TP53的阳性表达率分别是47.1%(64/136)和65.4%(89/136)。HER2蛋白表达于癌细胞膜,对HER2(++)者行SISH检测,最终阳性扩增率为23.5%(32/136),见图 3C、3D。正常胃黏膜上皮未见TopⅡα与TP53阳性表达及HER2阳性扩增。

|
| A: positive TOPⅡα expression in tumor cells nuclei (IHC×20); B: positive TP53 expression in tumor cells nuclei (IHC×20); C: positive HER2 expression in membranes of tumor cells (IHC×20); D: silver-enhanced in situ hybridization(SISH) for HER2 gene amplification (×20), Black dots were the sites of HER2 gene amplification, red dots were chromosome centromeres, and the ratio of the two was greater than 2.0. 图 3 TOPⅡα、TP53和HER2在肿瘤细胞中的表达 Figure 3 TOPⅡα, TP53 and HER2 expressions in tumor cells |
TOPⅡα和TP53的表达均与胃腺癌分化程度及Lauren分型显著相关(P < 0.05),与患者性别、年龄、瘤体大小、淋巴结转移及临床分期等无关;低分化以及弥漫型胃腺癌的TOPⅡα和TP53的阳性表达率显著高于中-高分化以及肠型胃腺癌。HER2阳性扩增与肿瘤的分化、Lauren分型以及临床分期显著相关(P < 0.05),与患者性别、年龄、瘤体大小以及淋巴结转移无关;中-高分化、肠型胃腺癌以及临床分期晚(Ⅲ和Ⅳ期)的胃腺癌HER2阳性扩增率显著高于低分化、弥漫型胃腺癌及临床分期早(Ⅰ和Ⅱ期)者,见表 1。

|
136例胃腺癌中,TOPⅡα和TP53同时阳性者53例,同时阴性36例,TOPⅡα阳性而TP53阴性者11例,TP53阳性而TOPⅡα阴性者36例,相关性分析结果显示,二者有显著相关性(r=0.326, P=0.000);HER2和TP53同时阳性者15例,同时阴性30例,HER2阳性而TP53阴性者17例,TP53阳性而HER2阴性者74例,相关性分析结果显示,二者有显著相关性(r=0.212, P=0.012);TOPⅡα和HER2同时阳性者13例,同时阴性53例,TOPⅡα阳性而HER2阴性者51例,HER2阳性而TOPⅡα阴性者19例,相关性分析结果显示,二者不具有显著相关性(r=0.071, P=0.404)。
3 讨论DNA拓扑异构酶(topoisomerase, TOP)分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四种,其中TOPⅡ又称四旋酶,有两个α亚基和两个β亚基。拓扑异构酶在肿瘤细胞中通过介导DNA断裂反应并形成DNA酶复合物,促进肿瘤细胞内DNA的合成、提高肿瘤增殖能力及恶性程度,同Ki-67一样被认为是经典的反映肿瘤细胞增殖状态的分子指标[2]。研究发现,TopⅡα抑制剂能够选择性杀伤增殖期肿瘤细胞,因此TOPⅡα可作为许多抗肿瘤药物的靶点。在乳腺癌中,TOPⅡα高表达,伴有TOPⅡα高表达的临床晚期的乳腺癌患者预后差于低表达者[3]。TOPⅡα在壶腹癌中也存在过表达,提示与患者的不良预后有关[4]。本研究显示TOPⅡα的表达与胃腺癌的分化和Lauren分型显著相关,组织学分级越高,TOPⅡα表达水平越高,对预后有预测作用。
人类P53基因是一种被广泛研究的抑癌基因,按基因型不同分为野生型以及突变型。其中野生型P53基因通过对细胞生长和凋亡进行调控而发挥抑癌作用,而当其转变为突变型P53(TP53)后,空间构像发生变化,抑癌作用改变,发挥刺激血管内皮生长因子并且调控肿瘤血管生长等促癌作用[5]。有研究报道,伴P53基因变异的晚期非小细胞肺癌患者,对以铂类药物为主的化疗方案的敏感度显著提高,说明TP53的检测对患者化疗用药有一定的指导意义[6]。TP53在胃腺癌旁黏膜上皮中亦有表达,可能是胃腺癌发生中的早期事件[7]。研究证实,TP53表达与胃腺癌病理类型密切相关,恶性程度高的患者TP53阳性表达率更高;预后分析亦显示,TP53阳性是胃腺癌患者预后不良的独立危险因素,更易出现肿瘤转移和复发[8]。本研究与既往研究结果一致,TP53蛋白表达与胃腺癌的组织分化及Lauren分型相关,其在分化差及弥漫型胃腺癌中均具有较高的阳性表达。因此分析胃腺癌组织中P53表达,有助于了解胃腺癌的进展状态,间接评估患者的预后。
HER2基因在诸如乳腺癌、食管癌、胃腺癌、卵巢癌等多种恶性肿瘤中呈现不同程度过表达。目前HER2受体的靶向治疗在胃腺癌中也受到广泛的关注。多项研究显示,HER2在胃腺癌中阳性表达范围为4%~53%,偏差较大[9-10];肠型胃腺癌HER2扩增率明显高于弥漫型胃腺癌,且HER2扩增的胃腺癌患者的长期生存率低于HER2阴性患者。HER2扩增的胃腺癌患者应用曲妥珠单抗联合化疗比单独化疗者的进展时间、反应持续时间均明显缩短,总缓解率显著提高,患者存活时间延长[11]。本研究HER2阳性表达率为23.5%,与全球多中心Ⅲ期随机临床研究报道的22.1%接近[12]。
P53与HER2基因均位于17号染色体上,有研究表明,17号染色体上存在P53基因高频缺失和HER2基因扩增[13]。在对卵巢浆液性癌[14]及乳腺癌[15]的研究中也发现,HER2和TP53蛋白的表达显著相关,提示二者与这些肿瘤的发展进程密切相关。在胃黏膜肠上皮化生中,TP53和HER2的异常表达随着肠化生程度加重而增加,一定程度上说明二者与胃腺癌的发生发展密切相关[16]。本研究结果显示,TP53和HER2阳性表达显著相关,且二者均与胃腺癌组织分化程度相关。另外,本研究还发现,TP53表达与TOPⅡα显著相关,这与既往在乳腺癌中的研究结果相一致[17]。
综上所述,TOPⅡα和TP53在胃腺癌组织中均有相当高的表达率,而TOPⅡα和HER2基因扩增与TP53表达均存在相关性。TOPⅡα、TP53及HER2等多基因的相互作用共同促进了胃腺癌的发生发展,三者联合检测有利于临床评估胃腺癌的生物学特性及预测患者预后,为胃腺癌患者,尤其是晚期患者的个性化治疗提供参考。
| [1] | 《胃癌HER2检测指南(2016版)》专家组. 胃癌HER2检测指南(2016版)[J]. 中华病理学杂志, 2016, 45(8): 528–32. [ Guideline Recommendations for HER2 Detection in Gastric Cancer Group. Guidelines for HER2 detection in gastric cancer (2016)[J]. Zhonghua Bing Li Xue Za Zhi, 2016, 45(8): 528–32. DOI:10.3760/cma.j.issn.0529-5807.2016.08.007 ] |
| [2] | Qiao JH, Jiao DC, Lu ZD, et al. Clinical significance of topoisomerase 2A expression and gene change in operable invasive breast cancer[J]. Tumour Biol, 2015, 36(9): 6833–8. DOI:10.1007/s13277-015-3390-6 |
| [3] | 赵向前, 梁斌, 张安红, 等. 壶腹癌中Ki-67和Top oⅡα的表达及意义[J]. 中华临床医师杂志(电子版), 2015, 9(2): 214–7. [ Zhao XQ, Liang B, Zhang AH, et al. Expression and significance of Ki-67, TopoisomeraseⅡα in ampullary carcinoma[J]. Zhonghua Lin Chuang Yi Shi Za Zhi(Dian Zi Ban), 2015, 9(2): 214–7. ] |
| [4] | Vousden KH, Prives C. Blinded by the Light: The Growing Complexity of p53[J]. Cell, 2009, 137(3): 413–31. DOI:10.1016/j.cell.2009.04.037 |
| [5] | Gazdar AF, Bunn PA, Minna JD. Small-cell lung cancer: what we know, what we need to know and the path forward[J]. Nat Rev Cancer, 2017, 17(12): 725–37. DOI:10.1038/nrc.2017.87 |
| [6] | Zhou F, Xu Y, Shi J, et al. Expression profile of E-cadherin, estrogen receptors, and P53 in early-onset gastric cancers[J]. Cancer Med, 2016, 5(12): 3403–11. DOI:10.1002/cam4.931 |
| [7] | Kunizaki M, Fukuda A, Wakata K, et al. Clinical Significance of Serum p53 Antibody in the Early Detection and Poor Prognosis of Gastric adenocarcinoma[J]. Anticancer Res, 2017, 37(4): 1979–84. DOI:10.21873/anticanres |
| [8] | Ayed DB, Khabir A, Abid M, et al. Clinicopathological and prognostic significance of p53, Ki-67, and Bcl-2 expression in Tunisian gastric adenocarcinomas[J]. Acta Histochem, 2014, 116(8): 1244–50. DOI:10.1016/j.acthis.2014.07.008 |
| [9] | Chua TC, Merrett ND. Clinicopathologic factors associated with HER2-positive gastric camcer and its impact on survival outcomes-a systematic review[J]. Int J Cancer, 2012, 130(12): 2845–56. DOI:10.1002/ijc.26292 |
| [10] | Gomez-Martin C, Plaza JC, Pazo-Cid R, et al. Level of HER2 gene amplification predicts response and overall survival in HER2-positive advanced gastric cancer treated with trastuzumab[J]. J Clin Oncol, 2013, 31(35): 4445–2. DOI:10.1200/JCO.2013.48.9070 |
| [11] | Sanford M. Trastuzumab: a review of its use in HER2-positive advanced gastric cancer[J]. Drugs, 2013, 73(14): 1605–15. DOI:10.1007/s40265-013-0119-y |
| [12] | Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687–97. DOI:10.1016/S0140-6736(10)61121-X |
| [13] | 黄必军, 朱振宇, 梁启万, 等. 肝细胞癌中p53基因的缺失与HER-2基因的扩增及其意义[J]. 中华病理学杂志, 2003, 32(1): 20–4. [ Huang BJ, Zhu ZY, Liang QW, et al. Loss of p53 gene and amplification of HER-2 oncogene in primary hepatocellular carcinoma and their clinical significance[J]. Zhonghua Bing Li Xue Za Zhi, 2003, 32(1): 20–4. DOI:10.3760/j.issn:0529-5807.2003.01.005 ] |
| [14] | Khandakar B, Mathur SR, Kumar L, et al. Tissue biomarkers in prognostication of serous ovarian cancer following neoadjuvant chemotherapy[J]. Biomed Res Int, 2014, 2014: 401245. |
| [15] | Wang XZ, Liu Q, Sun JJ, et al. Correlation between p53 and epidermal growth factor receptor expression in breast cancer classification[J]. Genet Mol Res, 2015, 14(2): 4282–90. DOI:10.4238/2015.April.28.10 |
| [16] | 张秋琴, 左艳, 徐三荣. 胃黏膜肠腺化生中Ki67、p53、HER-2、Bcl-2的表达及其临床意义[J]. 中国临床研究, 2012, 25(5): 423–5. [ Zhang QQ, Zuo Y, Xu SR. The expressions and clinical significance of Ki67, p53, HER-2 and Bcl-2 in the intestinal metaplasia of the gastric mucous membrane[J]. Zhongguo Lin Chuang Yan Jiu, 2012, 25(5): 423–5. ] |
| [17] | Yan J, Liu XL, Han LZ, et al. Relation between Ki-67, ER, PR, Her2/neu, p21, EGFR, and TOP Ⅱ-α expression in invasive ductal breast cancer patients and correlations with prognosis[J]. Asian Pac J Cancer Prev, 2015, 16(2): 823–9. DOI:10.7314/APJCP.2015.16.2.823 |
 2018, Vol. 45
2018, Vol. 45


