文章信息
- 不同原发部位结肠癌的临床病理及预后分析
- Clinicopathologic Characteristics and Prognosis of Colon Cancer Patients with Different Primary Locations
- 肿瘤防治研究, 2018, 45(9): 672-675
- Cancer Research on Prevention and Treatment, 2018, 45(9): 672-675
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.18.0017
- 收稿日期: 2018-01-08
- 修回日期: 2018-03-26
2. 430079 武汉,湖北省结直肠癌临床医学研究中心,湖北省肿瘤医院胃肠外科
2. Hubei Colorectal Cancer Clinical Research Center, Department of Gastrointestinal Surgery, Hubei Cancer Hospital, Wuhan 430079, China
结肠癌是消化道常见的恶性肿瘤之一,其发病率及死亡率在我国呈逐年上升趋势[1]。在当前肿瘤个体化治疗时代,个体化评价患者的预后,对患者病情的把握及治疗方案的制定都具有重要意义。近期有研究显示,结肠癌原发肿瘤部位可能影响患者预后并对分子靶向药物的用药选择具有指导意义[2]。然而,既往研究主要针对左、右半结肠癌进行预后分析[3-5],而针对具体结肠解剖部位包括升结肠、横结肠、降结肠、乙状结肠的预后分析研究较少。本研究对湖北省肿瘤医院收治的1 088例结肠癌进行回顾性分析,旨在探讨结肠癌患者不同原发肿瘤部位对临床病理及预后的影响。
1 资料与方法 1.1 病例入选和排除标准患者入组标准为:(1)肿瘤原发于结肠;(2)均行手术治疗,原发灶有明确的病理分期;(3)病理明确诊断为腺癌;(4)有完整的随访资料。排除标准:(1)同时性或异时性结肠多原发癌;(2)阑尾及直肠肿瘤;(3)家族性腺瘤性息肉病。
1.2 一般资料2007年1月1日至2011年12月31日间在湖北省肿瘤医院接受手术治疗的1 247例结肠癌患者中,排除结肠多原发癌56例,临床信息或随访资料不全103例,最终对1 088例结肠癌的临床病理资料进行统计分析,其中男622例(57.2%),女466例(42.8%),平均年龄为(59.9±12.6)岁。根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第7版分期标准进行肿瘤TNM分期。1 088例患者中,Ⅰ~Ⅳ期依次为64、505、367、152例;盲肠癌58例、升结肠癌338例、结肠肝曲癌98例、横结肠癌62例、结肠脾曲癌21例、降结肠癌96例、乙状结肠癌415例。根据原发肿瘤位置不同,将所有病例分为升结肠组(含盲肠癌及升结肠癌)396例、横结肠组(含结肠肝曲癌及横结肠癌)160例、降结肠组(含结肠脾曲癌及降结肠癌)117例和乙状结肠组415例。
1.3 随访通过门诊复查、信件和电话方式进行随访。随访截至2016年12月1日,随访时间为3~107月,中位随访时间为68月。
1.4 统计学方法所有资料均用SPSS17.0统计软件处理。计数资料比较采用χ2检验;多组间的计量资料比较采用方差分析。肿瘤不同部位对预后影响的多因素分析采用Cox比例风险回归模型。采用Kaplan-Meier法进行生存分析,Log rank检验进行生存时间比较。检验水准α=0.05。
2 结果 2.1 结肠癌患者临床病理特征升结肠组患者平均年龄最大,为(61.1±12.3)岁,女性患者所占比例最高(47%),而降结肠组女性所占比例最低(33.3%)。升结肠组和横结肠组患者CEA异常升高患者较多见,分别为48.5%和42.5%,而降结肠组和乙状结肠组分别为35.9%和40.7%,组间差异有统计学意义(P=0.044)。升结肠组和横结肠组肿瘤直径(5.9±2.2 cm和5.8±2.4 cm)显著大于降结肠组及乙状结肠组(4.4±1.8 cm和4.6±1.7 cm,P=0.000)。除外升结肠组,其他部位肿瘤Ⅰ/Ⅱ期患者所占比例均在50%以上,乙状结肠组Ⅰ期患者所占比例最高(9.9%),约为升结肠组的3倍(3.8%),差异有统计学意义(P=0.001)。升结肠组和横结肠组肿瘤中黏液分泌、低分化及未分化程度和脉管瘤栓比例均显著高于降结肠组及乙状结肠组,差异均有统计学意义(P=0.000或0.001),见表 1。肿瘤大体形态、癌结节和接受化疗患者所占比例在四组间差异无统计学意义。淋巴结检出数目升结肠组和横结肠组显著高于降结肠组及乙状结肠组,各组分别为(21.0±9.9)、(19.4±11.1)、(13.5±8.3)和(13.8±8.0)个(P=0.001)。
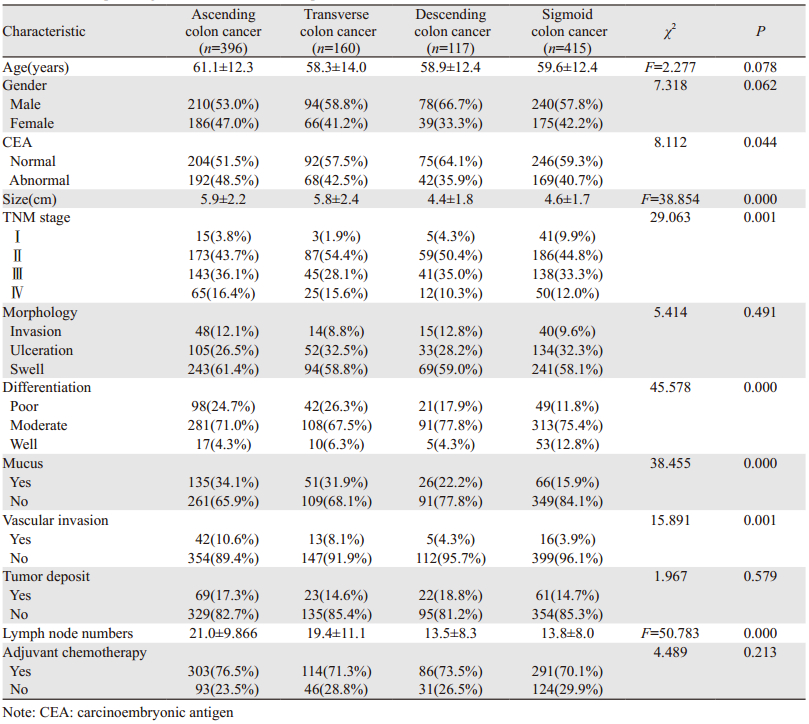
|
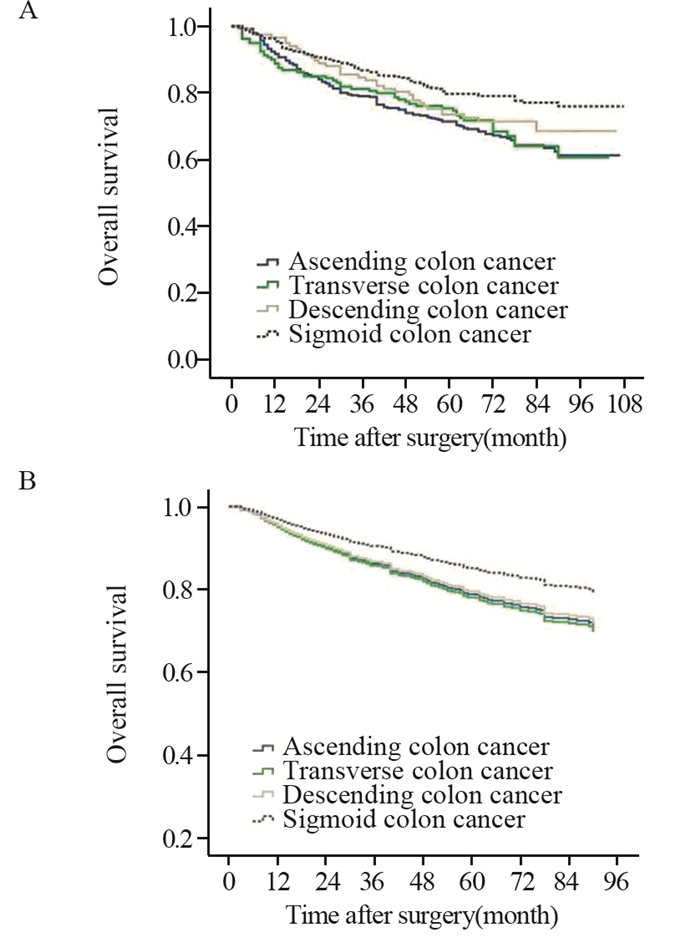
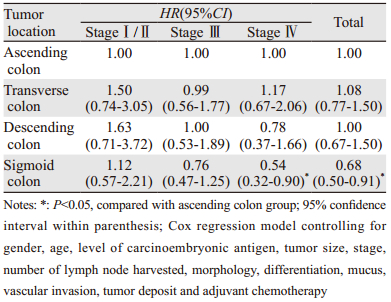
升结肠组、横结肠组、降结肠组和乙状结肠组患者中位生存期分别为:66、67、68和71月;5年总生存率分别为:71.4%、75.4%、73.5%和79.7%,差异有统计学意义(P=0.001),见图 1A。应用Cox比例风险回归模型进行多因素回归分析,调整后肿瘤部位是独立的预后影响因素(P=0.024),乙状结肠组患者预后显著优于其他组,见图 1B,与升结肠组患者相比,死亡风险下降32%。根据肿瘤分期进行分层分析显示,Ⅳ期乙状结肠组预后显著优于升结肠组,死亡风险下降46%,见表 2。
|
| A: Overall survival curves of colon cancer patients with different primary tumor locations; B: Adjusted overall survival curves of colon cancer patients with different primary tumor locations; Cox regression model controlling for sex, age, level of carcinoembryonic antigen, tumor size, stage, number of lymph node harvested, morphology, differentiation, mucus, vascular invasion, tumor deposit and adjuvant chemotherapy 图 1 不同原发部位结肠癌总生存曲线图 Figure 1 Overall survival curves of colon cancer patients with different primary tumor locations |
|
结肠癌的预后影响因素众多,主要有肿瘤分期及治疗方式等,而肿瘤部位对预后的影响一直存在争议[3-5]。近年来,有学者认为由于结肠不同的胚胎起源,解剖及生理功能存在差异,致使不同部位结肠对致癌因素的敏感度不同,因而可能存在不同的致癌机制,表现为不同的预后转归[6]。通过研究不同部位结肠癌的临床病理特征及预后差异有利于揭示结肠癌不同的肿瘤生物学行为及个体化评价患者预后,从而为结肠癌制定更加合理的治疗提供依据。
流行病学方面,本研究中升结肠组患者平均年龄最大,为(61.1±12.3)岁,其他组患者平均年龄则不足60岁;另外,升结肠组女性患者所占比例最高,为47%,而降结肠组该比例最低,仅为33.3%。这与Wray等[7]报道结果相似,其统计的美国加利福利亚癌症登记中心82 926例结肠癌患者发现,升结肠癌及横结肠癌患者中高龄患者及女性患者更多见,升结肠癌患者平均年龄较乙状结肠癌患者高5岁(74岁vs. 69岁),女性患者比例升结肠癌及横结肠癌均较乙状结肠癌多8%(54% vs. 46%)。
临床病理特征方面,本研究中升结肠组和横结肠组肿瘤中黏液分泌、低分化及未分化和脉管瘤栓比例均显著高于降结肠组及乙状结肠组,差异均有统计学意义(P=0.000或P=0.001)。Benedix等[8]统计17 641例结肠癌结果同样发现,右半结肠癌中分化差、印戒细胞癌及黏液腺癌所占比例均显著高于左半结肠癌患者。有研究发现右半结肠癌组织中黏蛋白相关抗原表达显著高于左半结肠癌,可能是右半结肠癌中黏液腺癌比例更高的原因[9]。也有学者认为,黏蛋白的产生是体细胞微卫星不稳定性(microsatellite instability, MSI)肿瘤的特性,而统计显示MSI在升结肠癌及横结肠癌中多见,因此该部位患者黏液腺癌和印戒细胞癌多见[10]。另外,本研究中升结肠组和横结肠组淋巴结检出数目显著高于降结肠组及乙状结肠组,这可能与左、右半结肠癌根治术切除的肠管长度、系膜面积不同相关。
本研究生存分析显示升结肠、横结肠、降结肠和乙状结肠组患者5年总生存率分别为:71.4%、75.4%、73.5%和79.7%,差异有统计学意义(P=0.001)。为排除影响预后的其他干扰因素,进一步将各种影响因素带入Cox回归模型,经调整后发现肿瘤部位是独立的预后影响因素,乙状结肠组患者预后显著优于其他组,与升结肠组患者相比,死亡风险下降32%。根据肿瘤分期进行分层分析显示Ⅰ/Ⅱ期乙状结肠组预后略差于升结肠组,而Ⅲ期预后略优,但各组差异无统计学意义,Ⅳ期乙状结肠组预后显著优于升结肠组。本研究结果提示早期各部位结肠癌预后相似,未体现显著差异,而晚期结肠癌中乙状结肠癌预后最好。Meguid等[11]对不同期别不同部位结肠癌患者进行生存分析显示,Ⅰ期左、右半结肠癌预后相似,Ⅱ期右半结肠是预后的有利因素;Ⅲ/Ⅳ期右半结肠癌预后显著差于左半结肠癌。Price等[12]报道2 972例Ⅳ期结直肠癌患者同样发现右半结肠癌患者预后显著差于左半结肠癌,两组中位生存期分别为9.6月和20.3月。Yokota等[6]分析认为,不同部位结肠癌显著的不良预后可能与其不同的发病机制有关,升结肠癌CpG岛甲基化表型及BRAF基因突变概率更高,而CpG岛甲基化表型及BRAF基因突变正是影响预后的危险因素。
综上所述,不同部位结肠癌在临床病理学特征及预后方面均存在显著差异。在当前肿瘤个体化治疗时代,肿瘤学医师应区别地认识不同部位的结肠癌患者,根据其不同的生物学行为,个体化评价患者预后,以期获得更精准、更个体化的治疗,从而使结肠癌患者受益。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | Holch JW, Ricard I, Stintzing S, et al. The relevance of primary tumour location in patients with metastatic colorectal cancer: A meta-analysis of first-line clinical trials[J]. Eur J Cancer, 2017, 70: 87–98. DOI:10.1016/j.ejca.2016.10.007 |
| [3] | Moritani K, Hasegawa H, Okabayashi K, et al. Difference in the recurrence rate between right- and left-sided colon cancer: a 17-year experience at a single institution[J]. Surg Today, 2014, 44(9): 1685–91. DOI:10.1007/s00595-013-0748-5 |
| [4] | Weiss JM, Pfau PR, O'Connor ES, et al. Mortality by stage for right-versus left-sided colon cancer: analysis of surveillance, epidemiology, and end results-Medicare data[J]. J Clin Oncol, 2011, 29(33): 4401–9. DOI:10.1200/JCO.2011.36.4414 |
| [5] | Powell AG, Wallace R, McKee RF, et al. The relationship between tumour site, clinicopathological characteristics and cancer-specific survival in patients undergoing surgery for colorectal cancer[J]. Colorectal Dis, 2012, 14(12): 1493–9. DOI:10.1111/codi.2012.14.issue-12 |
| [6] | Yokota T, Ura T, Shibata N, et al. BRAFmutationisa powerful prognostic factor in advanced and recurrent colorectal cancer[J]. Br J Cancer, 2011, 104(5): 856–62. DOI:10.1038/bjc.2011.19 |
| [7] | Wray CM, Ziogas A, Hinojosa MW, et al. Tumor subsite location within the colon is prognostic for survival after colon cancer diagnosis[J]. Dis Colon Rectum, 2009, 52(8): 1359–66. DOI:10.1007/DCR.0b013e3181a7b7de |
| [8] | Benedix F, Kube R, Meyer F, et al. Comparison of 17, 641 patients with right- and left-sided colon cancer: differences in epidemiology, perioperativecourse, histology, and survival[J]. Dis Colon Rectum, 2010, 53(1): 57–64. DOI:10.1007/DCR.0b013e3181c703a4 |
| [9] | Bara J, Nardelli J, Gadenne C, et al. Differences in the expression of mucus-associated antigens between proximal and distal human colon adenocarcinomas[J]. Br J cancer, 1984, 49(4): 495–501. DOI:10.1038/bjc.1984.77 |
| [10] | Roth AD, Delorenzi M, Tejpar S, et al. Integrated analysis of molecular and clinical prognostic factors in stage Ⅱ/Ⅲ colon cancer[J]. J Natl Cancer Inst, 2012, 104(21): 1635–46. DOI:10.1093/jnci/djs427 |
| [11] | Meguid RA, Slidell MB, Wolfgang CL, et al. Is there a difference in survival between right-versus left-sided colon cancers?[J]. Ann Surg Oncol, 2008, 15(9): 2388–94. DOI:10.1245/s10434-008-0015-y |
| [12] | Price TJ, Beeke C, Ullah S, et al. Does the primary site of colorectal cancer impact outcomes for patients with metastatic disease?[J]. Cancer, 2015, 121(6): 830–5. DOI:10.1002/cncr.v121.6 |
 2018, Vol. 45
2018, Vol. 45


