文章信息
- 2017年美国预防服务工作组甲状腺癌筛查推荐声明解读
- An Interpretation of Screening for Thyroid Cancer: US Preventive Services Task Force Recommendation Statement in 2017
- 肿瘤防治研究, 2018, 45(9): 710-714
- Cancer Research on Prevention and Treatment, 2018, 45(9): 710-714
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1698
- 收稿日期: 2018-01-02
- 修回日期: 2018-05-28
2. 454000 焦作,焦作市人民医院肿瘤内科;
3. 100021 北京,国家癌症中心北京协和医学院中国医学科学院肿瘤医院头颈外科
2. Department of Medical Oncology, The People's Hospital of Jiaozuo, Jiaozuo 454000, China;
3. Department of Head and Neck Surgery, Cancer Hospital, Peking Union Medical College, Chinese Academy of Medical Sciences, Beijing 100021, China
2017年美国预防服务工作组(US Preventive Services Task Force, USPSTF)基于最新证据对1996年USPSTF推荐进行了更新,与1996年推荐一致,反对应用颈部触诊和超声对无症状成人行甲状腺癌筛查(推荐级别D)[1]。近年来我国甲状腺癌的发病率呈现增高趋势,非必要的甲状腺结节手术率也显著升高,甲状腺结节的过度诊断和过度治疗问题日益突出[2-5]。
1 甲状腺癌诊疗的现状甲状腺结节为常见的临床问题。碘充足地区人群中通过触诊的检出率女性为5%,男性为1%。随机人群借助高分辨率超声的检出率为19%~68%,其中7%~15%为甲状腺癌。1975年美国的甲状腺癌发病率为4.9/10万人,之后逐渐增长,2013年为15.3/10万人。1997—2009年甲状腺癌的发病率每年增长6.7%[6]。但是近年来(2009—2013年)增长率放慢至2.1%。与此同时,死亡率每年仅增加了0.7/10万人[6]。大多数甲状腺癌预后良好,五年生存率为98.1%。与美国相似,世界其他国家的甲状腺癌发病率也迅速增加,成为发病率增加最快的恶性肿瘤。
2003—2007年中国甲状腺癌发病率和死亡率呈上升趋势,每年分别以14.51%和1.42%的速度上升[7]。2014年我国甲状腺癌的发病率为12.40/10万人,中标发病率为9.29/10万人,为女性肿瘤的第四位。在30岁以下的女性中,甲状腺癌为最常见的恶性肿瘤[8]。预计2015年,中国将有9.00万甲状腺癌新发病例,死亡人数为0.68万人[9]。人口老龄化、不健康的生活方式、医疗保险的覆盖率增加及医疗技术的进步可能是甲状腺癌发病率升高的原因,但尚缺乏相应的证据。目前我国整体的甲状腺癌诊治水平较欧美发达国家存在着一定差距,指南共识多采用国外数据制定。医疗资源地区分布不均,诊疗水平参差不齐,尚需要全国范围内推广甲状腺细针穿刺活检和甲状腺癌的规范治疗等诊疗技术。
2 USPSTF推荐声明及更新2017年USPSTF推荐声明:反对无症状人群行甲状腺癌筛查。但不适用于伴有声音嘶哑、疼痛、吞咽困难和其他咽喉症状的患者,也不适用于颈部肿物、颈部肿大和颈部不对称及其他原因需要颈部检查的患者。同样不适用于因电离辐射暴露史(医学治疗和核辐射)而使甲状腺癌风险增加的人群,特别是低碘饮食人群、与甲状腺癌相关的遗传基因综合征(如家族性腺瘤肌肉病)或者一级亲属有甲状腺癌史的人群[10-11]。
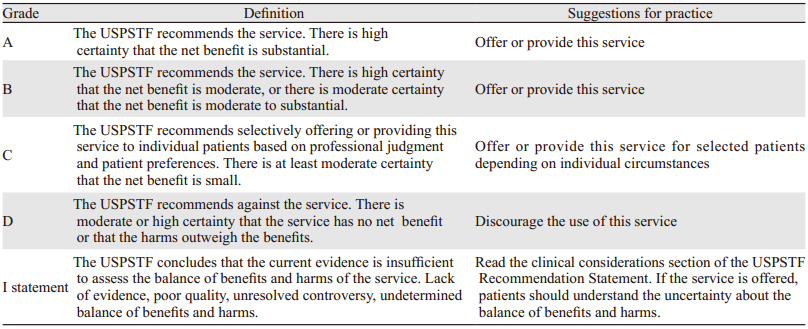
1996年USPSTF推荐婴幼儿时期上身(主要是头颈部)有外放射史的无症状成人行甲状腺癌筛查(推荐级别C定义为无充分证据的推荐或者反对)。2017年更新虽然推荐级别依然为C,但C的定义发生了改变,见表 1。与1996年相比,指南没有改变其余无症状人群筛查的态度。
应用颈部触诊或超声行甲状腺癌筛查的准确性证据是有限的,每种筛查方法只有两项适用研究,在筛查人群中采用同一参考标准来比较这两种筛查方法。两项来自芬兰的高质量前瞻性研究显示颈部触诊对甲状腺结节的诊断敏感度低[12-13]。一项随机选择成人(n=253)的研究,5.1%颈部检查发现异常(甲状腺结节或弥漫性增大),其特异性和敏感度分别为11.6%(95%CI: 5.1%~21.6%)和97.3%(95%CI: 93.8%~99.1%)[12, 14]。另一项关于接受乳腺摄影女性人群的甲状腺癌筛查研究(n=101)显示甲状腺超声有异常发现的女性,颈部触诊发现甲状腺结节的敏感度为27.8%(颈部触诊阴性的女性未随访,因而假阳性率无法评估)[13-14]。
两项基于韩国人群的高质量研究,报道了仅采用超声筛查的诊断准确性[15-16]。一项前瞻性研究(n=2 079接受筛查,113名接受了细针穿刺活检术)显示超声筛查发现1项或者更多的恶性特征(微钙化或形状不规则)的敏感度和特异性分别为94.3%(95%CI: 84.3%~98.8%)和55.0%(95%CI: 41.6%~67.9%)。另一项回顾性研究分析了1 009名患者基于超声发现(2项高危超声特征)筛查出130名无症状成人行细针穿刺活检术,结果显示敏感度和特异性分别为94.8%和86.6%(计算每一个甲状腺结节而不是每一名患者)。但是这个研究没有随访超声阴性的患者,因而可能过度评估了超声的敏感度。
甲状腺细针穿刺细胞学是术前评估甲状腺结节性质敏感度、特异性最高的方法,为国内外指南所推荐,以减少过度治疗的概率。2015年美国甲状腺学会《成人甲状腺结节与分化型甲状腺癌诊治指南》指出,直径≤1.0 cm高度可疑恶性的甲状腺结节,推荐密切随访,不主张行积极的细针穿刺活检。我国指南则相对温和,2018年《超声引导下甲状腺结节细针穿刺活检专家共识及操作指南》指出:直径≤1.0 cm无高危因素的甲状腺结节,不推荐常规行穿刺活检。学术界对于细针穿刺活检的态度也趋向于保守。
4 筛查相关早期诊断和治疗的获益USPSTF推荐认为,对无症状人群行甲状腺癌筛查,无论是通过颈部触诊还是超声检查,均无获益的明确证据。除罕见类型甲状腺癌,患者治疗和随访的获益无明显差异。观察到的证据显示,引入基于人群的筛查系统后死亡率并没有改变。
没有研究直接对比筛查人群与未筛查人群的预后。也没有随机试验评估接受早期治疗和筛查相关治疗的分化型甲状腺癌患者的预后是否优于观察组(推迟或不治疗)[11]。仅有两项观察性研究(发表于5篇文献[17-21])符合早期诊断获益的纳入标准。一项高质量的回顾性观察研究,比较了1973—2005年甲状腺乳头状癌治疗组(n=35 663)和未治疗组患者(n=440)的生存率[16]。总的来说,与治疗组相比未治疗组患者20年生存率稍差(97% vs. 99%, P < 0.001)。但是这些研究没有调整潜在的混杂因素。另一项由日本主导的高质量的前瞻性研究报道两个独立队列(1993—2004年和2005—2013年)的乳头状微小癌的复发和生存率[18-21]。第一队列,1 055名患者选择接受即刻手术治疗而340人选择观察,大约随访6年后,观察组患者的32.1%接受了手术治疗,即刻手术组的2名患者死亡而观察组无患者死亡;第二队列,974名患者选择即刻手术治疗,1 179名患者选择了积极观察,大约随访4年后,8%积极观察组的患者选择了手术治疗,两组均没有出现远处转移和相关死亡。因为两个研究缺乏混杂因素的调整,所以不能确定早期即刻治疗与延迟治疗和非手术治疗相比,在改善甲状腺乳头状癌和微小癌患者预后方面是否存在差异。
国内学者周鑫等[22]采用秩和检验比较甲状腺癌患者性别、年龄、治疗方法等对患者生存质量等级高低的影响是否存在差异,结果显示:治疗方法(手术与非手术)对甲状腺癌生存质量等级的影响差异无统计学意义(χ2=-0.481, P=0.631)。积极的手术治疗并未显著改善甲状腺癌患者的生活质量。
5 筛查相关早期诊断和治疗的潜在危害目前缺乏关于筛查危害的充分直接证据,但考虑甲状腺癌治疗危害的充足证据以及过度诊断和过度治疗可能会因人群筛查而大量出现的直接证据,USPSTF建议适当控制筛查和治疗的总体危害。
没有研究直接调查颈部触诊和超声甲状腺筛查的危害。总体来说,甲状腺癌筛查的危害证据非常有限,包括细针穿刺活检的危害(住院治疗,术后血肿,针道种植)[11, 23-24]。USPSTF发现了36项关于手术危害的高质量研究,32项关于永久甲状旁腺功能减退(低钙血症),28项关于永久性喉返神经麻痹(声带麻痹),2项关于手术死亡率,15项关于其他主要的手术危害。这些大多数为回顾性观察研究,仅3项为随机研究[14]。队列规模从76人到13 854人不等。
大量证据表明了外科治疗和放射性碘治疗的危害。永久性甲状旁腺功能减退的发生率差异较大(15个研究组),预计每100台甲状腺手术出现2~6例永久甲状旁腺功能减退,若伴淋巴结清扫术则发生率差异较大。永久性喉返神经麻痹的发生率差异较小(14个研究组),预计每100例手术(包括或不包括淋巴结清扫)出现1~2例。16项高质量的研究(n=94 823)证明了放射性碘清甲和治疗的潜在危害[14]。预计每年,每10 000人有12~13人出现继发性肿瘤[14, 25-26],每100人有2.3~21人出现唾液腺损害(例如口干)[14, 27-32]。
6 甲状腺癌是否存在过度诊断甲状腺癌具有惰性生长的生物学性质,即使发生了局部淋巴结转移,复发率和死亡率都极低。肿瘤学界将甲状腺癌发病率持续升高而死亡率却保持稳定的特殊现象定义为“过度诊断”[33]。
尽管没有筛查导致过度诊断的直接证据。生态和横截面数据显示甲状腺癌筛查导致甲状腺癌发病率增加,但甲状腺癌的死亡率并没有因此改变[10]。同样的情况也出现在我国[7, 9]。甲状腺癌过度诊断的最佳生态学证据来自韩国,他们从1999年开始建立了有组织的肿瘤筛查系统[34]。尽管这个系统并没有正式包括甲状腺癌筛查,但是临床医生经常只需要额外很少费用就可以提供超声的甲状腺癌筛查。2011年,甲状腺癌的诊断率是1993年的15倍,但甲状腺癌相关的死亡率却保持稳定。甲状腺癌的发病率与韩国成人接受甲状腺癌筛查的比例呈正相关[34]。
尸检研究为甲状腺癌过度诊断提供了另外的证据。2014年Lee等[35]总结了1969年至2005年关于尸检发现潜在甲状腺癌的15项研究。从8 619例甲状腺标本中,检出了989(11.5%)例甲状腺乳头状癌,其中大多数为微小癌(直径小于1 mm~3 mm)。
7 USPSTF的结论USPSTF没有发现筛查获益和筛查危害的充分直接证据,但可以确定的是筛查和治疗的整体获益极小,而且应适度限制筛查和治疗的总体危害。另外发现了治疗危害的充分证据和基于人口筛查导致大量的过度诊断和过度治疗的间接证据。除了甲状腺罕见肿瘤,治疗和随访的预后没有明显差异。观察数据显示随着肿瘤筛查系统的引入,死亡率并没有改变。因而,USPSTF中等水平确定甲状腺癌筛查的净获益为阴性。
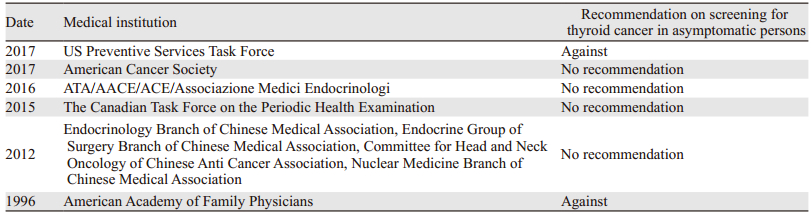
8 思考国外的经验教训及我国的数据迫使中国学者思考:如何解决我国面临的甲状腺癌“过度诊断”和“过度治疗”的风险[3-4]。2016年《甲状腺微小乳头状癌诊断与治疗专家共识》指出:对于低危的甲状腺微小乳头状癌患者,严格选择指征并充分结合患者意愿,可采取密切观察的处理。这些并不符合我国“早发现,早诊断,早治疗”肿瘤防治的基本策略。不可否认国内外对于甲状腺癌治疗的态度趋向于谨慎和保守。肿瘤筛查是肿瘤防治策略“早发现”的重要环节,但是否推荐无症状人群行甲状腺癌筛查仍存在较大争议。我国甲状腺癌有自己的发病特点,国外的推荐指南未必完全适用于我国国情,见表 2。但甲状腺癌发病率的明显升高和超声普及带来的甲状腺手术量增加的趋势和国外基本一致,我们应积极进行相关研究,制定基于我国临床特点的甲状腺癌筛查建议,减少过度诊断和过度治疗所带来的危害。
|
| [1] | US Preventive Services Task Force, Bibbins-Domingo K, Grossman DC, et al. Screening for Thyroid Cancer: US Preventive Services Task Force Recommendation Statement[J]. JAMA, 2017, 317(18): 1882–7. DOI:10.1001/jama.2017.4011 |
| [2] | 中华医学会内分泌学分会, 中华医学会外科学分会内分泌学组, 中国抗癌协会头颈肿瘤专业委员会, 等. 甲状腺结节和分化型甲状腺癌诊治指南[J]. 中华核医学与分子影像杂志, 2013, 33(2): 96–115. [ Endocrinology branch of Chinese Medical Association, Endocrine Group of Surgery Branch of Chinese Medical Association, Committee for Head and Neck Oncology of Chinese Anti Cancer Association, et al. Guidelines for the diagnosis and treatment of thyroid nodules and differentiated thyroid carcinoma[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2013, 33(2): 96–115. DOI:10.3760/cma.j.issn.2095-2848.2013.02.003 ] |
| [3] | 史晓光, 杨雯晴, 滕卫平. 甲状腺癌的"过度诊断"和"过度治疗"[J]. 中华内分泌代谢杂志, 2016, 32(6): 443–7. [ Shi XG, Yang WQ, Teng WP. "Overdiagnosis" and "overtreatment" in thyroid cancer[J]. Zhonghua Nei Fen Mi Dai Xie Za Zhi, 2016, 32(6): 443–7. DOI:10.3760/cma.j.issn.1000-6699.2016.06.002 ] |
| [4] | 伍波, 樊友本. 我国甲状腺癌治疗现状:不足、不规范和过度并存[J]. 浙江医学, 2017, 56(1): 857–9. [ Wu B, Fan YB. Comments on management of thyroid carcinoma in China: over-treatment, inadequate and irregular treatment[J]. Zhejiang Yi Xue, 2017, 56(1): 857–9. ] |
| [5] | 庹吉妤, 张敏, 常江, 等. 2012年湖北省肿瘤登记地区恶性肿瘤发病与死亡情况分析[J]. 肿瘤防治研究, 2016, 43(11): 974–9. [ Tuo JY, Zhang M, Chang J, et al. Cancer Incidence and Mortality in Cancer Registries in Hubei Province, 2012[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(11): 974–9. DOI:10.3971/j.issn.1000-8578.2016.11.011 ] |
| [6] | Howlader N, Noone A, Krapcho M, et al. SEER Cancer Statistics Review, 1975-2013, National Cancer Institute. Bethesda, MD[EB/OL]. (2016-09-12)[2017-08-01]. https://seer.cancer.gov/archive/csr/1975_2013/. |
| [7] | 刘玉琴, 张书全, 陈万青, 等. 中国2003-2007年甲状腺癌发病死亡现状及流行趋势分析[J]. 中华流行病学杂志, 2012, 33(10): 1044–8. [ Liu YQ, Zhang SQ, Chen WQ, et al. Trend of incidence and mortality on thyroid cancer in China during 2003-2007[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2012, 33(10): 1044–8. DOI:10.3760/cma.j.issn.0254-6450.2012.10.011 ] |
| [8] | 陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 27(1): 1–14. [ Chen WQ, Sun KX, Zheng RS, et al. Report of Cancer Incidence and Mortality in Different Areas of China, 2014[J]. Zhongguo Zhong Liu, 2018, 27(1): 1–14. ] |
| [9] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. Ca A Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [10] | American Cancer Society.Thyroid cancer risk factors[EB/OL].[2017/8/13]. https://www.cancer.org/cancer/thyroid-cancer/causes-risks-prevention/risk-factors.html. |
| [11] | Lin JS, Bowles EJA, Williams SB, et al. Screening for thyroid cancer: updated evidence report and systematic review for the us preventive services task force[J]. JAMA, 2017, 317(18): 1888–903. DOI:10.1001/jama.2017.0562 |
| [12] | Brander A, Viikinkoski P, Nickels J, et al. Thyroid gland: US screening in a random adult population[J]. Radiology, 1991, 181(3): 683–7. DOI:10.1148/radiology.181.3.1947082 |
| [13] | Brander A, Viikinkoski P, Nickels J, et al. Thyroid gland: US screening in middle-aged women with no previous thyroid disease[J]. Radiology, 1989, 173(2): 507–10. DOI:10.1148/radiology.173.2.2678263 |
| [14] | Lin JS, Aiello Bowles EJ, Williams SB, et al. Screening for Thyroid Cancer: A Systematic Review for the US Preventive Services Task Force[M]. Rockville, MD: Agency for Healthcare Research and Quality, 2017: 13-25. |
| [15] | Kim JY, Lee CH, Kim SY, et al. Radiologic and pathologic findings of nonpalpable thyroid carcinomas detected by ultrasonography in a medical screening center[J]. J Ultrasound Med, 2008, 27(2): 215–23. DOI:10.7863/jum.2008.27.2.215 |
| [16] | Kim SJ, Moon WK, Cho N. Sonographic criteria for fine-needle aspiration cytology in a Korean female population undergoing thyroid ultrasound screening[J]. Acta Radiol, 2010, 51(5): 475–81. DOI:10.3109/02841851003641834 |
| [17] | Davies L, Welch HG. Thyroid cancer survival in the United States: observational data from 1973 to 2005[J]. Arch Otolaryngol Head Neck Surg, 2010, 136(5): 440–4. DOI:10.1001/archoto.2010.55 |
| [18] | Ito Y, Miyauchi A, Inoue H, et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients[J]. World J Surg, 2010, 34(1): 28–35. DOI:10.1007/s00268-009-0303-0 |
| [19] | Ito Y, Uruno T, Nakano K, et al. An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid[J]. Thyroid, 2003, 13(4): 381–7. DOI:10.1089/105072503321669875 |
| [20] | Ito Y, Miyauchi A, Kihara M, et al. Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation[J]. Thyroid, 2014, 24(1): 27–34. DOI:10.1089/thy.2013.0367 |
| [21] | Oda H, Miyauchi A, Ito Y, et al. Incidences of unfavorable events in the management of low-risk papillary microcarcinoma of the thyroid by active surveillance versus immediate surgery[J]. Thyroid, 2016, 26(1): 150–5. DOI:10.1089/thy.2015.0313 |
| [22] | 周鑫, 杨小平, 何怡, 等. 常州市金坛区2003-2014年甲状腺癌患者生存状况及其影响因素[J]. 中国慢性病预防与控制, 2017, 25(1): 9–12. [ Zhou X, Yang XP, He Y, et al. The living condition and influencing factors in patients with thyroid carcinoma during 2003-2014 in Jintan district of Changzhou city[J]. Zhongguo Man Xing Bing Yu Fang Yu Kong Zhi, 2017, 25(1): 9–12. ] |
| [23] | Abu-Yousef MM, Larson JH, Kuehn DM, et al. Safety of ultrasound-guided fine needle aspiration biopsy of neck lesions in patients taking antithromboticanticoagulant medications[J]. Ultrasound Q, 2011, 27(3): 157–9. DOI:10.1097/RUQ.0b013e31822b5681 |
| [24] | Ito Y, Tomoda C, Uruno T, et al. Needle tract implantation of papillary thyroid carcinoma after fine-needle aspiration biopsy[J]. World J Surg, 2005, 29(12): 1544–9. DOI:10.1007/s00268-005-0086-x |
| [25] | Brown AP, Chen J, Hitchcock YJ, et al. The risk of second primary malignancies up to three decades after the treatment of differentiated thyroid cancer[J]. J Clin Endocrinol Metab, 2008, 93(2): 504–15. DOI:10.1210/jc.2007-1154 |
| [26] | Iyer NG, Morris LG, Tuttle RM, et al. Rising incidence of second cancers in patients with low-risk (T1N0) thyroid cancer who receive radioactive iodine therapy[J]. Cancer, 2011, 117(19): 4439–46. DOI:10.1002/cncr.26070 |
| [27] | Grewal RK, Larson SM, Pentlow CE, et al. Salivary gland side effects commonly develop several weeks after initial radioactive iodine ablation[J]. J Nucl Med, 2009, 50(10): 1605–10. DOI:10.2967/jnumed.108.061382 |
| [28] | Hyer S, Kong A, Pratt B, et al. Salivary gland toxicity after radioiodine therapy for thyroid cancer[J]. Clin Oncol (R Coll Radiol), 2007, 19(1): 83–6. DOI:10.1016/j.clon.2006.11.005 |
| [29] | Ish-Shalom S, Durleshter L, Segal E, et al. Sialochemical and oxidative analyses in radioactive I131-treated patients with thyroid carcinoma[J]. Eur J Endocrinol, 2008, 158(5): 677–81. DOI:10.1530/EJE-07-0634 |
| [30] | Ryu CH, Ryu J, Ryu YM, et al. Administration of Radioactive Iodine Therapy Within 1 Year After Total Thyroidectomy Does Not Affect Vocal Function[J]. J Nucl Med, 2015, 56(10): 1480–6. DOI:10.2967/jnumed.115.161463 |
| [31] | Solans R, Bosch JA, Galofré P, et al. Salivary and lacrimal gland dysfunction (sicca syndrome) after radioiodine therapy[J]. J Nucl Med, 2001, 42(5): 738–43. |
| [32] | Jeong SY, Kim HW, Lee SW, et al. Salivary gland function 5 years after radioactive iodine ablation in patients with differentiated thyroid cancer: direct comparison of pre-and postablation scintigraphies and their relation to xerostomia symptoms[J]. Thyroid, 2013, 23(5): 609–16. DOI:10.1089/thy.2012.0106 |
| [33] | Esserman LJ, Thompson IM, Reid B, et al. Addressing overdiagnosis and overtreatment in cancer: a prescription for change[J]. Lancet Oncol, 2014, 15(6): e234–42. DOI:10.1016/S1470-2045(13)70598-9 |
| [34] | Ahn HS, Kim HJ, Welch HG. Korea's thyroid-cancer "epidemic"--screening and overdiagnosis[J]. N Engl J Med, 2014, 371(19): 1765–7. DOI:10.1056/NEJMp1409841 |
| [35] | Lee YS, Lim H, Chang HS, et al. Papillary thyroid microcarcinomas are different from latent papillary thyroid carcinomas at autopsy[J]. J Korean Med Sci, 2014, 29(5): 676–9. DOI:10.3346/jkms.2014.29.5.676 |
 2018, Vol. 45
2018, Vol. 45