文章信息
- 重离子辐照对人舌鳞癌CAL27细胞的生物学效应及其分子机制
- Biological Effect and Molecular Mechanism of Heavy Ion Irradiation on Human Tongue Squamous Cell Carcinoma CAL27 Cells
- 肿瘤防治研究, 2018, 45(8): 523-527
- Cancer Research on Prevention and Treatment, 2018, 45(8): 523-527
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1673
- 收稿日期: 2017-12-26
- 修回日期: 2018-04-10
2. 730030兰州,西北民族大学口腔医学国家民委重点实验室;
3. 730030兰州,兰州大学第二医院口腔颌面外科
2. Key Lab of Stomatology of State Ethnic Affairs Commission, Northwest University for Nationalities, Lanzhou 730030, China;
3. Department of Oral and Maxillofical Surgery, Lanzhou University Second Hospital, Lanzhou 730030, China
重离子束是一种高传能线密度(linear energy transfer, LET)的射线,具有良好的深度剂量分布和较高的相对生物学效应,是目前临床放射治疗肿瘤最具前景的方法[1-2]。相比较常规射线及电子束,具有深度分布剂量好、实现肿瘤靶向辐照等巨大优势,是一种可保护周围正常细胞的理想照射方式。本研究通过不同剂量重离子束对人舌鳞癌CAL27细胞进行辐照,探讨重离子对CAL27细胞增殖、凋亡、细胞周期、迁移、侵袭及P53、P56相关蛋白表达的影响,为重离子在口腔癌的进一步应用提供可靠依据。
1 材料与方法 1.1 主要试剂与仪器HF90 Heal Force培养箱(中国上海力申科学仪器有限公司);超低温冰箱(Thermo Scientific, 美国);HR-150AZ型精密电子天平(AND, 日本);CX31型倒置相差显微镜(日本Olympus公司);L420台式低速离心机(中国长沙湘仪离心机仪器有限公司);荧光倒置显微镜(日本Olympus公司);FACSCanto流式细胞仪(美国BD公司);Countstar全自动细胞计数仪(中国上海睿钰生物科技有限公司);RPMI 1640培养基(美国Gibco公司);青霉素-链霉素溶液(上海碧云天生物技术有限公司);胰蛋白酶(美国Sigma公司);胎牛血清(FBS,以色列BI公司);FITC偶联Annexin-V凋亡检测试剂盒;兔抗人P53、P65、VEGF抗体(美国Abcam公司);人舌鳞癌细胞CAL27(上海交通大学第九人民医院口腔科)。
1.2 细胞培养人舌鳞癌CAL-27细胞用含10%胎牛血清、1%青/链霉素的RPMI 1640培养液,在37℃、5%CO2的培养箱中常规培养,取对数生长期的细胞进行实验。
1.3 辐照条件12C6+重离子束辐照于中国科学院兰州分院近代物理研究所HIRFL重离子终端进行,辐照能量为250 MeV,LET 75 keV,剂量率约为1 Gy/min。空白对照组辐照剂量为0,重离子辐照分为三组,参照参考文献[3]将各组辐照剂量分别设为1、2、4 Gy。用空气电离室监测剂量,样品更换、辐照时间和剂量的数据获取由计算机控制。
1.4 MTT实验检测细胞抑制率取对数生长期细胞在辐照前48 h接种到直径35 mm的培养皿中(1×105个/皿),以0、1、2、4 Gy剂量12C6+离子照射,将辐照后的细胞用胰酶消化计数,以每孔2.5×104个细胞接种至96孔板,每组设6孔重复;分别孵育12、24、48 h后,每孔加入10 μl MTT溶液,孵育4 h后,小心弃去上清液,加入100 μl DMSO,水平摇床振荡15 min,全程避光处理。于490 nm波长处测定吸光度。细胞存活抑制率=(OD实验组-OD空白组)/(OD对照组-OD空白组)。
1.5 Transwell细胞迁移实验取经0、1、2、4 Gy辐照的每毫升5×105个无血清细胞悬液,将400 μl该悬液加入Transwell上室,24孔板中加入600 μl含20%血清的RPMI 1640培养液,培养48 h后,用棉棒轻轻拭去上室细胞,甲醇固定30 min,结晶紫染色5 min,PBS洗涤3次,镜下随机选取5个视野进行结果观察[4]。细胞迁移抑制率=(对照组迁移细胞数-实验组迁移细胞数)/对照组迁移细胞数×100%。
1.6 Transwell细胞侵袭实验取经0、1、2、4 Gy辐照的每毫升1×106个无血清细胞悬液,将200 μl该悬液加入Transwell上室,24孔板中加入500 μl含10%血清的RPMI 1640培养液,培养24 h后,用棉棒轻轻拭去上室细胞,甲醇固定30 min,结晶紫染色5 min,PBS洗涤3次,倒置显微镜下随机选取5个视野计数并拍照。细胞侵袭抑制率=(对照组侵袭细胞数-实验组侵袭细胞数)/对照组侵袭细胞数×100%
1.7 流式细胞术检测细胞凋亡取经0、1、2、4 Gy辐照的每毫升5×104个细胞悬液,常规培养48 h后消化、离心、PBS洗涤两次,弃上清液;一份加入100 μl Binding Buffer重悬,依次加入FITC标记AnnexinV 5 μl、PI 5 μl,避光15 min,转至流式检测管,加入400 μl PBS,上机进行凋亡检测;另一份依次加入PI染夜l ml(1g/L),室温避光放置30 min,上机进行细胞凋亡检测。
1.8 流式细胞术检测细胞周期前期细胞处理提取过程同1.6;4℃预冷,75%乙醇固定过夜,含RNase及PI的染液染色30 min,上流式细胞仪测定DNA含量的变化[5]。
1.9 划痕实验检测细胞迁移(1)取生长状态良好的细胞,用含0.1% BSA的RPMI 1640培养液调整细胞浓度为每毫升5×105个,接种于35 mm直径培养皿,无血清培养液饥饿培养24 h;(2)当细胞长到融合的细胞层,以200 μl无菌Tip头作3条平行划痕,在辐照前用PBS洗液轻轻洗去脱落细胞,Nikon倒置显微镜拍照;(3)使用重离子束进行辐照;(4)辐照后36 h,在相同位置用Nikon倒置显微镜进行拍照;(5)辐照前后的划痕区域相对距离采用Image J软件进行测定,计算划痕迁移率[6]。划痕迁移率=(T0时面积-Tt时面积)/T0时面积×100%。
1.9.1 克隆形成实验(1)辐照前一天,用0.25%的胰蛋白酶溶液将生长良好的CAL27细胞制备成单细胞悬液,将其接种于直径60 mm培养皿中,接种细胞数为2 000个,轻轻晃动培养皿使细胞均匀分散(每个剂量至少3皿);(2)置于37℃、5%CO2细胞培养箱中培养24 h,待贴壁后使用重离子束辐照;(3)辐照后立即置于37℃、5%CO2的细胞培养箱中培养14 d(每隔3d换一次液),待对照组出现克隆时终止培养,弃培养液,PBS洗2次,甲醇固定15 min后,Giemsa染液染色15 min,流水洗去染色液,空气中自然干燥;(4)对细胞培养皿中的克隆数进行计数,普通光学显微镜下集落细胞数 > 50个细胞计为1个克隆,克隆形成率使用3个培养皿的平均克隆数来进行评估[6]。
1.9.2 Western blot检测蛋白表达收集处理24 h后的各浓度组细胞,用RIPA裂解液冰上裂解细胞,提取总蛋白,BCA法测定蛋白含量。各样品取40 μg,经12%SDS-PAGE电泳分离后,转移至PVDF膜,5%脱脂奶粉(用TBST配制)封闭2 h,分别加入兔抗人P53、P65和VEGF一抗,4℃孵育过夜,TBST洗膜3次,每次10 min,加Dylight800标记羊抗兔二抗,室温下脱色,摇床上避光摇动孵育2 h,TBST洗膜3次,每次10 min。用Odyssey双色红外荧光扫描成像系统采集条带图像,使用Image J软件进行定量分析,以β-actin为内参。
1.10 统计学方法所有实验数据均采用SPSS22.0统计软件进行分析,计量数据以均数±标准差表示。P < 0.05为差异有统计学意义。
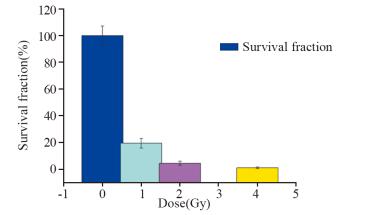
2 结果 2.1 细胞抑制率的测定MTT比色法显示,辐照剂量一定时,随时间的延长,细胞抑制率增加;时间一定时,随辐照剂量的增加,细胞抑制率增加,以4 Gy时增加最明显,时间-效应曲线见图 1。
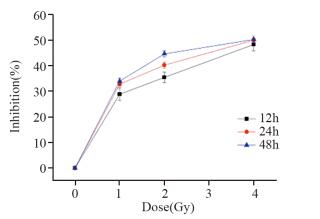
|
| 图 1 MTT法检测细胞生存抑制率 Figure 1 Proliferation inhibition rate of CAL27 cells detected by MTT assay |
结果表明,未辐照组中大量的CAL27细胞通过Transwell膜的孔隙迁移至膜的另一侧,而辐照后,CAL27细胞的迁移明显受到抑制,见图 2。经12C6+离子辐照,48 h后照射剂量在0、1、2、4 Gy时的迁移抑制率分别为0、28.34%、34.49%和42.57%。

|
| 图 2 采用Transwell迁移小室检测12C6+离子辐照后对CAL27细胞迁移的影响 Figure 2 Effect of 12C6+ ion irradiation on migration of CAL27 cells detected using Transwell migration chamber |
采用Transwell小室观察辐照对CAL27细胞侵袭活性的影响。结果表明,未辐照组中大量的CAL27细胞通过Transwell膜的孔隙侵袭至膜的另一侧,而经辐照后,CAL27细胞的侵袭明显受到抑制,见图 3。经12C6+离子辐照,24 h后辐照剂量在0、1、2、4 Gy时的侵袭抑制率分别为0、34.10%、45.46%和53.995%。
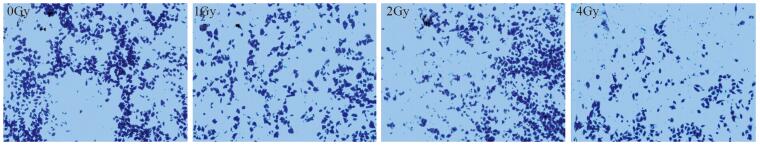
|
| 图 3 Transwell迁移小室检测12C6+离子辐照后对CAL27细胞侵袭的影响 Figure 3 Effect of 12C6+ ion irradiation on invasion of CAL27 cells detected using Transwell migration chamber |
12C6+离子辐照48 h后,辐照剂量在0、1、2、4 Gy组发生凋亡的细胞所占百分比分别为(1.875±0.4313)%,(8.44±0.4101)%,(10.01±1.4284)%, (14.25±1.4001)%;随着12C6+离子辐照剂量的增加,凋亡细胞所占比例增加,见图 4。
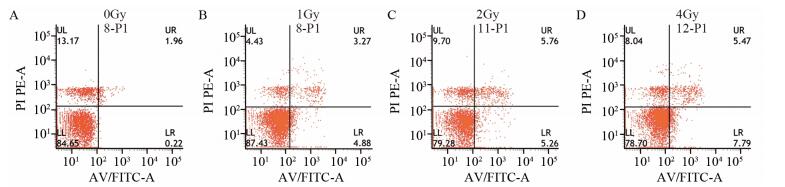
|
| 图 4 Annexin V/PI荧光探针和流式细胞仪检测12C6+离子辐照作用48h对CAL27细胞凋亡的影响 Figure 4 Effect of 12C6+ ion irradiation on apoptosis of CAL27 cells for 48h detected by Annexin V/PI fluorescence probe and flow cytometry |
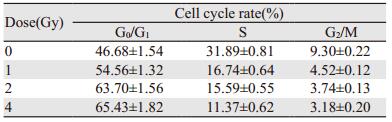
流式细胞仪检测结果显示,2、4 Gy组的CAL27细胞在G0/G1期所占细胞比率较0、1 Gy组高,并且4 Gy组出现明显的凋亡峰,见表 1。说明2、4 Gy组在12C6+离子辐照后,CAL27细胞复制停滞于G0/G1期,发生了细胞凋亡。
|
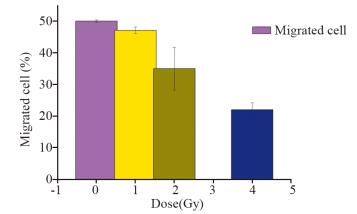
12C6+离子辐照36 h后,辐照剂量0、1、2、4 Gy的细胞穿过滤膜率分别为50.12%、47.17%、35.03%和21.99%。随着12C6+离子辐照剂量的增加,重离子束辐照降低了CAL27细胞的迁移能力,见图 5。
|
| 图 5 采用划痕实验检测12C6+离子辐照后对CAL27迁移的影响 Figure 5 Effect of 12C6+ ion irradiation on migration of CAL27 cells detected by scratch assay |
不同剂量12C6+离子辐照对CAL27细胞株的克隆形成能力均有显著的抑制效果,见图 6。
|
| 图 6 克隆实验检测12C6+辐照后对CAL27克隆形成能力的影响 Figure 6 Efect of 12C6+ irradiation on colony formation ability of CAL27 cells |
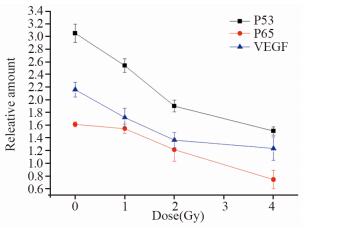
12C6+离子辐照24 h后,CAL27细胞株中P53、P65和VEGF的表达随剂量增加逐渐下降,见图 7。
|
| 图 7 重离子辐照后CAL27细胞24 h后P53、P65和VEGF蛋白表达量 Figure 7 Expression of P53, P65 and VEGF protein in CAL27 cells after heavy ion irradiation |
舌癌是最常见的口腔癌,多为鳞癌。常为溃疡型或浸润型。一般恶性程度较高、生长快、浸润性强,常波及舌肌,致舌运动受限。舌癌的治疗以综合疗法为主。其中放疗作为治疗舌癌的重要手段之一,可避免手术对组织的过度损伤和破坏,使得肿瘤部位的器官和功能得以保留,对于提高患者的生存质量具有重要意义,但常规放疗面临增强某些恶性肿瘤侵袭和转移能力的挑战[7-8],因此,寻求更优的放疗方式具有重大意义。
本研究通过MTT法检测不同时间段及不同剂量组12C6+离子束对人舌鳞癌CAL27细胞的作用,结果表明其对CAL27细胞具有明显的体外抑制作用,且呈现时间-剂量依赖性。
凋亡作为细胞死亡的重要方式之一,其过程受到基因程序化的调控。本实验通过流式细胞术检测12C6+离子束对CAL27细胞凋亡诱导情况,结果表明随着剂量的增加,其凋亡率显著性增加。同时,细胞周期检测结果显示2、4 Gy组G0/G1期所占细胞比率显著高于0、1 Gy组,使CAL27细胞发生G0/G1期阻滞,诱导细胞凋亡的发生;其生物学效应为重离子束引发DNA损伤,但具体机制仍不明确。
细胞迁移在血管新生及肿瘤转移等过程中起关键作用。本研究通过Transwell小室及划痕实验结果均表明12C6+离子束辐射能显著降低CAL27细胞迁移能力,可能与放射治疗可直接破坏肿瘤新生血管有关;同样Transwell小室实验显示,随着辐照剂量的增多,CAL27细胞的侵袭能力受到明显抑制。
P53基因作为常见的抑癌基因,在多种肿瘤中存在表达及突变,分为野生型P53和突变型P53。两者在肿瘤发生、发展的调控机制上存在明显差异。野生型P53可通过NF-κB及信号转导及转录刺激因子(single transducer and activators of tran-scription, STAT)等的表达来抑制IL-6、环氧合酶-2、诱导型一氧化氮合酶(inducible nitric oxide syn-thase, iNOS)等的产生与释放,进而抑制炎性反应的产生,最终抑制肿瘤的发生和转移。而NF-κB主要存在或表现形式为P65和P50,p65参与基因转录的起始调节,并可促进p50与DNA结合;当p65与细胞质内抑制蛋白IκB结合,可掩盖p50上核定位信号,对于促成肿瘤细胞发生发展具有重要作用[9-11]。本研究通过Western blot实验观察不同剂量处理后的CAL27细胞培养24 h后P53、P65、VEGF的蛋白表达量,结果显示随不同剂量的辐照,以上蛋白表达含量明显降低(P < 0.05),其蛋白含量的改变呈现出一定的剂量相关性。
综上,本研究初步证明重离子辐射对人舌鳞癌CAL27细胞增殖、凋亡、周期、迁移、侵袭及P53、P56、VEGF表达的影响,为重离子更好地应用于口腔舌鳞癌的治疗提供了一定依据。尽管目前重离子抗肿瘤已得到广泛认识,在肝癌、肺癌及口腔腺样囊性癌等多种肿瘤有所研究,且与其他放疗方式相比,其良好的剂量分布和靶向高生物学效应[12],以及对周围组织保护作用,我们应更进一步从分子通路去探究,使其更精准地用于肿瘤的治疗。
| [1] | 叶飞, 李强. 重离子治癌相关研究[J]. 原子核物理评论, 2010, 27(3): 309–16. [ Ye F, Li Q. Researches related to heavy Ion cancer therapy[J]. Yuan Zi He Wu Li Ping Lun, 2010, 27(3): 309–16. ] |
| [2] | Jingu K, Tsujii H, Mizoe JE, et al. Carbon ion radiation therapy improves the prognosis of unresectable adult bone and soft-tissue sarcoma of the head and neck[J]. Int J Radiat Oncol Biol Phys, 2012, 82(5): 2125–31. DOI:10.1016/j.ijrobp.2010.08.043 |
| [3] | 刘斌, 侯玮玮, 李宁, 等. 重离子诱导人舌鳞癌细胞凋亡和Bax/Bcl-2蛋白表达的变化[J]. 辐射研究与辐射工艺学报, 2009, 27(1): 5–9. [ Liu B, Hou WW, Li N, et al. Effects of carbon ions irradiation on apoptosis and Bax/Bcl-2 expression of squamous cell in carcinoma of tongue[J]. Fu She Yan Jiu Yu Fu She Gong Yi Xue Bao, 2009, 27(1): 5–9. DOI:10.3969/j.issn.1000-3436.2009.01.002 ] |
| [4] | 刘圆圆, 张红, 刘阳, 等. 重离子和X射线对人微血管内皮细胞血管生成的抑制作用[J]. 原子核物理评论, 2013, 30(1): 84–8. [ Liu YY, Zhang H, Liu Y, et al. Inhibitory Effect of 12C6+ Ion and X-ray on Angiogenesis in HMEC-1[J]. Yuan Zi He Wu Li Ping Lun, 2013, 30(1): 84–8. ] |
| [5] | 叶兰萍, 徐华, 苟海涛, 等. 重离子对人肝癌细胞细胞凋亡及bcl-2/bax基因表达的研究[J]. 兰州大学学报(医学版), 2006, 32(2): 1–3. [ Ye LP, Xu H, Gou HT, et al. Effects of heavy ion irradiation on apoptosis and bcl-2/bax expression in human hepatoma cell SMMC-7721[J]. Lanzhou Da Xue Xue Bao(Yi Xue Ban), 2006, 32(2): 1–3. DOI:10.3969/j.issn.1000-2812.2006.02.001 ] |
| [6] | 郑茜. 重离子束和X射线辐照对Tca-8113细胞迁移侵袭及生物力学的影响[D]. 兰州大学, 2014. [ Zheng Q. Effects of heavy ion beam and X-ray irradiation on the invasion and biomechanics of Tca-8113 cells[D]. Lanzhou Da Xue, 2014. ] http://cdmd.cnki.com.cn/Article/CDMD-10730-1014303836.htm |
| [7] | He M, Dong C, Ren R, et al. Radiation enhances the invasiveness of irradiated and nonirradiated bystander hepatoma cells through a VEGF-MMP2 pathway initiated by p53[J]. Radiat Res, 2013, 180(4): 389–97. DOI:10.1667/RR3355.1 |
| [8] | 郑军, 王小明, 杜婵媛, 等. 靶向抑制Rad50提高头颈部鳞癌细胞放疗敏感性的初步研究[J]. 实用口腔医学杂志, 2016, 32(2): 190–5. [ Zheng J, Wang XM, Du CY, et al. Targeted inhibition of Rad50 increases the radiosensitivity of head and neck squamous cell carcinoma cells:A pilot study[J]. Shi Yong Kou Qiang Yi Xue Za Zhi, 2016, 32(2): 190–5. DOI:10.3969/j.issn.1001-3733.2016.02.008 ] |
| [9] | 赵芳, 徐斌, 蒋敬庭, 等. P53在肿瘤微环境、细胞代谢中的调控机制及检测技术的研究进展[J]. 临床检验杂志, 2017, 35(8): 621–3. [ Zhao F, Xu B, Jiang JT, et al. Research progress on the regulation mechanism and detection technology of P53 in tumor microenvironment and cell metabolism[J]. Lin Chuang Jian Yan Za Zhi, 2017, 35(8): 621–3. ] |
| [10] | 薛浩, 薛令军. P65在上皮源性恶性肿瘤中的表达进展[J]. 医学信息(上旬刊), 2011, 24(4): 2352–3. [ Xue H, Xue LJ. Expression of P65 in epithelial malignant tumor[J]. Yi Xue Xin Xi (Shang Xun Kan), 2011, 24(4): 2352–3. ] |
| [11] | 徐静雯, 王楠. 黄芪多糖对胃癌前病变模型大鼠胃黏膜P53、P65、VEGF蛋白表达及AI的影响[J]. 中国药房, 2016, 27(22): 3069–71. [ Xu JW, Wang N. Effects of astragalus polysaccharide on gastric mucosa P53, P65, VEGF protein expression and AI in rats with gastric cancer[J]. Zhongguo Yao Fang, 2016, 27(22): 3069–71. DOI:10.6039/j.issn.1001-0408.2016.22.14 ] |
| [12] | 蒋国梁. 对国内质子重离子放疗热的评述[J]. 肿瘤防治研究, 2017, 44(3): 159–61. [ Jiang GL. Comment on investment tide of proton and heavy ion irradiation[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(3): 159–61. ] |
 2018, Vol. 45
2018, Vol. 45


