文章信息
- β1, 3-乙酰葡萄糖胺转移酶3在非小细胞肺癌中的表达及其临床意义
- Expression of β1, 3-N-acetylglucosaminyltransferase-3 in Non-small Cell Lung Cancer and Its Clinical Significance
- 肿瘤防治研究, 2018, 45(8): 571-575
- Cancer Research on Prevention and Treatment, 2018, 45(8): 571-575
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1638
- 收稿日期: 2017-12-20
- 修回日期: 2018-04-23
β1, 3-乙酰葡萄糖胺转移酶3(β1, 3-N-acetylglucosaminyltransferase-3, B3GNT3)是β3GlcNAcT家族成员之一。β3GlcNAcT家族是一类Ⅱ型跨膜蛋白,其与组织恶性转变有关[1-3]。近年来有研究报道,β3GlcNAcT家族成员在肿瘤组织中异常表达[4-5], 如B3GNT3在宫颈癌细胞、神经母细胞瘤、非霍奇金淋巴瘤、结肠癌细胞中表达[1, 6]。Ho等报道B3GNT3可通过抑制FAK、Akt和ERK信号通路来抑制神经母细胞瘤细胞迁移及侵袭[6]。B3GNT3主要分子生物学功能为调节半乳糖基转移酶活性,影响肿瘤细胞能量代谢,在L-选择素配体生物合成中起主导作用,从而影响肿瘤细胞生存和转移。这些研究结果提示B3GNT3的表达与肿瘤发生发展有关。然而,目前有关B3GNT3在人体肿瘤组织中异常表达的研究并不多见,检索国内外文献,未发现有关B3GNT3表达与非小细胞肺癌(non-small cell lung cancer, NSCLC)之间联系的研究报道。本研究通过TCGA公开数据库,应用Western blot及免疫组织化学法检测肺正常组织和NSCLC组织中B3GNT3蛋白的表达情况,探讨其与NSCLC患者临床病理特征及预后之间的关系,为肿瘤的早期诊断和治疗提供新的靶点。
1 资料与方法 1.1 一般资料收集2015年7月—2015年12月在湖北省肿瘤医院进行手术的60例NSCLC患者肿瘤组织,所有组织均经术后病理检查确诊;以肺大泡、炎性假瘤患者(非肿瘤)22例作为正常对照肺组织。其中肺腺癌(lung adenocarcinoma, LUAD)38例,肺鳞癌(squamous cell lung carcinomas, SCLC)22例,男40例,女20例,年龄30~78岁,平均年龄57岁。按2004年WHO制定的肺肿瘤分类标准进行组织分化程度评估,高分化癌13例、中分化癌29例、低分化癌13例和未分化癌5例;按TNM分期标准(2009年AJCC标准,第7版)分为:Ⅰ期11例、Ⅱ期30例、Ⅲ期19例;无淋巴结转移者39例,有淋巴结转移者21例。60例患者术前均未行化疗或放疗,排除糖尿病及其他代谢性疾病。正常肺组织离体后,立即剔除坏死部分,余下组织经病理证实为正常肺组织。肺肿瘤标本和正常肺组织离体后立即取材,将部分组织用中性福尔马林固定、脱水、石蜡包埋及切片,用于免疫组织化学法检测;另外一部分于液氮中浸置30 min后,转至-80℃冰箱保存,用于提取组织蛋白,进行Western blot法检测。本研究涉及的所有资料均经湖北省肿瘤医院伦理委员会同意批准,所有患者均知情并签订同意书。
1.2 主要试剂兔抗人B3GNT3多克隆抗体(18098-1-AP,武汉Proteintech公司);兔抗人actin抗体(武汉Proteintech公司),免疫组织化学试剂盒(美国Dako公司)。
1.3 方法 1.3.1 Western blot法冰冻组织标本用RIPA裂解液裂解并用匀浆器碾碎,低温超速离心,BCA法测定蛋白浓度,用10%SDS-PAGE凝胶电泳后转膜,一抗B3GNT3(1:1 000),actin(1:2 000),4℃孵育过夜,碱性磷酸酶标记二抗(1:5 000)37℃孵育1 h,ECL显影液均匀滴加在PVDF膜上,在凝胶化学发光成像仪器上进行曝光。用ImageJ灰度分析软件计算泳道对应的灰度值,通过计算目的条带与内参条带灰度值比进行统计分析。
1.3.2 免疫组织化学法按照免疫组织化学试剂盒说明书操作。3 μm厚连续肺肿瘤标本和肺正常组织切片,在63℃烤箱中烘烤70 min,经二甲苯、梯度乙醇溶液脱蜡,高压锅修复抗原,冷却至室温;滴加10%山羊血清封闭30 min,以减少非特异性染色,组织滴加一抗B3GNT3(1:300),4℃孵育过夜。滴加生物素标记的二抗工作液,37℃反应30 min,DAB显色5~10 s。B3GNT3阳性表达物定位于细胞质和细胞膜,细胞出现棕黄色颗粒者为阳性细胞。每个标本随机选取10个高倍(×400)视野,每个视野计数100个细胞。根据显色程度判断阳性程度:标本无色为0分;淡黄色细颗粒为1分;棕黄色颗粒为2分;棕黑色粗颗粒为3分。根据阳性细胞在细胞中所占比例分为:阳性细胞数≤25%为1分;25%~50%为2分;> 50%~75%为3分;> 75%为4分。两类分数乘积0~6分为低表达;> 6分为高表达。
1.4 TCGA数据库数据分析本研究通过在线TCGA数据库(UALCAN: https://ualcan.path.uab.edu/analysis.html.)分析B3GNT3基因在肺癌标本中的表达量,以及B3GNT3基因在肺腺癌、肺鳞癌组织中表达水平与NSCLC患者临床病理特征之间的关系。
1.5 统计学方法采用GraphpadPrism6软件进行生存曲线分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 B3GNT3基因在非小细胞肺癌中的表达通过网络在线TCGA数据库,从肺腺癌组织芯片数据中得到B3GNT3基因表达明显上调,见图 1A;同样,从515例原发肺腺癌组织中也证实B3GNT3基因表达明显上调,见图 1B。同时,发现原发肺鳞癌组织(505例)B3GNT3基因表达也明显上调,见图 1C。这些结果说明B3GNT3基因在NSCLC中表达明显上调,差异有统计学意义(P < 0.001)。
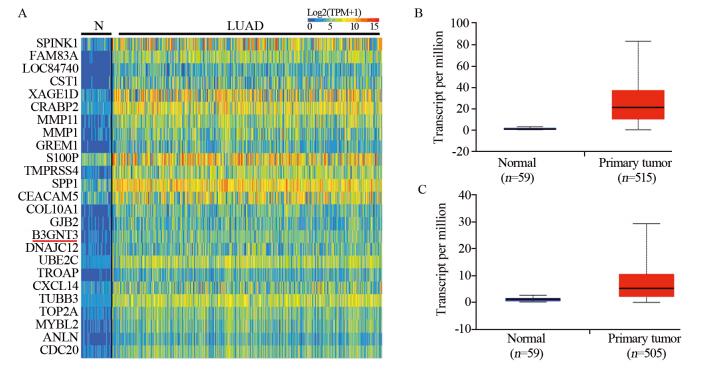
|
| A: Top(1-25)over-expressed genes in lung adenocarcinoma(LUAD); B: B3GNT3 expression in LUAD based on major cancer stages; C: B3GNT3 expression in SCLC based on major cancer stages 图 1 肺腺癌组织中高表达基因热图及B3GNT3在肺腺鳞癌组织中表达 Figure 1 Heat map of overexpressed gene in lung adenocarcinoma tissues and B3GNT3 expression in lung adenocarcinoma and squamous cell lung carcinoma |
免疫组织化学法检测结果显示,B3GNT3蛋白在肺腺癌细胞和肺鳞癌细胞中高表达,在正常肺组织中的肺上皮细胞几乎不表达,见图 2A~C。进一步通过Western blot法检测,同样发现肺腺癌和肺鳞癌组B3GNT3蛋白表达量明显高于正常肺组织组(P值分别为0.0086, 0.0038),见图 2D、E。
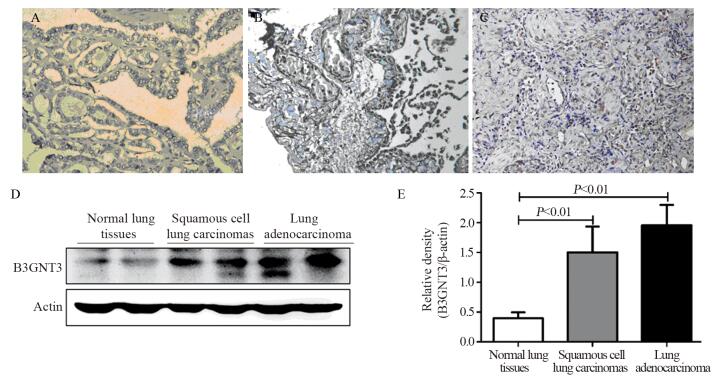
|
| A: normal lung tissues (×400); B: lung adenocarcinoma tissues (×400); C: squamous cell lung carcinomas (×400); D, E: B3GNT3 expression analyzed by Western blot 图 2 免疫组织化学法和Western blot法检测人肺癌组织与正常肺组织中B3GNT3的表达 Figure 2 B3GNT3 expression in lung cancer and normal lung tissues analyzed by immunohistochemical staining and Western blot |
通过在线分析TCGA数据库,发现肺腺癌和肺鳞癌组织中B3GNT3蛋白阳性表达与NSCLC患者年龄、性别、吸烟情况、种族、肿瘤TNM分期均无明显关系(P > 0.05),见图 3。
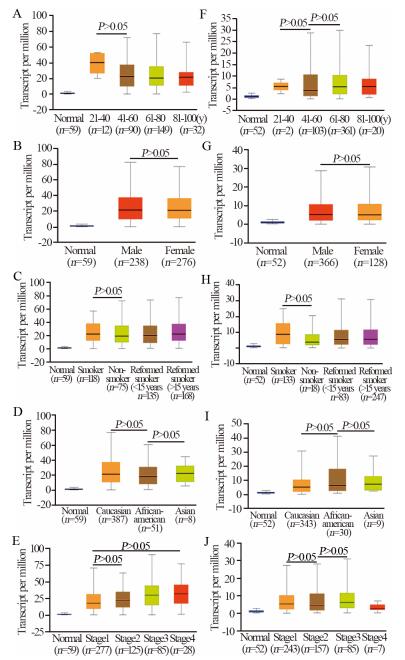
|
| A-E: B3GNT3 expression in LUAD based on age, gender, smoking status, race and individual cancer stages, respetively; F-J: B3GNT3 expression in SCLC based on age 图 3 B3GNT3在人肺组织中的表达及其与NSCLC患者临床病理特征之间的关系 Figure 3 B3GNT3 expression in human lung tissues and its relationship with clinicopathological features of NSCLC patients |
通过在线分析TCGA数据库来探讨B3GNT3表达与NSCLC患者预后之间的关系,将肺腺癌分为高表达组(n=124)和低表达组/中表达组(n=378),得到B3GNT3高表达组患者生存时间明显短于低表达组/中表达组患者(P=0.0066),见图 4A。同样,将肺鳞癌分为高表达组(n=123)和低表达组/中表达组(n=371),得到B3GNT3高表达组患者生存时间明显短于低表达组/中表达组患者(P=0.022),见图 4B。为了进一步验证肺癌细胞B3GNT3表达与NSCLC患者预后之间的关系,随访我院60例NSCLC患者,截至2017年10月30日,随访率为100%,随访时间为4~51月,生存时间从患者手术后开始计算,至患者死亡或随访结束,中位随访时间为29.5月。根据免疫组织化学评分将60例NSCLC患者分为高表达组(n=24)和低表达组(n=36),随访期间有25例患者死亡。Kaplan-Meier曲线法分析结果显示B3GNT1蛋白高表达组患者生存预后明显差于B3GNT3蛋白低表达组患者,差异有统计学意义(P=0.017),见图 4C。
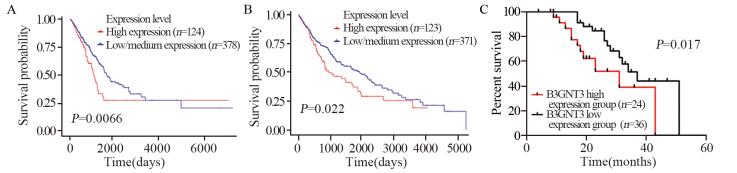
|
| A: lung adenocarcinoma patients; B: squamous cell lung carcinomas patients; C: NSCLC patients 图 4 B3GNT3的不同表达对NSCLC患者生存期的影响 Figure 4 Survival curves of NSCLC patients with high or low B3GNT3 expression |
B3GNT3参与了聚n-乙酰亚胺链的生物合成和二聚唾液酸Lewis A骨架结构的生物合成,近年来才有关于B3GNT3参与肿瘤发生相关作用机制的报道[3, 6]。Shiraishi等[3]证实B3GNT3在结肠癌细胞系Colo205表达上调,也有研究发现,B3GNT1表达下调与胰腺导管腺癌不良预后有关[4],而有报道发现B3GNT5在脑胶质瘤中高表达,B3GNT7在卵巢癌和结肠癌细胞中高表达[5, 7-8]。Cerhan等[9]发现B3GNT3与机体免疫功能和炎性反应有关,它在淋巴细胞移行与迁移方面发挥重要作用,因此可促进非霍奇金淋巴瘤肿瘤细胞生存和转移。另有研究表明B3GNT3基因座与胰腺癌患者CA19-9水平有关[10]。这些结果表明B3GNT3蛋白是一个与人类多种肿瘤相关的癌蛋白,在某些肿瘤类型中发挥着致癌作用。然而,Ho等[6]研究发现B3GNT3过表达抑制T细胞抗原形成和SK-N-SH肿瘤细胞表型,包括肿瘤细胞迁移和浸润。还有研究发现,B3GNT3表达可降低FAK、Src、paxillin、Akt和ERK1/2磷酸化。表明B3GNT3可能在抑制神经母细胞瘤的恶性特性方面发挥关键作用[10]。而B3GNT3在肺癌中作用如何,目前不清楚,尚无文献报道。而本研究结果表明B3GNT3无论在肺腺癌还是肺鳞癌中表达量明显高于正常肺组织,差异有统计学意义(P < 0.01),表明B3GNT3蛋白的高表达可能与NSCLC的发生、发展有关。Zhang等[1]研究表明B3GNT3表达与早期宫颈癌患者HPV感染、FIGO分期、肿瘤大小、淋巴结转移等临床特征相关,B3GNT3表达与早期宫颈癌患者生存预后相关。而本研究发现,B3GNT3蛋白阳性表达与NSCLC患者的临床病理特征之间无明显关系,这可能与组织的差异性有关,也可能与样本量有关,需要进一步研究。我们通过TCGA数据库分析发现B3GNT3表达高低与肺腺癌、肺鳞癌生存预后明显相关,而分析随访的60例NSCLC资料发现,B3GNT3高表达组患者的术后总生存时间明显短于B3GNT3低表达组患者(P < 0.05),与Zhang等研究报道结果一致。因本研究样本量偏少,未进一步行Cox比例风险模型多因素生存分析,B3GNT3蛋白表达是否为NSCLC患者术后总体生存时间的独立影响因素,仍需进一步研究。
总之,本研究无论是从TCGA数据库还是NSCLC患者标本都证实了B3GNT3蛋白在NSCLC组织中高表达并与NSCLC患者的预后有关,其具体的作用机制有待进一步研究。B3GNT3蛋白水平可作为NSCLC患者预后的一个重要指标。
| [1] | Zhang W, Hou T, Niu C, et al. B3GNT3 Expression Is a Novel Marker Correlated with Pelvic Lymph Node Metastasis and Poor Clinical Outcome in Early-Stage Cervical Cancer[J]. PLoS One, 2015, 10(12): e0144360. DOI:10.1371/journal.pone.0144360 |
| [2] | Peng W, Pranskevich J, Nycholat C, et al. Helicobacter pylori beta1, 3-N-acetylglucosaminyltransferase for versatile synthesis of type 1 and type 2 poly-LacNAcs on N-linked, O-linked and I-antigen glycans[J]. Glycobiology, 2012, 22(11): 1453–64. DOI:10.1093/glycob/cws101 |
| [3] | Shiraishi N, Natsume A, Togayachi A, et al. Identification and characterization of three novel beta 1, 3-N-acetylglucosaminyltransferases structurally related to the beta 1, 3-galactosyltransferase family[J]. J Biol Chem, 2001, 276(5): 3498–507. DOI:10.1074/jbc.M004800200 |
| [4] | Haider S, Wang J, Nagano A, et al. A multi-gene signature predicts outcome in patients with pancreatic ductal adenocarcinoma[J]. Genome Med, 2014, 6(12): 105. DOI:10.1186/s13073-014-0105-3 |
| [5] | Shibata TK, Matsumura F, Wang P, et al. Identification of mono- and disulfated N-acetyl-lactosaminyl Oligosaccharide structures as epitopes specifically recognized by humanized monoclonal antibody HMOCC-1 raised against ovarian cancer[J]. J Biol Chem, 2012, 287(9): 6592–602. DOI:10.1074/jbc.M111.305334 |
| [6] | Ho WL, Che MI, Chou CH, et al. B3GNT3 expression suppresses cell migration and invasion and predicts favorable outcomes in neuroblastoma[J]. Cancer science, 2013, 104(12): 1600–8. DOI:10.1111/cas.2013.104.issue-12 |
| [7] | Etcheverry A, Aubry M, de Tayrac M, et al. DNA methylation in glioblastoma: impact on gene expression and clinical outcome[J]. BMC Genomics, 2010, 11: 701. DOI:10.1186/1471-2164-11-701 |
| [8] | Lu CH, Wu WY, Lai YJ, et al. Suppression of B3GNT7 gene expression in colon adenocarcinoma and its potential effect in the metastasis of colon cancer cells[J]. Glycobiology, 2014, 24(4): 359–67. DOI:10.1093/glycob/cwu002 |
| [9] | Cerhan JR, Ansell SM, Fredericksen ZS, et al. Genetic variation in 1253 immune and inflammation genes and risk of non-Hodgkin lymphoma[J]. Blood, 2007, 110(13): 4455–63. DOI:10.1182/blood-2007-05-088682 |
| [10] | He M, Wu C, Xu J, et al. A genome wide association study of genetic loci that influence tumour biomarkers cancer antigen 19-9, carcinoembryonic antigen and alpha fetoprotein and their associations with cancer risk[J]. Gut, 2014, 63(1): 143–51. DOI:10.1136/gutjnl-2012-303434 |
 2018, Vol. 45
2018, Vol. 45


