文章信息
- 肺腺癌中HLA-G的表达及其与患者预后的关系
- HLA-G Expression in Lung Adenocarcinoma Tissues and Its Relationship with Prognosis
- 肿瘤防治研究, 2018, 45(8): 566-570
- Cancer Research on Prevention and Treatment, 2018, 45(8): 566-570
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1594
- 收稿日期: 2018-01-18
- 修回日期: 2018-04-16
2. 100142 北京,北京大学肿瘤医院暨北京市肿瘤防治研究所胸外二科,恶性肿瘤发病机制及转化研究教育部重点实验室
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Department of Thoracic Surgery Ⅱ, Peking University Cancer Hospital and Institute, Beijing 100142, China
肺癌是一种常见的恶性肿瘤,是造成癌症死亡的主要原因之一[1],近年来肺癌发病率逐年升高,其中约85%的患者为非小细胞肺癌,尽管在肺癌的诊断和治疗方面取得了不小进展,但是非小细胞肺癌的预后仍然不容乐观,并且约有40%的Ⅰ期和60%的Ⅱ期非小细胞肺癌患者术后5年内发生复发和远处转移而死亡[2]。肺癌的进展和转移是患者死亡的主要原因,因此研究肺癌的发病机制,寻找新的治疗靶标,成为肺癌研究的热点。
人类白细胞抗原-G(human leukocyte antigen G, HLA-G)属于非经典HLAⅠ类基因家族,定位于人6号染色体短臂远侧6p21.3,是机体重要的免疫耐受分子,最早发现在母胎界面的绒毛膜细胞上表达[3-4]。HLA-G可以通过直接结合各种抑制性受体对免疫系统抑制。研究表明,HLA-G分子结合的受体主要有三种:免疫球蛋白样转录体2(ILT2/CD85j/LILRB1)、免疫球蛋白样转录体4(ILT4/CD58d/LILRB2)及杀伤细胞抑制性受体KIR2DL4/CD158d。HLA-G分子与这些受体结合,可有效地抑制T细胞、NK细胞及抗原呈递细胞的功能[5]。继Paul等学者首次在黑色素瘤中发现HLA-G分子表达后[6],相继发现多种恶性肿瘤如肺癌、卵巢癌、食管癌、结直肠癌、肾透明细胞癌、乳腺癌以及血液肿瘤等均通过表达HLA-G形成免疫抑制性的肿瘤微环境,从而逃避机体的抗肿瘤免疫反应,其与患者的预后成负相关[7-17]。这些研究表明HLA-G可以作为肿瘤诊断和判断预后的生物学指标。
本研究采用生物信息学方法分析公共数据库中HLA-G分子在肺癌中基因水平的改变及与患者预后的相关性,并在肺腺癌标本中加以验证,通过检测肺腺癌组织中HLA-G蛋白的表达水平,分析其与临床病理特征的相关性及与预后的关系,从而为寻找新的肺癌生物靶标提供线索。
1 资料与方法 1.1 组织标本选取2007年7月25日至2014年12月31日于北京肿瘤医院胸外二科就诊并行根治性手术治疗的肺腺癌患者共223例,其中女158例,男65例,中位年龄58岁。所有患者均接受根治性手术切除+纵隔淋巴结清扫术,原发灶至少行肺叶切除术,术后标本均证实为非小细胞肺腺癌。223例患者同时满足下列条件:死亡原因是肺癌而非其他疾病;通过电话、查阅住院病例等方式对223例患者随访到2016年12月31日。
在标本收集之前,临床科研协议书已由北京大学肿瘤医院伦理委员会审批通过,所有患者均签署科研知情告知书,所有文件常规扫描并转换为PDF版保存于患者病历中。
1.2 生物信息学分析采用cBioPortal分析工具(http://www.cbioportal.org/)对肿瘤基因图谱(The Cancer Genoma Atlas, TCGA, http://cancergeome.nih.gov/)数据库中的HLA-G基因改变频率进行分析。利用Kaplan-Meier Plotter数据库(www.kmplot.com)对720例肺腺癌患者HLA-G的表达和预后进行分析。
1.3 免疫组织化学石蜡包埋组织切片4 μm,60℃烤箱预烤片,2 h;随后置于二甲苯中脱蜡2次,每次15 min;梯度酒精(100%→95%→85%→75%)水化各5 min,之后去离子水洗3次,每次2 min;去除内源性HRP:50 μl 3%H2O2去除内源性过氧化物酶滴加到切片上,湿盒内室温孵育10 min,封闭结束后PBS洗3次,每次5 min;抗原修复:切片置入柠檬酸盐缓冲液中,高压锅加热(1800 W 300℃),喷气后改为400 W,计时5 min,冷却至室温,PBS洗3次,每次5 min;封闭:每张切片滴加50 μl 5%BSA,湿盒内室温孵育30 min,甩去多余液体,勿冲洗;一抗孵育:每张片子滴加1:500稀释的HLA-G抗体(美国Abcam公司)50~100 μl,置于湿盒内,4℃过夜,次日晨取出,PBS洗3次,每次5 min;二抗孵育:每张片子滴加二抗50~100 μl,湿盒内室温孵育30 min,PBS洗3次,每次5 min;显色:DAB原液和稀释液以1:30的比例配成显色液,滴加至切片上,每张约50 μl,在显微镜下掌握染色程度满意时终止反应,染色结束后去离子水洗3次,每次2 min;苏木精对比染色3 min,1%盐酸酒精分化5秒,自来水冲洗30 min;酒精梯度脱水,每次1 min;风干,滴加中性树胶,盖玻片封片。
1.4 免疫组织化学染色结果判定标准免疫组织化学结果采用半定量方法,按着色程度分为:基本未着色或染色与背景相似者为0分;着色浅,略高于背景者为1分;中度着色,明显高于背景者为2分;强染色者为3分;按阳性细胞数量分为:在光学显微镜下随机选取5个高倍镜视野,以视野的均值作为阳性细胞百分比,阳性细胞数≤5%者为0分;6%~25%为1分;26%~50%为2分;51%~100%为3分。以染色强度评分与阳性细胞比例评分的乘积作为最终分值。综合评分 < 2分为阴性(-),2~3分为弱阳性(+),4~5分为中等程度阳性(++),≥6分为强阳性(+++)。由两位高年资病理科医师独立阅片并评分,将HLA-G表达(-)判定为低表达或阴性表达,(+/++/+++)判定为高表达或阳性表达。
1.5 统计学方法用统计学软件SPSS17.0进行统计学处理,样本间均值比较使用t检验或非参数检验(Mann Whitney test),采用χ2和Fisher’s检验分析不同患者临床病理特征的差异,采用Kaplan-Meier法绘制生存曲线,各因素之间比较用Log rank分析,Cox回归分析影响生存的独立危险因素,以P < 0.05为差异有统计学意义。
2 结果 2.1 肺癌中HLA-G分子的基因组学分析运用cBioPortal分析工具对TCGA数据库中HLA-G的基因水平改变进行分析,分析结果显示,在肺癌中,共有11项研究表明HLA-G基因的改变主要表现为扩增和错义突变,其中,扩增突变主要在肺腺癌中,错义突变主要发生在肺鳞癌和小细胞肺癌中,见图 1。
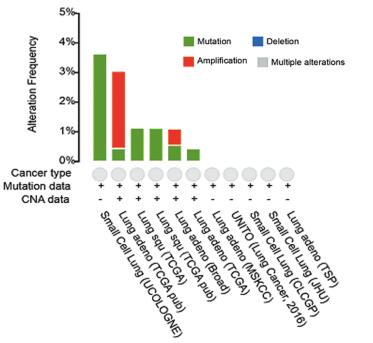
|
| 图 1 数据库中HLA-G分子在肺癌中基因组学分析 Figure 1 Genomic analysis of HLA-G of lung cancer in the TCGA database |
利用网络在线生存分期软件Kaplan-Meier Plotter对肺腺癌中HLA-G的表达水平进行分析,分析结果显示,在720例肺腺癌患者中,有360例高表达,360例低表达,Kaplan-Meier曲线和Log rank检测结果显示,HLA-G高表达的患者生存时间较短,预后较差,见图 2。
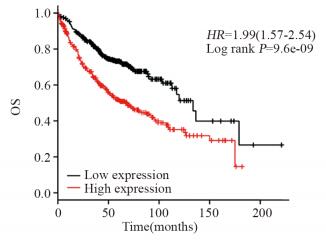
|
| 图 2 HLA-G分子表达与肺癌预后的相关性 Figure 2 Correlation between HLA-G expression and prognosis of lung cancer patients |
为了验证上述结果,对本中心的223名肺腺癌患者进行研究,所有患者的具体临床病理学特征见表 1。

|
免疫组织化学结果显示,HLA-G分子主要在细胞膜或细胞质表达,呈棕黄色至棕褐色,见图 3。根据表达强度评分(-/+/++/+++),低表达组有140例(62.8%),高表达组有83例(37.2%),相关性分析提示HLA-G蛋白的表达与脉管癌栓及肿瘤的临床分期相关(P < 0.05),而与性别、年龄、吸烟史、肿瘤大小无关(P > 0.05),见表 1。
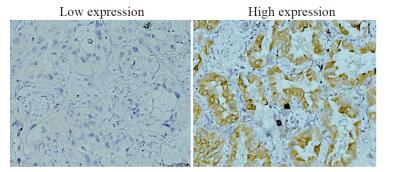
|
| 图 3 HLA-G蛋白在肺腺癌患者中的表达(×20) Figure 3 Expression of HLA-G protein in patients with lung adenocarcinoma (×20) |
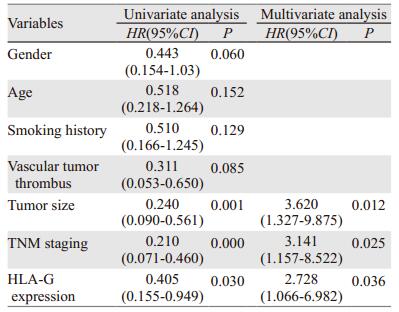
按肿瘤细胞HLA-G的表达水平分为低表达组(n=140)与高表达组(n=83),结合随访数据进行生存分析,Kaplan-Meier生存曲线,并进行Log rank检验。结果显示HLA-G的表达与患者生存有关,HLA-G高表达的患者生存时间较短,预后较差(P=0.03),见图 4。将性别、年龄、吸烟史、脉管癌栓、肿瘤大小、临床分期以及HLA-G表达等因素纳入Cox回归分析发现,HLA-G表达、肿瘤大小和临床分期是影响患者整体生存的独立危险因素,见表 2。
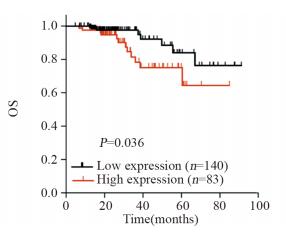
|
| 图 4 223例肺腺癌患者五年总生存曲线 Figure 4 5-year overall survival (OS) curves of 223 patients with lung adenocarcinoma |
|
上世纪90年代以来,化疗在一定程度上提高了肺癌患者5年生存率,但效果并不十分显著,肺癌患者的5年标化生存率仍然很低,仅为10%~15%,自2013年以来,肿瘤的免疫治疗被列为十大科技突破之一,成为继分子靶向治疗之后的新热点[18];研究表明,HLA-G在多种恶性肿瘤组织中的异常表达已经成为肿瘤免疫反应中的普遍现象,可通过与抑制性受体相结合以及诱导抑制性T细胞的产生等多种方式直接或间接地促进肿瘤细胞发生免疫逃逸,并抑制机体的抗肿瘤免疫反应。HLA-G的表达受到自身特异基因序列以及肿瘤微环境、表观遗传机制、细胞因子等调节。已有研究表明,HLA-G分子的基因多态性及血液中的HLA-G分子与非小细胞肺癌患者的预后相关[16-17, 19-22]。鉴于HLA-G在肿瘤中具有重要免疫调节作用,其在肿瘤诊断和预后中的作用以及以HLA-G作为靶点的生物免疫治疗将成为新的研究方向和热点。
本实验中,通过生物信息学的方法对非小细胞肺癌中HLA-G分子的基因多态性进行分析,发现HLA-G基因的改变主要表现为扩增和错义突变,其中,扩增突变主要在肺腺癌中,错义突变主要发生在肺鳞癌和小细胞肺癌中。即HLA-G基因的改变类型与非小细胞肺癌的病理类型有关,根据病理类型对非小细胞肺癌分类后再探索HLA-G分子与患者的临床病理特征以及与患者预后的关系具有更重要的临床指导意义。
Yie等通过免疫组织化学的方法证实了非小细胞肺癌中HLA-G的表达与患者的预后相关[16]。由于HLA-G的基因多态性与预后相关且非小细胞肺癌的不同病理类型中HLA-G分子的基因改变类型不同。本研究经统计分析发现HLA-G的表达与脉管癌栓、肿瘤的TNM分期显著相关,且HLA-G高表达的肺腺癌患者预后较差。这与在所有类型的非小细胞肺癌中的研究结果一致。但在肺腺癌中,37.2%(83/223)的患者高表达HLA-G,而在所有类型的非小细胞肺癌中,HLA-G的高表达率为41.6%(42/101)[23]~75%(79/106)[16]。
肿瘤细胞可通过下调细胞表面的HLAⅠ类分子、分泌免疫抑制因子、抑制T细胞共刺激信号以及表达PD1/PD-L1分子等方式逃避宿主的免疫监视功能。已有研究表明,HLA-G可抑制自然杀伤细胞(natural killer cell, NK)和细胞毒性T淋巴细胞(cytotoxicity T lymphocyte, CTL)的功能,其在肿瘤细胞中的异常表达也同样被认为是肿瘤细胞发生免疫逃逸的手段。HLA-G的表达与宿主的免疫反应之间存在显著的反向相关性,但与其他临床病理参数不相关,这也为HLA-G参与肿瘤细胞发生免疫逃逸提供了证据。因此,高表达HLA-G的肿瘤细胞与HLA-G低表达的肿瘤细胞相比更具有生存优势,最终导致临床患者预后不良。除了基因序列的控制,HLA-G的表达还受肿瘤环境因素的影响,如细胞因子、应激、化疗药物脱乙基分子等。鉴于HLA-G所具有的免疫抑制作用及其在肿瘤细胞表面表达的特点,研究以HLA-G为靶点的抗肿瘤免疫治疗具有潜在的临床意义。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11–30. DOI:10.3322/caac.v63.1 |
| [2] | Xue C, Hu Z, Jiang W, et al. National survey of the medical treatment status for non-small cell lung cancer (NSCLC) in China[J]. Lung Cancer, 2012, 77(2): 371–5. DOI:10.1016/j.lungcan.2012.04.014 |
| [3] | Carosella ED, Rouas-Freiss N, Tronik-Le Rous D, et al. HLA-G: An Immune Checkpoint Molecule[J]. Adv Immunol, 2015, 127: 33–144. DOI:10.1016/bs.ai.2015.04.001 |
| [4] | Ferreira LMR, Meissner TB, Tilburgs T, et al. HLA-G: At the Interface of Maternal-Fetal Tolerance[J]. Trends Immunol, 2017, 38(4): 272–86. DOI:10.1016/j.it.2017.01.009 |
| [5] | Carosella ED, Ploussard G, LeMaoult J, et al. A Systematic Review of Immunotherapy in Urologic Cancer: Evolving Roles for Targeting of CTLA-4, PD-1/PD-L1, and HLA-G[J]. Eur Urol, 2015, 68(2): 267–79. DOI:10.1016/j.eururo.2015.02.032 |
| [6] | Paul P, Rouas-Freiss N, Khalil-Daher I, et al. HLA-G expression in melanoma: a way for tumor cells to escape from immunosurveillance[J]. Proc Natl Acad Sci U S A, 1998, 95(8): 4510–5. DOI:10.1073/pnas.95.8.4510 |
| [7] | Brown R, Kabani K, Favaloro J, et al. CD86+ or HLA-G+ can be transferred via trogocytosis from myeloma cells to T cells and are associated with poor prognosis[J]. Blood, 2012, 120(10): 2055–63. DOI:10.1182/blood-2012-03-416792 |
| [8] | Caocci G, Greco M, Arras M, et al. HLA-G molecules and clinical outcome in Chronic Myeloid Leukemia[J]. Leuk Res, 2017, 61: 1–5. DOI:10.1016/j.leukres.2017.08.005 |
| [9] | De Re V, Caqqiari L, Mussolin L, et al. HLA-G+3027 polymorphism is associated with tumor relapse in pediatric Hodgkin's lymphoma[J]. Oncotarget, 2017, 8(62): 105957–70. |
| [10] | Caocci G, Greco M, Fanni D, et al. HLA-G expression and role in advanced-stage classical Hodgkin lymphoma[J]. Eur J Histochem, 2016, 60(2): 2606. |
| [11] | Rutten MJ, Dijk F, Savci-Heijink CD, et al. HLA-G expression is an independent predictor for improved survival in high grade ovarian carcinomas[J]. J Immunol Res, 2014, 2014: 274584. |
| [12] | Jung YW, Kim YT, Kim SW, et al. Correlation of human leukocyte antigen-G (HLA-G) expression and disease progression in epithelial ovarian cancer[J]. ReprodSci, 2009, 16(11): 1103–11. |
| [13] | Zhang RL, Zhang X, Dong SS, et al. Predictive value of different proportion of lesion HLA-G expression in colorectal cancer[J]. Oncotarget, 2017, 8(64): 107441–51. |
| [14] | Guo ZY, Lv YG, Wang L, et al. Predictive value of HLA-G and HLA-E in the prognosis of colorectal cancer patients[J]. Cell Immunol, 2015, 293(1): 10–6. DOI:10.1016/j.cellimm.2014.10.003 |
| [15] | Konig L, Kasimir-Bauer S, Hoffmann O, et al. The prognostic impact of soluble and vesicular HLA-G and its relationship to circulating tumor cells in neoadjuvant treated breast cancer patients[J]. Hum Immunol, 2016, 77(9): 791–9. DOI:10.1016/j.humimm.2016.01.002 |
| [16] | Yie SM, Yang H, Ye SR, et al. Expression of human leucocyte antigen G (HLA-G) is associated with prognosis in non-small cell lung cancer[J]. Lung Cancer, 2007, 58(2): 267–74. DOI:10.1016/j.lungcan.2007.06.011 |
| [17] | Zhang Y, Zhao J, Qiu L, et al. Co-expression of ILT4/HLA-G in human non-small cell lung cancer correlates with poor prognosis and ILT4-HLA-G interaction activates ERK signaling[J]. Tumour Biol, 2016, 37(8): 11187–98. DOI:10.1007/s13277-016-5002-5 |
| [18] | Asmar R, Rizvi NA. Immunotherapy for Advanced Lung Cancer[J]. Cancer J, 2015, 21(5): 383–91. DOI:10.1097/PPO.0000000000000151 |
| [19] | Tartour E, Zitvogel L. Lung cancer: potential targets for immunotherapy[J]. Lancet Respir Med, 2013, 1(7): 551–63. DOI:10.1016/S2213-2600(13)70159-0 |
| [20] | Kowal A, Wisniewski A, Kusnierczyk P, et al. Human leukocyte antigen (HLA)-G gene polymorphism in patients with non-small cell lung cancer[J]. Thoracic Cancer, 2015, 6(5): 613–9. DOI:10.1111/tca.2015.6.issue-5 |
| [21] | Cao M, Yie SM, Liu J, et al. Plasma soluble HLA-G is a potential biomarker for diagnosis of colorectal, gastric, esophageal and lung cancer[J]. Tissue Antigens, 2011, 78(2): 120–8. DOI:10.1111/tan.2011.78.issue-2 |
| [22] | Wisniewski A, Kowal A, Wyrodek E, et al. Genetic polymorphisms and expression of HLA-G and its receptors, KIR2DL4 and LILRB1, in non-small cell lung cancer[J]. Tissue Antigens, 2015, 85(6): 466–75. DOI:10.1111/tan.12561 |
| [23] | Lin A, Zhu CC, Chen HX, et al. Clinical relevance and functional implications for human leukocyte antigene-G expression in non-small-cell lung cancer[J]. J Cell Mol Med, 2010, 14(9): 2318–29. DOI:10.1111/jcmm.2010.14.issue-9 |
 2018, Vol. 45
2018, Vol. 45


