文章信息
- 隐丹参酮诱导人食管癌HCE-4细胞凋亡的机制
- Apoptotic Effects of Cryptotanshinone on Human Esophageal Carcinoma HCE-4 Cells and Related Mechanism
- 肿瘤防治研究, 2018, 45(8): 533-539
- Cancer Research on Prevention and Treatment, 2018, 45(8): 533-539
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1582
- 收稿日期: 2017-12-11
- 修回日期: 2018-03-28
2. 163316 大庆,哈尔滨医科大学第五医院妇产科
2. Department of Gynaecology and Obstetrics, The Fifth Affiliated Hospital of Harbin Medical University, Daqing 163316, China
食管癌是常见的消化道肿瘤,约占所有恶性肿瘤的2%,其病死率位居第4位[1-3]。食管癌的治疗方式主要为手术治疗、化学治疗和放射治疗,但都存在不良反应强和预后差的缺点[4]。因此,寻找安全、高效、低毒的治疗方法迫在眉睫。
隐丹参酮(cryptotanshinone)是从传统中药丹参根部分离出来的有效成分,分子式为C19H20O3,作为菲醌类化合物,其骨架上具有邻醌或对醌结构,表现出抗菌、抗炎和抗肿瘤的药理活性[5-6]。研究表明,隐丹参酮可以通过调控雌激素受体、ERK及AKT等蛋白有效抑制前列腺癌、胃癌、胆管癌及乳腺癌细胞的增殖并诱导其凋亡[7-10],在体内实验中发现,隐丹参酮也可通过诱导肝癌HepG2裸鼠移植瘤细胞发生凋亡进而抑制肿瘤细胞的增殖[11],但其对食管癌细胞的作用研究尚未见报道,我们猜测隐丹参酮可能对食管癌细胞也具有类似的作用。本实验将探究隐丹参酮对人食管癌HCE-4细胞的杀伤作用、诱导凋亡作用及分子机制,为食管癌以及其他癌症的治疗和新药开发提供新思路。
1 材料与方法 1.1 材料 1.1.1 细胞人食管癌HCE-4和TE-2细胞系,人正常肝L-02和QSG-7701细胞系(中国科学院细胞研究所)。
1.1.2 主要试剂隐丹参酮和DMSO(Sigma, 美国),5-氟尿嘧啶(Med Chem Express,美国),RPMI 1640培养液和FBS胎牛血清(Gibco,美国),青/链霉素双抗(Hyclone, 美国,SV30010),胰蛋白酶和磷酸盐缓冲液(Hyclone,美国),噻唑蓝(Amresco,美国),α-tubulin、Bad、Bcl-2、Caspase-3、PARP、ERK、p-ERK、JNK、p-JNK、p38、p-p38、AKT、p-AKT抗体,HRP标记山羊抗兔IgG,HRP标记山羊抗鼠IgG(Santa Cruz,美国),活性氧检测试剂盒(Invitrogen,美国),Annexin V-FITC细胞凋亡检测试剂盒(碧云天,中国),ECL化学发光试剂(Thermo,美国)。
1.2 方法 1.2.1 细胞培养人食管癌HCE-4和TE-2细胞及人正常肝L-02和QSG-7701细胞用含10%胎牛血清、100 u/ml青霉素及100 µg/ml链霉素的RPMI 1640培养液,在37℃、5%CO2饱和湿度的培养箱中培养。待细胞密度达到70%~80%时,按照比例进行传代培养。
1.2.2 MTT比色法检测细胞存活率收集处于对数生长期的食管癌HCE-4和TE-2细胞及正常肝L-02和QSG-7701细胞,制成细胞数为每毫升1×105个的细胞悬液,每孔以100 µl接种至96孔板中,于5% CO2、37℃培养箱孵育24 h。1%FBS血清饥饿2 h,设立阴性对照组和实验组,实验组每孔分别加入1 µl不同浓度的隐丹参酮(1、3、10、30及100 μmol/L),阳性对照组用5-Fu作相同处理,阴性对照组加入DMSO,每组设定8个复孔。在培养箱中培养24 h后,每孔加入15 µl 0.5%的MTT溶液,2 h后弃去上清液,每孔加入100 µl DMSO,振荡10 min,调节酶联免疫检测仪于490 nm波长处测量吸光度值,计算细胞存活率。重复3次独立实验,方法同上。细胞存活率=(实验组A490-空白调零组A490)/(对照组A490-空白调零组A490)。
1.2.3 食管癌HCE-4细胞形态学观察收集处于对数生长期的食管癌HCE-4细胞,配制成细胞悬液,每孔1×105个接种至6孔板。5%CO2、37℃培养箱培养24 h后,以不同浓度的隐丹参酮(1、3、10、30及100 μmol/L)处理细胞,通过倒置显微镜观察HCE-4细胞的形态学变化,并进行分析。
1.2.4 Annexin V-FITC/PI双染法检测细胞凋亡收集处于对数生长期的HCE-4细胞,以每孔1×105的密度接种至6孔板,5%CO2、37℃培养箱中孵育24 h。用浓度为20 µmol/L的隐丹参酮处理细胞3、6、12和24 h,应用碧云天Annexin V-FITC细胞凋亡检测试剂盒,根据操作说明检测细胞凋亡情况,实验重复3次,并利用荧光显微镜照相,观察细胞凋亡情况。
1.2.5 流式细胞术检测细胞凋亡情况收集处于对数生长期的HCE-4细胞,以每孔1×105个密度接种至6孔板,于5%CO2、37℃培养箱中孵育24 h。用浓度为20 µmol/L的隐丹参酮处理细胞3、6、12和24 h,收集细胞,弃去上清液后PBS洗涤1次。加入195 μl的Annexin V-FITC结合液重悬细胞,再加入3 μl Annexin V-FITC与2 μl PI,室温避光孵育15 min,每组加入300 μl PBS,转移至流式管,流式细胞仪检测细胞凋亡率。
1.2.6 Western blot法检测细胞凋亡相关蛋白的表达量变化收集处于对数生长期的HCE-4细胞,接种至3.5 cm培养皿中,20 µmol/L隐丹参酮处理3、6、12和24 h,收集细胞于1.5 ml离心管中。加入100 µl裂解液,冰上裂解30 min,12 000 r/min、4℃离心30 min,收集上清液,在595 nm处测得蛋白质浓度。取总蛋白30 µg用5×buffer上样,加热变性后使用12%SDS聚丙烯酰胺凝胶电泳分离,将蛋白质转至硝酸纤维膜上,脱脂乳封闭1 h,TBST洗涤5次,分别与ERK、p-ERK、JNK、p-JNK、p38、p-p38、AKT、p-AKT、Bad、Bcl-2、cleaved-caspase-3及cleaved-PARP结合,4℃摇床过夜孵育。TBST洗涤5次,以HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG为二抗,室温孵育2 h,加入ECL化学发光试剂显色,利用AI600多功能成像仪成像,内参采用α-tubulin。
1.2.7 流式细胞术检测细胞内活性氧水平收集处于对数生长期的HCE-4细胞,以每孔1×105个密度接种至6孔板,于5%CO2、37℃培养箱中孵育24 h。用浓度为20 µmol/L的隐丹参酮处理细胞3、6、12和24 h,收集细胞,弃去上清后PBS洗涤1次。加10 μmol/L的2, 7-二氯二氢荧光素二酯(2, 7-dichlorofluorescein diacetate, DCFH-DA),37℃恒温水浴锅中避光孵育30 min,PBS洗涤1次,500 μl PBS重悬细胞,转移至流式管后流式细胞仪检测细胞内活性氧水平。
1.2.8 活性氧清除剂N-乙酰-L-半胱氨酸(NAC)对隐丹参酮诱导HCE-4细胞凋亡的抑制作用收集处于对数生长期的HCE-4细胞,以每孔1×105个密度接种至6孔板,于5%CO2、37℃培养箱中孵育24 h。以终浓度为5 mmol/L的活性氧清除剂NAC预处理30 min后,用20 μmol/L的隐丹参酮处理HCE-4细胞24 h。以PBS洗涤1次,加入195 μl Annexin V-FITC结合液重悬细胞,再加入3 μl Annexin V-FITC及2 μl PI,避光孵育15 min,300 μl PBS重悬,转移至流式管中通过流式细胞仪检测细胞凋亡率。
1.3 统计学方法采用SPSS19.0软件进行统计分析,计量资料数据以均数±标准差(x±s)表示,两组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 隐丹参酮对人食管癌HCE-4细胞的杀伤作用MTT检测结果显示,随着隐丹参酮浓度的增加,食管癌HCE-4和TE-2细胞的存活率逐渐降低,表明隐丹参酮对HCE-4和TE-2细胞均具有良好的杀伤作用,并呈浓度依赖性。与阳性对照组(5-Fu)相比,差异有统计学意义,并且对人正常肝L-02和QSG-7701细胞无明显杀伤作用,见图 1。经计算,对食管癌细胞HCE-4和TE-2细胞的IC50分别为16.5和23.89 µmol/L,HCE-4细胞对隐丹参酮的敏感度最高,因此后续实验以人食管癌HCE-4细胞作为主要研究对象。
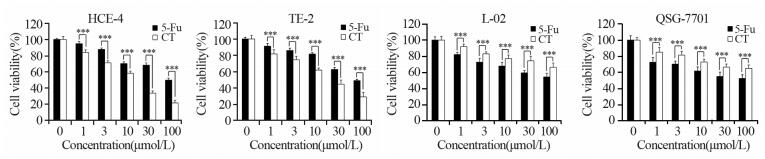
|
| ***: P < 0.001, compared with control group(5-Fu); n=3; CT: cryptotanshinone 图 1 不同浓度的5-Fu和隐丹参酮处理食管癌HCE-4、TE-2及正常肝L-02和QSG-7701细胞24 h后细胞的存活率 Figure 1 Viabilities of esophageal carcinoma HCE-4, TE-2 cells and normal liver L-02 and QSG-7701 cells treated with different concentration of 5-Fu and cryptotanshinone for 24h |
通过倒置显微镜对不同浓度(1、3、10、30及100 μmol/L)隐丹参酮处理后的HCE-4细胞进行形态学观察。未经药物处理的HCE-4细胞(0 μmol/L)生长状态良好,细胞呈多边型,单层生长,形态规则;而实验组细胞,随着隐丹参酮处理浓度的递增,细胞形态发生显著改变,出现细胞核固缩、变圆,颗粒感增强,悬浮细胞增多的现象,其中以处理浓度为100 μmol/L时细胞形态变化最为明显,见图 2。
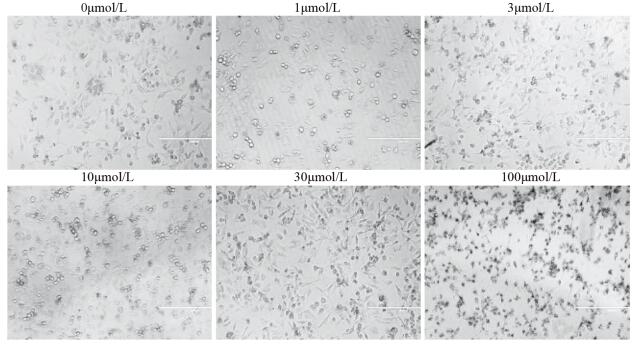
|
| 图 2 不同浓度的隐丹参酮处理HCE-4细胞24 h后细胞的形态学观察(×200) Figure 2 Morphological changes of HCE-4 cells treated with different concentration of cryptotanshinone for 24 h (×200) |
为了验证隐丹参酮是否能诱导HCE-4细胞凋亡,用终浓度为16.5 μmol/L的隐丹参酮处理HCE-4细胞3、6、12和24 h后,进行Annexin V-FITC/PI双染实验。结果显示,随着时间的增加,绿色荧光强度逐渐增强,即细胞凋亡程度逐渐增强。24 h时,HCE-4细胞的荧光强度最高,见图 3A,且显微镜下观察发现癌细胞基本均已凋亡。通过流式细胞术对细胞凋亡数量进行检测,发现随着时间的不断延长,细胞凋亡数量逐渐增加,24 h时,细胞凋亡水平最为明显,见图 3B。最后,通过Western blot法对凋亡相关蛋白的表达量变化进行检测,发现随着时间的延长,促凋亡蛋白Bad、caspase-3和PARP表达量升高,抗凋亡蛋白Bcl-2表达量降低,见图 3C。以上结果表明,隐丹参酮能够诱导人食管癌HCE-4细胞凋亡,并呈时间依赖性。
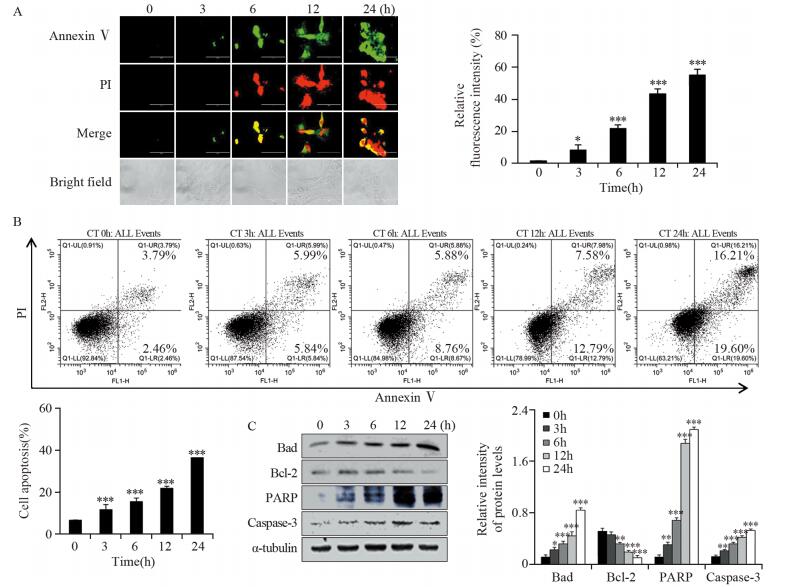
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0 h group; A: Annexin V-FITC/PI double staining (×200) and quantitative analysis; B: apoptotic rates detected by flow cytometry and quantitative analysis; C: expression levels of apoptosis-related proteins detected by Western blot and quantitative analysis 图 3 隐丹参酮对HCE-4细胞的诱导凋亡作用 Figure 3 Apoptotic effects of cryptotanshinone on HCE-4 cells |
16.5 μmol/L的隐丹参酮处理HCE-4细胞3、6、12及24 h后,通过Western blot法检测上游相关蛋白的表达量变化。结果显示,随着时间的增加,促凋亡蛋白p-JNK和p-p38表达量增加,抗凋亡蛋白p-ERK和p-AKT表达量降低,表明隐丹参酮通过调控MAPK、AKT信号通路诱导HCE-4细胞凋亡,并呈时间依赖性,进而对HCE-4细胞发挥良好的杀伤作用,见图 4。
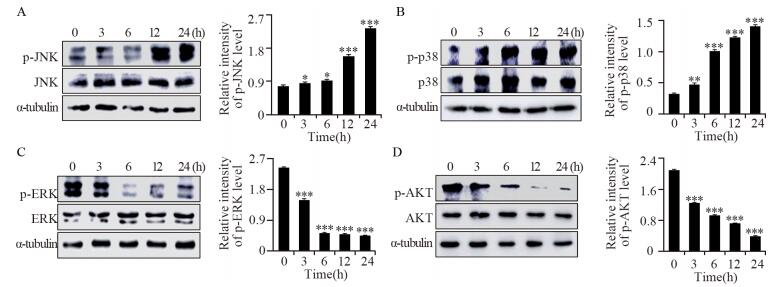
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0h group; A-D: expression levels of upstream-related proteins determined by Western blot and quantitative analysis 图 4 隐丹参酮对HCE-4细胞上游相关蛋白表达的影响 Figure 4 Effect of cryptotanshinone on expression levels of upstream-related proteins in HCE-4 cells |
终浓度为16.5 μmol/L的隐丹参酮处理HCE-4细胞3、6、12和24 h后,通过DCFH-DA荧光探针法检测细胞内活性氧水平变化情况。结果显示,随着时间的增加,细胞内ROS水平明显升高,峰图向右侧移动,说明隐丹参酮可促进HCE-4细胞内ROS的产生,并呈时间依赖性,见图 5A。分别用隐丹参酮与NAC单独或共同处理HCE-4细胞24 h,结果发现隐丹参酮+NAC处理组与隐丹参酮单独处理组相比,细胞凋亡率明显降低,表明隐丹参酮通过上调细胞内ROS水平诱导HCE-4细胞凋亡,见图 5B。
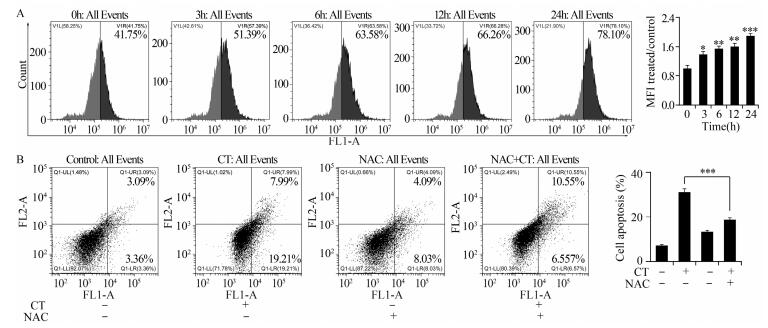
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0h group; MFI: mean of fluorescence index; A: intracellular ROS levels determined by flow cytometry and quantitative analysis; B: apoptotic effect of CT, NAC and CT+NAC on HCE-4 cells, and quantitative analysis 图 5 隐丹参酮对HCE-4细胞内ROS水平的影响 Figure 5 Effect of cryptotanshinone on ROS levels in HCE-4 cells |
肿瘤的发生是一个长期、多阶段、多基因参与的过程,而细胞凋亡在肿瘤发生和发展的过程中扮演着重要角色。有研究表明,细胞凋亡受到细胞因子和凋亡相关蛋白的协同调控,在多基因精确调控的凋亡受到抑制时会导致肿瘤的发生,因此诱导肿瘤细胞发生凋亡是一种治疗肿瘤的重要手段。在实验进行之前,通过查阅大量文献发现,隐丹参处理癌细胞浓度多为1~100 μmol/L[12-14],因此用浓度梯度为1、3、10、30及100 μmol/L的隐丹参酮处理细胞,以便找到隐丹参酮处理食管癌细胞的最适浓度。通过MTT实验检测隐丹参酮对人食管癌HCE-4细胞的杀伤效果,发现隐丹参酮对HCE-4细胞具有增殖抑制作用,呈剂量依赖性,且IC50值为16.5 μmol/L,并通过Annexin V-FITC/PI双染和流式细胞术实验检测隐丹参酮对HCE-4细胞的诱导凋亡能力,在荧光显微镜下发现随着化合物处理时间的不断增加,细胞形态发生不规则变化并出现凋亡小体,细胞荧光强度逐渐增强,凋亡细胞数量逐渐增多,与倒置显微镜下所观察结果相似。
多年研究发现,线粒体凋亡途径诱导的细胞凋亡是被多种上游因子刺激后引发的,整个途径受到多种因素的调控,包括Bcl-2家族的pro、抗凋亡蛋白和磷脂酰肌醇3-激酶(PI3K)/AKT/mTOR途径[15]。与正常细胞相比,Bcl-2家族成员中的抗凋亡蛋白发生失调是癌细胞的定义特征之一,它的存在会提高肿瘤细胞对当前所用治疗方式的抵抗[16],因此这些家族的成员已成为治疗众多癌症的靶标。AKT是调节细胞增殖、凋亡和迁移的重要信号分子,研究显示PI3K/AKT可以通过磷酸化Bad、释放抗凋亡蛋白Bcl-2以及激活caspase3/7等凋亡通路,进而调控细胞凋亡[17-18]。同时也有研究显示,隐丹参酮可以通过激活下游的caspase-3信号通路抑制胆管癌HCCC-9810细胞的增殖[19]。此外,MAPK是ras-MAPK信号通路的核心成分,MAPK激活后可以促进细胞核内c-Fos、c-Jun和c-Myc等转录因子的氨基酸残基发生磷酸化,从而调控基因的表达以促进细胞的生长、分化和凋亡[20]。其中,P38和JNK可以通过上调cleaved-caspase-3和PARP的表达,诱导乳腺癌细胞凋亡[21];而ERK也可以通过磷酸化p53、AKT等蛋白诱导肿瘤细胞凋亡[22-23],表明MAPK信号通路在肿瘤的发生发展过程中扮演着重要的角色。为了验证隐丹参酮是否通过调控以上通路诱导食管癌HCE-4细胞凋亡,利用Western blot实验对上游相关蛋白表达情况进行检测,发现隐丹参酮可以上调p-JNK、p-p38、caspase-3和PARP蛋白的表达,下调p-ERK、p-AKT和Bcl-2蛋白的表达。以上结果表明,隐丹参酮可以通过调控MAPK和AKT信号通路诱导人食管癌HCE-4细胞凋亡。
研究显示,活性氧(ROS)是人体内代谢的正常产物,在细胞信号和体内平衡过程中发挥重要的作用[24]。当细胞内ROS水平升高时,线粒体的通透性发生改变,基质肿胀,外膜破裂,导致细胞凋亡信号分子释放。此外,ROS还具有调节信号分子活性的作用,如NF-κB、AP-1和MAPK等信号通路,进而表现出调控细胞生长、分化、凋亡和侵袭等生物学效应[25]。本实验通过流式细胞术检测细胞内活性氧水平,发现随着隐丹参酮处理时间的不断增加,HCE-4细胞内ROS水平不断升高。同时,隐丹参酮与NAC共同处理细胞后,细胞凋亡程度明显低于隐丹参酮单独处理组,隐丹参酮的诱导凋亡能力被抑制,这表明隐丹参酮可以通过上调细胞内ROS的水平,诱导人食管癌HCE-4细胞凋亡。
综上所述,隐丹参酮对人食管癌HCE-4细胞具有良好的杀伤作用,其分子机制可能是隐丹参酮通过增加细胞内活性氧水平,调控MAPK和AKT信号通路,进而诱导HCE-4细胞凋亡,这为食管癌以及其他癌症的治疗与新药开发提供了新思路。
| [1] | Kagemoto K, Urabe Y, Miwata T, et al. ADH1B and ALDH2 are associated with metachronous SCC after endoscopic submucosal dissection of esophageal squamous cell carcinoma[J]. Cancer Med, 2016, 5(7): 1397–404. DOI:10.1002/cam4.2016.5.issue-7 |
| [2] | 朱雄杰, 田瑶, 朱娟娟, 等. 食管癌的靶向治疗研究进展[J]. 实用医学杂志, 2017, 33(12): 1910–2. [ Zhu XJ, Tian Y, Zhu JJ, et al. Advances in targeted therapies for esophageal cancer[J]. Shi Yong Yi Xue Za Zhi, 2017, 33(12): 1910–2. DOI:10.3969/j.issn.1006-5725.2017.12.004 ] |
| [3] | 孔德海. 食管癌危险因素及预防研究进展[J]. 中国保健营养, 2017, 27(13): 163. [ Kong HD. Risk factors of esophageal cancer and prevention research progress[J]. Zhongguo Bao Jian Ying Yang, 2017, 27(13): 163. ] |
| [4] | Du H, Che J, Shi M, et al. Beclin 1 expression is associated with the occurrence and development of esophageal squamous cell carcinoma[J]. Oncol Lett, 2017, 14(6): 6823–8. |
| [5] | Wang J, Zhang G, Dai C, et al. Cryptotanshinone potentiates the antitumor effects of doxorubicin on gastric cancer cells via inhibition of STAT3 activity[J]. J Int Med Res, 2017, 45(1): 220–30. DOI:10.1177/0300060516685513 |
| [6] | Lu L, Zhang S, Li C, et al. Cryptotanshinone inhibits human glioma cell proliferation in vitro and in vivo through SHP-2-dependent inhibition of STAT3 activation[J]. Cell Death Dis, 2017, 8(5): e2767. DOI:10.1038/cddis.2017.174 |
| [7] | 尧义, 李惠长, 钱本江, 等. 隐丹参酮对前列腺癌DU145细胞中异黏蛋白表达的影响[J]. 中华男科学杂志, 2015, 21(9): 782–7. [ Yao Y, Li HC, Qian BJ, et al. Crypotanshione reduces the expression of metadherin in DU145 prostate cancer cells[J]. Zhonghua Nan Ke Xue Za Zhi, 2015, 21(9): 782–7. ] |
| [8] | Liu C, Sun HN, Luo YH, et al. Cryptotanshinone induces ROS-mediated apoptosis in human gastric cancer cells[J]. Oncotarget, 2017, 8(70): 115398–412. |
| [9] | Pan Y, Shi J, Ni W, et al. Cryptotanshinone inhibition of mammalian target of rapamycin pathway is dependent on oestrogen receptor alpha in breast cancer[J]. J Cell Mol Med, 2017, 21(9): 2129–39. DOI:10.1111/jcmm.13135 |
| [10] | 李伟, 刘超, 郭志敏, 等. 隐丹参酮通过抑制帽子依赖的翻译促进人肺癌细胞A549的凋亡[J]. 肿瘤防治研究, 2016, 43(7): 550–4. [ Li W, Liu C, Guo ZM, et al. Cryptotanshinone promotes apoptosis of A549 cells via inhibiting cap-dependent mRNA translation[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(7): 550–4. DOI:10.3971/j.issn.1000-8578.2016.07.002 ] |
| [11] | 倪珊珊, 廖广辉, 张广顺, 等. 三氧化二砷与隐丹参酮不同配比对人肝癌HepG2裸鼠移植瘤的抑制作用[J]. 浙江中医药大学学报, 2015, 39(1): 62–6. [ Ni SS, Liao GH, Zhang GS, et al. The Effects of Compatibility of Arsenic Trioxide and Cryptotanshinone on Human Hepatocarcinoma Nude Mice[J]. Zhejiang Zhong Yi Yao Da Xue Xue Bao, 2015, 39(1): 62–6. ] |
| [12] | 叶因涛, 徐文清, 仲巍. 隐丹参酮对宫颈癌Hela细胞增殖及细胞凋亡的影响[J]. 中国中药杂志, 2010, 35(1): 118–21. [ Ye YT, Xu WQ, Zhong W. Effects of cryptotanshinone on proliferation and apoptosis of Hela cell line of cervical cancer[J]. Zhongguo Zhong Yao Za Zhi, 2010, 35(1): 118–21. ] |
| [13] | 叶因涛, 王晨, 宋晓坤, 等. 隐丹参酮对肝癌H22荷瘤小鼠放射增敏作用的影响[J]. 中国癌症杂志, 2014, 24(1): 29–34. [ Ye YT, Wang C, Song XK, et al. The radiosensitizing effects of cryptotanshinone on H22 hepatoma-bearing mice[J]. Zhongguo Ai Zheng Za Zhi, 2014, 24(1): 29–34. DOI:10.3969/j.issn.1007-3969.2014.01.005 ] |
| [14] | 唐焕焕, 沈晓燕, 段小群, 等. 隐丹参酮抑制恶性神经胶质瘤细胞C6增殖及对JAK2-STAT3信号通路的影响[J]. 安徽医科大学学报, 2016, 51(6): 769–72. [ Tang HH, Shen XY, Duan XQ, et al. Cryptotanshinone inhibits proliferation of malignant glioma C6 cells and its influence on JAK2-STAT3 signal pathway[J]. Anhui Yi Ke Da Xue Xue Bao, 2016, 51(6): 769–72. ] |
| [15] | Kalimuthu S, Se-Kwon K. Cell survival and apoptosis signaling as therapeutic target for cancer: marine bioactive compounds[J]. Int J Mol Sci, 2013, 14(2): 2334–54. DOI:10.3390/ijms14022334 |
| [16] | Weyhenmerver B, Murphy AC, Prehn JH, et al. Targeting the anti-apoptotic Bcl-2 family members for the treatment of cancer[J]. Exp Oncol, 2012, 34(3): 192–9. |
| [17] | Zhang J, Li L, Peng Y, et al. Surface chemistry induces mitochondria-mediated apoptosis of breast cancer cells via PTEN/PI3K/AKT signaling pathway[J]. Biochim Biophys Acta, 2018, 1865(1): 172–85. DOI:10.1016/j.bbamcr.2017.10.007 |
| [18] | 陈春雷, 弓建华, 缪辉来, 等. 隐丹参酮对人胆管癌HCCC-9810细胞增殖、survivin基因及caspase-3蛋白表达的影响[J]. 广东医学院学报, 2013, 31(1): 4–7. [ Chen CL, Gong JH, Miao HL, et al. Effect of cryptotanshinone on proliferation and expression of survivin gene and caspase 3 protein in HCCC 9810 cells[J]. Guangdong Yi Xue Yuan Xue Bao, 2013, 31(1): 4–7. DOI:10.3969/j.issn.1005-4057.2013.01.002 ] |
| [19] | Chai R, Fu H, Zheng Z, et al. Resveratrol inhibits proliferation and migration through SIRT1 mediated post-translational modification of PI3K/AKT signaling in hepatocellular carcinoma cells[J]. Mol Med Rep, 2017, 16(6): 8037–44. DOI:10.3892/mmr.2017.7612 |
| [20] | 邓立力, 赵玉莹, 姜秋颖, 等. 胃癌细胞中JAK-STAT和ras-MAPK信号通路相关基因的表达及意义[J]. 肿瘤防治研究, 2013, 40(11): 1027–30. [ Deng LL, Zhao YY, Jiang QY, et al. Gene expression and significance of JAK-STAT and ras-MAPK signaling pathways in gastric cancer cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2013, 40(11): 1027–30. DOI:10.3971/j.issn.1000-8578.2013.11.004 ] |
| [21] | Ahn J, Chung YW, Park JB, et al. ω-hydroxyundec-9-enoic acid induces apoptosis by ROS mediated JNK and p38 phosphorylation in breast cancer cell lines[J]. J Cell Biochem, 2018, 119(1): 998–1007. DOI:10.1002/jcb.26267 |
| [22] | Song H, Wei M, Liu W, et al. Cisplatin induced apoptosis of ovarian cancer A2780s cells by activation of ERK/p53/PUMA signals[J]. Histol Histopathol, 2018, 33(1): 73–9. |
| [23] | Kang K, Zhang J, Zhang X, et al. MicroRNA-326 inhibits melanoma progression by targeting KRAS and suppressing the AKT and ERK signalling pathways[J]. Oncol Rep, 2018, 39(1): 401–10. |
| [24] | Zhou YQ, Liu DQ, Chen SP, et al. Reactive oxygen species scavengers ameliorate mechanical allodynia in a rat model of cancer-induced bone pain[J]. Redox Biol, 2018, 14(6): 391–7. |
| [25] | Moris D, Spartalis M, Tzatzaki E, et al. The role of reactive oxygen species in myocardial redox signaling and regulation[J]. Ann Transl Med, 2017, 5(16): 324. DOI:10.21037/atm |
 2018, Vol. 45
2018, Vol. 45


