文章信息
- 少突胶质细胞瘤中染色体1p/19q联合缺失与MGMT基因启动子甲基化的相关性
- Correlation Between Codeletion of Chromosome 1p/19q and MGMT Promoter Methylation in Oligodendrogliomas
- 肿瘤防治研究, 2018, 45(8): 550-554
- Cancer Research on Prevention and Treatment, 2018, 45(8): 550-554
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1543
- 收稿日期: 2018-01-08
- 修回日期: 2018-03-28
2. 710061 西安,西安交通大学第一附属医院神经外科
2. Department of Neurosurgery, The First Affiliated Hospital of Xi'an Jiaotong University, Xi'an 710061, China
胶质瘤是中枢神经系统最常见的肿瘤,占颅内原发肿瘤的60%,少突胶质细胞瘤约占胶质瘤的5%~10%[1],发生率仅次于星形细胞瘤,以往少突胶质细胞瘤的病理诊断主要依靠显微镜下观察组织学特点、免疫组织化学检测相关蛋白来实现,2016年WHO首次推出整合组织学表型和基因型的中枢神经系统肿瘤分类方法,并第一次以分子分型作为肿瘤分型的核心依据[2],染色体1p/19q联合缺失就是在这次分类中引入的重要分子参数,是少突胶质细胞瘤的诊断性分子标志物[3]。06-甲基鸟嘌呤-DNA-甲基转移酶(06-methylguanine-DNA methyltransferase, MGMT)是一种DNA损伤修复酶,它在胶质瘤中的表达与肿瘤耐药性相关,而MGMT基因启动子的甲基化状态是决定MGMT表达量的主要因素,并可能影响患者的化疗效果及其预后[4]。本研究分别采用荧光原位杂交技术(fluorescence in situ hybridization, FISH)和巢式甲基化特异性PCR(methylation specific PCR, MSP)技术检测少突胶质细胞瘤染色体1p/19q联合缺失及MGMT基因启动子甲基化状态,分析探讨二者的相关性及临床意义,以期为胶质瘤患者的诊治提供更多理论依据。
1 资料与方法 1.1 临床资料收集西安交通大学第一附属医院2012~2016年手术切除且组织学表型为少突胶质细胞瘤的患者共计67例,其中男40例、女27例,年龄7~81岁,平均年龄47.6岁,患者均为首发病例,且术前未进行放疗、化疗或生物治疗。根据WHO病理分级标准,诊断为WHOⅡ级少突胶质细胞瘤35例、WHOⅢ级间变型少突胶质细胞瘤32例,所有病例均经两位以上有经验的病理医师同时阅片,另选星形细胞瘤20例、瘤周正常脑组织20例作为对照。
1.2 方法 1.2.1 染色体1p/19q联合缺失检测于光学显微镜下选择无出血及坏死的肿瘤区域,使用1p/19q双色荧光探针试剂盒(广州安必平医药科技有限公司),按说明书进行操作。在杂交区域处加入10 μl探针并盖上盖玻片,放入杂交仪,设定程序:85℃变性10 min,37℃杂交16 h;杂交完成后4', 6-二脒基-2-苯基吲哚(4', 6-diomidino-2-phenylindole, DAPI)复染剂进行样本区复染,莱卡DM4000荧光显微镜下观察结果。结果判断:探针试剂盒中包含lp36/lq21和19q13/19p13两管探针,lp36/1q21包含红色的检测位点探针lp36和绿色的内对照探针lq21,用于检测lp36的缺失情况,19q13/19p13包含红色的检测位点探针19q13和绿色的内对照探针19p13,用于检测19q13的缺失情况,细胞核则由DAPI染成蓝色。随机计数100个肿瘤细胞核中的红色、绿色信号,当lp36/lq21比值或19q13/19p13比值< 0.80时判为lp或19q缺失。
1.2.2 MGMT基因启动子甲基化检测用Qiagen DNA Mini Kit(51304)提取胶质瘤及对照脑组织石蜡包埋标本的基因组DNA,操作步骤按说明书进行。NanoDrop 2000C评估所提取的DNA的质量和浓度,确保DNA吸光度值A260/280均在1.8~2.0之间。用DNA甲基化修饰试剂盒(EpiTect Plus DNA Bisulfite Kit,QIAGEN 59124)对上述抽提的基因组DNA进行亚硫酸氢盐修饰,修饰后甲基化的胞嘧啶(C)保持不变,而未甲基化的C转变为尿嘧啶(U)。巢式MSP:引物序列见表 1,第一步PCR的引物为Pan-f和Pan-r,反应体系20 μl:模板DNA 0.2 μg、10 μmol/L引物各1 μl、zymoTapTMPreMix 10 μl。反应条件:95℃ 10 min,95℃ 30 s、53℃ 30 s、72℃ 30 s,40个循环后72℃延伸10 min,4℃保存。取第一步反应产物1 μl为第二步PCR模板,第二步PCR的甲基化引物为M-f和M-r,非甲基化引物为U-f和U-r,反应体系20 μl:模板DNA 1 μl、10 μmol/L引物各1 μl、zymoTapTMPreMix 10 μl。反应条件:95℃ 5 min,95℃45 s、53℃ 45 s、72℃ 1 min,40个循环后72℃延伸10 min,4℃保存。以健康者外周血淋巴细胞(PBL)DNA作为未甲基化阳性对照,用甲基化酶(MSSsI)处理的PBL DNA作为甲基化阳性对照,蒸馏水代替模板作为空白阴性对照。PCR产物用9%聚丙酰胺凝胶电泳分离,DNA Marker 50 bp为相对分子质量标准,用AlphaImager HP荧光/可见光凝胶成像分析系统观察分析电泳结果。结果判定:电泳结果中出现非甲基条带(U)扩增,而不出现甲基化条带(M)扩增,判断为非甲基化;仅M条带或U和M条带均出现扩增,则判定为甲基化。
应用SPSS18.0统计软件进行数据分析,采用χ2检验、Fisher精确概率法检验和Spearman等级相关分析,P < 0.05为差异有统计学意义。
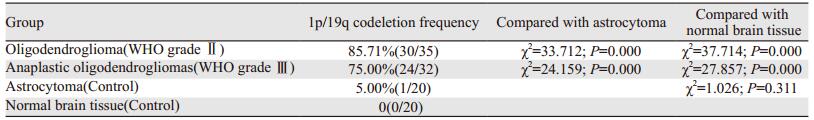
2 结果 2.1 染色体1p/19q联合性缺失检测结果少突胶质细胞瘤及间变型少突胶质细胞瘤组1p/19q联合缺失率均显著高于星形细胞瘤组及正常脑组织组,差异有统计学意义(P < 0.05);而星形细胞瘤组与正常脑组织组相比差异无统计学意义(P > 0.05);少突胶质细胞瘤(WHOⅡ级)组1p/19q联合缺失率略高于间变型少突胶质细胞瘤(WHOⅢ级)组,但差异无统计学意义(χ2=1.227, P=0.268),见图 1、表 2。提示1p/19q联合缺失与少突胶质细胞瘤的病理分级无关,而在少突胶质细胞瘤和星形细胞瘤鉴别诊断中有意义。
|
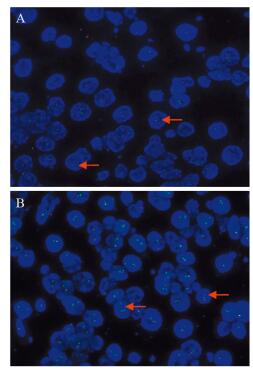
| A: 1p deletion; B: 19q deletion 图 1 荧光原位杂交方法检测少突胶质瘤染色体1p/19q缺失情况 Figure 1 1p/19q codeletion in chromosome oligodendroglioma detected by FISH |
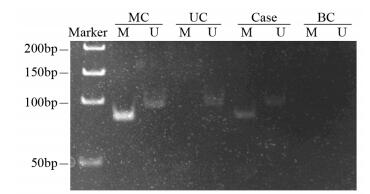
少突胶质细胞瘤组、间变型少突胶质细胞瘤组、星形细胞瘤组的MGMT基因启动子甲基化率均显著高于正常脑组织组(P < 0.05),但三者组间比较差异无统计学意义(χ2=1.373, P=0.503),见表 3、图 2。
|
| MC: methylation positive control; UC: unmethylation control; BC: blank control(water); Case: specimen of the patient 图 2 少突胶质细胞瘤中MGMT启动子甲基化 Figure 2 Methylation status of MGMT promoter in oligodendrogliomas |
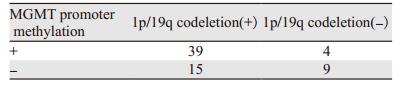
在67例少突胶质细胞瘤中,共有43例发生MGMT启动子甲基化,其中39例(90.70%)同时发生1p/19q联合性缺失;而在未发生MGMT启动子甲基化的24例少突胶质细胞瘤中只有15例(62.5%)出现1p/19q联合性缺失,两者相比差异有统计学意义(χ2=7.831, P=0.005)。另外9例少突胶质细胞瘤未检测出1p/19q联合缺失或MGMT基因启动子甲基化。Spearman等级相关分析显示少突胶质细胞瘤1p/19q联合缺失与MGMT基因启动子甲基化呈正相关(r=0.342, P=0.005),见表 4。
|
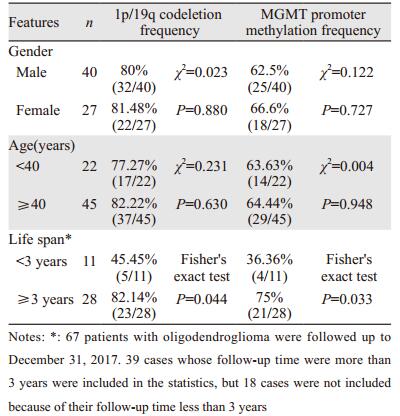
1p/19q联合性缺失率、MGMT基因启动子甲基化率与少突胶质细胞瘤患者的性别、年龄无关(P > 0.05),而与3年生存率密切相关,差异有统计学意义(P < 0.05)。生存期大于3年者的1p/19q联合性缺失率、MGMT基因启动子甲基化率均显著高于生存期小于3年者,提示二者与患者预后呈正相关,见表 5。
|
少突胶质细胞瘤是胶质瘤的一种独立类型,瘤细胞形态类似少突胶质细胞,呈圆形或多角形,排列成蜂窝状,胞核圆形、大小较一致,胞质透亮;典型病例常可见微钙化、分支状毛细血管,亦可见星形细胞瘤样成分。由于瘤细胞与周围正常脑组织没有明显界限,呈交织侵袭性生长,难以彻底切除肿瘤,因此,术后进一步化疗就显得尤为重要。但在临床实践中发现,组织学特征及WHO分级相同的个体对同一化疗方案的反应和预后不一致,从分子遗传学观点出发,胶质瘤是一类基因水平高度异质性的疾病,病理组织学形态相同的胶质瘤的分子遗传学改变不尽一致,从而导致肿瘤治疗反应和预后的差别,针对患者基因的个体差异,进行“量体裁衣”制定化疗方案,实现个体化治疗,使患者在化疗中最大获益,是未来脑胶质瘤的治疗方向[5]。
染色体lp/19q联合缺失是指1号染色体短臂和19号染色体长臂同时缺失,Reifenberger等[6]最早发现少突胶质细胞瘤中存在较高频率的lp/19q联合缺失。随后研究也表明,1p/19q联合缺失在少突胶质瘤中常见,发生率可达80%~90%,在间变性少突胶质细胞瘤中发生率为50%~70%,而在星形细胞瘤中发生率较低[7]。有1p/19q联合缺失的少突胶质细胞瘤,术后复发或者进展至更高级别时,该项分子遗传学改变依然存在[8]。据此WHO认为lp/19q联合缺失是少突胶质细胞瘤的分子特征,是其诊断性分子标志物,可用于鉴别少突胶质细胞瘤和星形细胞瘤,对于治疗选择有重要意义。在本组病例中,少突胶质细胞瘤及间变型少突胶质细胞瘤中1p/19q联合性缺失率分别达85.71%、75.00%,显著高于星形细胞瘤的5.00%,与文献报道基本一致。
国外多项临床随机对照试验显示1p/19q联合缺失还是少突胶质细胞瘤化疗敏感度及预后的重要预测指标,存在1p/19q联合缺失的少突胶质细胞瘤生长速度较慢,对PCV化疗方案(甲基苄肼+洛莫司汀+长春新碱)敏感,反应率达100%,而仅有25%的无1p/19q联合缺失的肿瘤对PCV化疗方案有反应[9];除PCV方案外,具有1p/19q联合缺失的少突胶质细胞瘤对替莫唑胺(temozolomide, TMZ)亦有较高的反应率,Brandes等[10]发现具有1p/19q联合缺失的间变或复发少突胶质细胞瘤中,59.4%的肿瘤对TMZ敏感。由于具有lp/19q缺失的少突胶质细胞瘤患者能够受益于PCV、TMZ化疗方案,故生存期较无缺失者显著延长[11]。本文研究结果也显示1p/19q联合缺失率虽与少突胶质细胞瘤患者性别、年龄、病理分级无关,但与生存率密切相关,生存期大于3年者1p/19q联合性缺失率显著高于生存期小于3年者,提示1p/19q联合缺失可作为少突胶质细胞瘤患者预后因子。
MGMT是一种DNA修复酶,可以通过修复烷化剂如亚硝脲及TMZ造成的胶质瘤细胞DNA损伤,导致肿瘤耐药。而MGMT基因启动子的甲基化状态是决定MGMT表达量的主要因素,若启动子区域甲基化,则MGMT不表达或低表达,肿瘤对烷化剂敏感。由于1p/19q联合缺失的少突胶质瘤对含烷化剂的PCV化疗方案及TMZ敏感,故有部分学者猜测,这些肿瘤的化疗敏感度可能与MGMT基因启动子甲基化有关[12],因此本文研究了少突胶质细胞瘤1p/19q联合性缺失与MGMT基因启动子甲基化的相关性,结果显示少突胶质细胞瘤1p/19q联合性缺失与MGMT基因启动子甲基化呈正相关性,提示1p/19q联合缺失患者对化疗敏感有可能是因为同时伴有MGMT基因启动子甲基化所导致。以往研究显示1p/19q联合性缺失是少突胶质细胞瘤发生的早期事件,而MGMT启动子甲基化多发生在肿瘤进展期,因而推测二者之间可能存在因果关系[13],但其内在机制仍需深入探讨。进一步比较少突胶质细胞瘤、间变型少突胶质细胞瘤、星形细胞瘤的MGMT基因启动子甲基化率,结果显示各组间差异无统计学意义,提示其在鉴别少突胶质细胞瘤及星形细胞瘤中意义不大。与1p/19q联合缺失的研究结果相似,MGMT基因启动子甲基化亦与少突胶质细胞瘤患者的性别、年龄、病理分级无关,而与生存率呈正相关,提示可以用来评估预后。
综上所述,染色体1p/19q联合缺失不仅是少突胶质细胞瘤特异性分子标志物,而且与MGMT基因启动子甲基化有正相关性,检测1p/19q联合缺失在一定程度上可以估测MGMT基因启动子甲基化情况,从而提高临床病理诊断的精确性,而且对胶质瘤的治疗及预后判断具有重要的指导作用。
| [1] | Choi KY, Jung TY, Jung S, et al. Prognosis of oligodendroglial tumor with ring enhancement showing central necrotic portion[J]. J Neurooncol, 2011, 103(1): 103–10. DOI:10.1007/s11060-010-0353-z |
| [2] | Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary[J]. Acta Neuropathol, 2016, 131(6): 803–20. DOI:10.1007/s00401-016-1545-1 |
| [3] | Karine M, Marie de Tayrac, Myreille D'Astous, et al. Contribution of 1p, 19q, 9p and 10q Automated Analysis by FISH to the Diagnosis and Prognosis of Oligodendroglial Tumors According to WHO 2016 Guidelines[J]. PLoS One, 2016, 11(12): e0168728. DOI:10.1371/journal.pone.0168728 |
| [4] | Ida CM, Butz ML, Jenkins RB, et al. Real-Time Methylation-Specific Polymerase Chain Reaction for MGMT Promoter Methylation Clinical Testing in Glioblastoma: An Alternative Detection Method for a Heterogeneous Process[J]. Am J Clin Pathol, 2017, 148(4): 296–307. |
| [5] | Ene CI, Holland EC. Personalized medicine for gliomas[J]. Surg Neurol Int, 2015, 6(Suppl 1): S89–95. |
| [6] | Reifenberger J, Reifenberger G, Liu L, et al. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic deletions on 19q and 1p[J]. Am J Pathol, 1994, 145(5): 1175–90. |
| [7] | Jansen M, Yip S, Louis DN. Molecular pathology in adult glioms: diagnostic, prognostic, and predictive markers[J]. Lancet Neurol, 2010, 9(7): 717–26. DOI:10.1016/S1474-4422(10)70105-8 |
| [8] | Pai T, Epari S, Desai S, et al. Histological spectrum of oligodendroglial tumors: Only a subset shows 1p/19q codeletion[J]. Neurol India, 2017, 65(1): 113–20. DOI:10.4103/0028-3886.198195 |
| [9] | Cairncross JG, Ueki K, Zlatescu MC, et al. Specific genetic predictors of chemotherapeutic response and survival in patients with anaplastic oligodendrogliomas[J]. J Natl Cancer Inst, 1998, 90(19): 1473–9. DOI:10.1093/jnci/90.19.1473 |
| [10] | Brandes AA, Tosoni A, Cavallo G, et al. Correlations between O6-methylguanine DNA methyltransferase promoter methylation status, 1p and 19q deletions, and response to temozolomide in anaplastic and recurrent oligodendroglioma: a prospective GICNO study[J]. J Clin Oncol, 2006, 24(29): 4746–53. DOI:10.1200/JCO.2006.06.3891 |
| [11] | Weller M, Stupp R, Hegi ME, et al. Personalized care in neuro-oncology coming of age: why we need MGMT and lp/19q testing for malignant glioma patients in clinical practice[J]. Neuro Oncol, 2012, 14(suppl): ivl00–8. |
| [12] | Deb P, Mani NS, Sudumbrekar SM, et al. Correlation of histomorphologic prognostic markers and proliferative index with loss of heterozygosity 1p/19q and MGMT status in diffusely infiltrating gliomas[J]. Med J Armed Forces India, 2013, 69(3): 228–36. DOI:10.1016/j.mjafi.2012.08.030 |
| [13] | Boots-Sprenger SH, Sijben A, Rijntjes J, et al. Significance of complete 1p/19q co-deletion, IDH1 mutation and MGMT promoter methylation in gliomas: use with caution[J]. Mod Pathol, 2013, 26(7): 922–9. DOI:10.1038/modpathol.2012.166 |
 2018, Vol. 45
2018, Vol. 45