文章信息
- 脂质体紫杉醇联合卡铂与紫杉醇联合卡铂治疗上皮性卵巢癌的疗效和安全性比较
- Comparison of Efficacy and Safety Between Liposome-paclitaxel plus Carboplatin and Paclitaxel plus Carboplatin on Epithelial Ovarian Cancer
- 肿瘤防治研究, 2018, 45(6): 410-413
- Cancer Research on Prevention and Treatment, 2018, 45(6): 410-413
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1516
- 收稿日期: 2017-11-28
- 修回日期: 2018-03-12
卵巢癌是女性生殖系统常见的恶性肿瘤[1],其发病率居妇科恶性肿瘤的第3位,仅次于宫颈癌和子宫内膜癌,死亡率居女性生殖系统恶性肿瘤之首[2]。卵巢癌起病隐匿,早期症状不明显,致使约70%的患者确诊时已属晚期,其5年生存率约为40%[3]。肿瘤细胞减灭术及铂类联合紫杉醇的系统化疗是治疗卵巢癌的金标准[4]。本研究比较了脂质体紫杉醇联合卡铂与紫杉醇联合卡铂治疗上皮性卵巢癌的疗效和不良反应,从而为脂质体紫杉醇的临床应用提供参考。
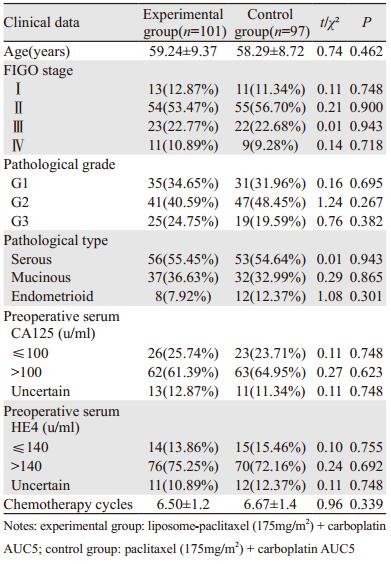
1 资料与方法 1.1 一般资料选取2013年1月至2016年1月在苏州大学附属第一医院初治的213例上皮性卵巢癌患者进行研究,所有患者均接受手术治疗(根据患者具体分期选择卵巢癌全面分期手术或卵巢肿瘤细胞减灭术),术后所有患者经数字表法随机分成试验组(脂质体紫杉醇联合卡铂化疗组)和对照组(紫杉醇注射液联合卡铂化疗组),在第2化疗周期后开始评价疗效及相关化疗不良反应。入组198例患者均完成不少于6周期化疗(未能完成6周期化疗的15例研究对象已剔除)其中试验组101例,平均年龄59.24±9.37岁,平均化疗6.50疗程;对照组97例,平均年龄58.29±8.72岁,平均化疗6.67疗程。根据FIGO分期,其中Ⅰ期患者24例、Ⅱ期患者109例、Ⅲ期患者45例、Ⅳ期20例。两组患者年龄、分期、分级、病理类型、术前血清肿瘤标志物和化疗疗程等临床特征均衡,具有可比性。两组患者一般资料对比情况,见表 1。
试验组给予注射用紫杉醇脂质体(力扑素,南京思科药业有限公司,国药准字H20030357)175 mg/m2+卡铂AUC5,每次化疗前30 min予地塞米松10 mg静脉滴注+非那根25 mg肌肉注射。对照组给予紫杉醇(泰素,美国百时美施贵宝制药公司,进口药品注册证号H20090547)175 mg/m2+卡铂AUC5,每次化疗前一晚9点予地塞米松10 mg静脉注射,化疗当日凌晨3点予地塞米松10 mg静脉注射,化疗前30 min予地塞米松10 mg静脉滴注+非那根25 mg肌肉注射,两组化疗周期均为21 d。
1.3 疗效判断治疗过程中每次化疗前所有患者均接受妇科检查(包括双合诊和三合诊)、影像学检查(每次化疗前复查胸部平片、盆腹部B型超声,每6月复查胸腹盆腔CT检查)和肿瘤标志物检查(包括CA125及HE4等),近期疗效评定按照实体肿瘤RECIST 1.1评价标准[5]分为:完全缓解(CR):所有靶病变完全消失;部分缓解(PR):靶病变最大径之和减少≥30%;稳定(SD):病变处于部分缓解和进展之间;进展(PD):靶病变最大径之和增大≥20%或出现新病灶。CR+PR为有效,总有效率=(CR+PR)/n×100%。
1.4 不良反应判断安全性评价参考美国国立癌症研究所的常规毒性判定标准NCI-CTC4.0评价[6]。不良反应主要包括面部潮红、皮疹、过敏反应、脱发、恶心及呕吐、药物性发热、腹泻、口腔溃疡、白细胞减少、血小板减少、肝功能损害、肾功能损害以及周围神经毒性。其严重程度按WHO标准分为轻度(Ⅰ级)、中度(Ⅱ级)、重度(Ⅲ级)、危及生命(Ⅳ级),Ⅲ~Ⅳ级为严重不良反应。
1.5 统计学方法采用SPSS19.0统计软件进行统计分析,计数资料组间比较采用χ2检验或Fisher精确检验,P < 0.05为差异有统计学意义。
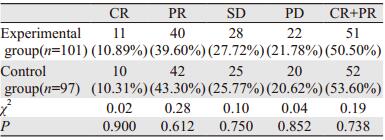
2 结果 2.1 疗效治疗2周期后,试验组和对照组的CR、PR、SD、PD分别为10.89% vs. 10.31%、39.60% vs. 43.30%、27.72% vs. 25.77%、21.78% vs. 20.62%。试验组和对照组的总有效率为50.50% vs. 53.60%,差异无统计学意义(P=0.738),见表 2。
共有22例患者在化疗(6~8周期)结束后出现复发,复发时间为4~22月,中位数为14月,其中试验组6例(27.27%),对照组16例(72.72%)(χ2=5.58, P=0.029),提示试验组患者较对照组复发率更低。
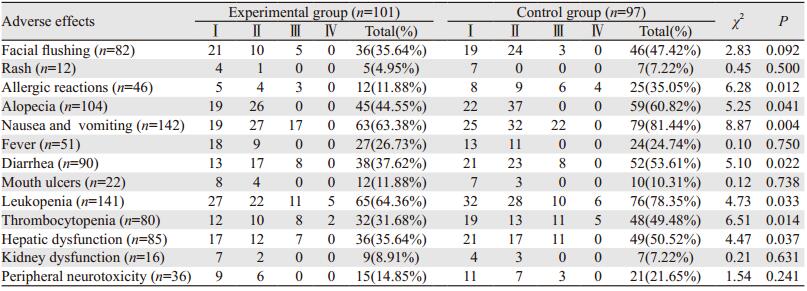
2.3 不良反应在过敏反应、脱发、恶心呕吐、腹泻、白细胞减少、血小板减少、肝功能损害方面,试验组患者均明显低于对照组患者,两组差异有统计学意义(均P < 0.05)。而在面部潮红、皮疹、药物性发热、口腔溃疡、肾功能损害、周围神经毒性方面两组患者比较差异无统计学意义(均P > 0.05),见表 3。两组共22例患者出现Ⅳ级不良反应,其中过敏反应4例,白细胞减少11例,血小板减少7例,经抗过敏、粒细胞集落刺激因子(G-CSF)、巨核细胞集落刺激因子(IL-11)、成分输血或血浆等对症治疗后均恢复正常,后继续接受化疗。
紫杉醇(paclitaxel, PTX)作为双萜紫杉烷类抗癌药物,已广泛应用于卵巢癌、乳腺癌和非小细胞肺癌等多种恶性肿瘤的治疗[7],PTX联合卡铂是上皮性卵巢癌一线化疗的标准方案[8],由于紫杉醇注射液难溶于水及多种药用溶媒,目前采用聚氧乙基代蓖麻油与无水乙醇复合溶媒,所以其容易在体内促进组织胺释放,诱导产生过敏反应,甚至严重的超过敏反应[9],同时,因需使用类固醇类药物进行预处理,从而限制了其在严重糖尿病、消化道溃疡及糖皮质激素使用禁忌的患者中使用。脂质体紫杉醇是一种新型的药物载体,其用磷脂双分子层将紫杉醇包裹起来,从而形成一个闭合的囊泡,将磷脂酰胆碱、胆固醇、紫杉醇按照一定的比例制成,由此可以改善药物的溶解性、延长药物的半衰期、增强药物的靶向性、降低药物的不良反应[10]。
本研究中,脂质体紫杉醇联合卡铂治疗组的总有效率为50.50%,与对照组(紫杉醇联合卡铂组)相比差异无统计学意义(P > 0.05),提示脂质体紫杉醇在上皮性卵巢癌患者中可达到与进口紫杉醇注射液相同的疗效。本研究结果提示脂质体紫杉醇治疗组患者较对照组复发率更低。这是由于紫杉醇脂质微粒直径仅500 nm,而肿瘤组织毛细血管壁本身不完整的特点,使得紫杉醇脂质体更容易进入肿瘤组织,并在肿瘤组织蓄积[11],同时,由于脂质体制剂具有被动靶向性,其进入体内易被单核巨噬细胞识别和吞噬,在卵巢、肝、脾、肺、淋巴等内皮组织中的浓度明显高于紫杉醇注射液[12],有助于提高靶组织中的药物浓度,为上皮性卵巢癌患者提供更多的选择。
在化疗安全性方面,本研究结果提示试验组患者在过敏反应、脱发、恶心及呕吐、腹泻、白细胞减少、血小板减少、肝功能损害方面明显低于对照组(均P < 0.05);而在面部潮红、皮疹、药物性发热、口腔溃疡、肾功能损害、周围神经毒性方面两组患者比较,差异无统计学意义(均P > 0.05),提示紫杉醇脂质体可明显减少化疗患者的过敏反应、骨髓抑制、胃肠道反应及肝功能损害,具有更好的耐受性和安全性。Soepenberg等[13]通过临床药代动力学研究表明,在相同治疗剂量下,紫杉醇脂质体在血液中的浓度明显低于紫杉醇注射液,因此对骨髓造血系统的抑制作用较紫杉醇注射液明显减轻,同时有研究证明[14],脂质体紫杉醇比原始紫杉醇具有更强的细胞毒性和较高的稳定性,从而提高抗肿瘤的疗效、减少不良反应的发生。另外,由于紫杉醇脂质体在肝、脾、肺等网状内皮系统较发达的脏器分布较多,并可以长时间保持较高浓度,在体内提供了一个缓慢释放药物的储存库[15],从而有效地降低了紫杉醇的毒性,也由此证实脂质体紫杉醇安全性优于紫杉醇注射液。
此外,因紫杉醇注射液需预处理以防止严重过敏反应,需在化疗前一晚9点、化疗当日凌晨3点及化疗前30 min使用地塞米松,而脂质体紫杉醇无需预处理[16],仅需在化疗前30 min使用一次地塞米松预防过敏反应,由此可见,脂质体紫杉醇在使用方法上更加简单,减少患者额外的痛苦及负担,同时,由于明显减少地塞米松等糖皮质激素的使用量,对于糖尿病、消化性溃疡及糖皮质激素使用禁忌的患者来说,脂质体紫杉醇更加安全。
本研究结果显示,脂质体紫杉醇联合卡铂与紫杉醇联合卡铂方案治疗上皮性卵巢癌疗效相当,但脂质体紫杉醇联合卡铂方案在过敏反应、骨髓抑制、胃肠道反应及肝功能损害方面的不良反应明显低于紫杉醇联合卡铂方案,具有更好的安全性。
| [1] | Butow PN, Price MA, Bell ML, et al. Caring for women with ovarian cancer in the last year of life: a longitudinal study of caregiver quality of life, distress and unmet needs[J]. Gynecol Oncol, 2014, 132(3): 690–7. DOI:10.1016/j.ygyno.2014.01.002 |
| [2] | Kaldawy A, Segev Y, Lavie O, et al. Low-grade serous ovarian cancer: A review[J]. Gynecol Oncol, 2016, 143(2): 433–8. DOI:10.1016/j.ygyno.2016.08.320 |
| [3] | Poole EM, Konstantinopoulos PA, Terry KL. Prognostic implications of reproductive and lifestyle factors in ovarian cancer[J]. Gynecol Oncol, 2016, 142(3): 574–87. DOI:10.1016/j.ygyno.2016.05.014 |
| [4] | Jordan S, Steer C, DeFazio A, et al. Patterns of chemotherapy treatment for women with invasive epithelial ovarian cancer--a population-based study[J]. Gynecol Oncol, 2013, 129(2): 310–7. DOI:10.1016/j.ygyno.2013.02.007 |
| [5] | Eisenhauer EA, Verweij J, Eisenhauer EA, et al. 11 New response evaluation criteria in solid tumors: RECIST GUIDELINE VERSION 1.1[J]. EJC Suppl, 2009, 7(2): 5. |
| [6] | 皋文君, 刘砚燕, 袁长蓉. 国际肿瘤化疗药物不良反应评价系统--通用不良反应术语标准4.0版[J]. 肿瘤, 2012, 32(2): 142–4. [ Gao WJ, Liu YY, Yuan CR. International evaluation system for adverse events of chemotherapeutic drugs in cancer treatment: CTCAE v4.0[J]. Zhong Liu, 2012, 32(2): 142–4. ] |
| [7] | van der Burg ME, Onstenk W, Boere IA, et al. Long-term results of a randomised phase Ⅲ trial of weekly versus three-weekly paclitaxel/platinum induction therapy followed by standard or extended three-weekly paclitaxel/platinum in European patients with advanced epithelial ovarian cancer[J]. Eur J Cancer, 2014, 50(15): 2592–601. DOI:10.1016/j.ejca.2014.07.015 |
| [8] | Kumar A, Hoskins PJ, Tinker AV. Dose-dense Paclitaxel in Advanced Ovarian Cancer[J]. Clin Oncol (R Coll Radiol), 2015, 27(1): 40–7. DOI:10.1016/j.clon.2014.10.001 |
| [9] | Cascales-Campos P, López-López V, Gil J, et al. Hyperthermic intraperitoneal chemotherapy with paclitaxel or cisplatin in patients with stage Ⅲ-C/Ⅳ ovarian cancer. Is there any difference?[J]. Surg Oncol, 2016, 25(3): 164–70. DOI:10.1016/j.suronc.2016.05.010 |
| [10] | Koudelka S, Turánek J. Liposomal paclitaxel formulations[J]. J Control Release, 2012, 163(3): 322–34. DOI:10.1016/j.jconrel.2012.09.006 |
| [11] | Wang X, Zhou J, Wang Y, et al. A phaseⅠclinical and pharmacokinetic study of paclitaxel liposome infused in non-small cell lung cancer patients with malignant pleural effusions[J]. Eur J Cancer, 2010, 46(8): 1474–80. DOI:10.1016/j.ejca.2010.02.002 |
| [12] | Liu Y, Ran R, Chen J, et al. Paclitaxel loaded liposomes decorated with a multifunctional tandem peptide for glioma targeting[J]. Biomaterials, 2014, 35(17): 4835–47. DOI:10.1016/j.biomaterials.2014.02.031 |
| [13] | Soepenberg O, Sparreboom A, de Jonge MJ, et al. Real-time pharmacokinetics guiding clinical decisions; phaseⅠstudy of a weekly schedule of liposome encapsulated paclitaxel in patients with solid tumours[J]. Eur J Cancer, 2004, 40(5): 681–8. DOI:10.1016/j.ejca.2003.11.027 |
| [14] | 喻晶, 张慧峰, 雷旦生. 卵巢癌化疗患者紫杉醇血药浓度监测的临床价值[J]. 肿瘤防治研究, 2017, 44(4): 268–71. [ Yu J, Zhang HF, Lei DS, et al. Clinical Value of Pharmacokinetic Monitoring of Serum Paclitaxel Concentration in Paclitaxel-based Chemotherapy on Patients with Ovarian Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(4): 268–71. ] |
| [15] | Yan F, Li L, Deng Z, et al. Paclitaxel-liposome-microbubble complexes as ultrasound-triggered therapeutic drug delivery carriers[J]. J Control Release, 2013, 166(3): 246–55. DOI:10.1016/j.jconrel.2012.12.025 |
| [16] | Liu Y, Ng Y, Toh MR, et al. Lipid-dendrimer hybrid nanosystem as a novel delivery system for paclitaxel to treat ovarian cancer[J]. J Control Release, 2015, 220(PtA): 438–46. |
 2018, Vol. 45
2018, Vol. 45