文章信息
- 桔梗皂苷D对人移行细胞癌5637细胞株的诱导凋亡作用及其分子机制
- Platycodin D Induces Apoptosis of Human Transitional Cell Carcinoma 5637 Cell Lines and Related Molecular Mechanism
- 肿瘤防治研究, 2018, 45(9): 634-639
- Cancer Research on Prevention and Treatment, 2018, 45(9): 634-639
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1515
- 收稿日期: 2017-11-28
- 修回日期: 2018-04-19
2. 133002 延吉,延边大学医学院病理学与法医学教研室
2. Department of Pathology and Forensic Medicine, Yanbian University College of Medicine, Yanji 133002, China
多种中药在膀胱癌治疗中有显著疗效,在预防肿瘤术后复发及转移、减轻放化疗反应方面显得尤为重要。但中药抗肿瘤作用机制尚不十分明确,开发中草药的抗癌作用并明确其作用机制已成为国内外膀胱癌研究的热点。
桔梗盛产于我国长白山地区,药理成分中最重要的组成部分为桔梗皂苷,其中包括桔梗皂苷D[1],有研究表明,桔梗皂苷D有多种药理作用,如抗炎、降血脂、镇咳、镇痛、化痰,辅助治疗糖尿病及肥胖症等[2]。近年来,其在抗肿瘤和调节人体免疫功能方面的作用越来越引起人们的重视。有学者发现,桔梗皂苷D对乳腺癌、肝癌、白血病和宫颈癌等有抑制增殖作用[3-7],但未见对泌尿系统肿瘤的研究。本实验采用HE染色、透射电子显微镜、Western blot等方法观测其对人移行细胞癌5637细胞形态学、细胞凋亡、凋亡通路相关分子Survivin、Livin、Caspase-9、Caspase-8、Caspase-3和Cyt-c蛋白、mRNA表达变化等的影响,以探讨桔梗皂苷D抗肿瘤作用及其机制。
1 材料与方法 1.1 材料 1.1.1 细胞株来源人移行细胞癌5637细胞株购自北京华美试剂公司。
1.1.2 主要仪器高压灭菌器(TOMYES-315,日本TOMY公司),SG基础型超纯水器(德国SG公司),倒置显微镜(IX70,日本OLYMPUS公司),旋涡混合器(上海跃进医疗器械厂),磁力加热搅拌器(江苏中大仪器厂)。
1.1.3 主要试剂丙烯酰胺(美国Sigma公司),亚甲双丙烯酰胺(美国Amresco公司),电泳级甘氨酸(美国Sigma公司),过硫酸铵(美国Promega公司),TEMED(美国Amresco公司),电泳级SDS(美国Sigma公司),分子生物学级Tris(美国Amresco公司),硝酸纤维素膜,PVDF膜(北京中杉金桥生物技术有限公司),Bcl-2、Bax、Caspase-9、Caspase-8、Caspase-3、Survivin、Livin、Cyt-c检测试剂盒(美国Santa Cruz公司),β-actin抗体(美国Sigma公司),辣根过氧化物标记IgG抗体(美国Santa Cruz公司)。
1.2 方法 1.2.1 光学显微镜涂片HE染色6孔板内置入无菌盖玻片,实验细胞接种2.5 ml细胞悬液(浓度1×105个每毫升)于盖玻片后加入桔梗皂苷D,对照组加入0.9%NaCl溶液。药物作用后24 h终止培养。HE染色,光学显微镜下进行观察并拍照。
1.2.2 透射电子显微镜观察培养瓶中细胞接种1×105个每毫升的5637细胞5 ml,4 h后加入桔梗皂苷D,对照组中加入0.9%NaCl溶液,继续置于培养箱内,共同培养24 h后将细胞吹打离心,3%戊二醛/PBS固定2 h;PBS漂洗,15 min/次×3次,1%OsO4后固定1 h,梯度脱水,树脂包埋,切片,染色,透射电子显微镜观察并拍照。
1.2.3 流式细胞仪检测5637细胞凋亡将对数生长期的5637细胞配制成1×106个每毫升的细胞悬液,培养于100 ml培养瓶,加入桔梗皂苷D,终浓度为20 μg/ml,并设立对照组(加入0.9%NaCl溶液)。共培养24、48 h后收集细胞,PBS缓冲液洗涤细胞两次,适量加入PBS配制成细胞悬液。用Cycle TESTTM PLUS DNA Kit进行细胞染色,流式细胞仪测量激发波长为488 nm的红色荧光,记录5637细胞的凋亡率。测量前用鸡红细胞作为标准样品调整CV值在5%以内,每份标本检测2×104个细胞,两组实验均重复3次。
1.2.4 Western blot法检测Survivin、Livin、Caspase-9、Caspase-8、Caspase-3、Cyt-c蛋白的表达细胞裂解方法参照博迈德RIPA裂解液产品说明,SDS聚丙烯酰胺凝胶配制方法:按照Acr:Bis=29:1比例配置30%的丙烯酰胺凝胶储备液,免疫印迹分析方法:(1)40 μg总蛋白样品进行SDS-PAGE电泳分离;(2)裁取适当大小的PVDF膜于甲醇液中浸泡1 min,然后浸入转膜缓冲液中平衡;(3)丽春红染色后,观察转膜效果。PBS溶液洗膜两次; (4)使用PBST配制5%的脱脂奶粉,室温摇床摇晃封闭1 h;(5)使用PBS将一抗稀释到所需浓度,滴加至PVDF膜上,室温孵育2 h;(6)PBST洗膜,15 min×3次;(7)加入适合比例稀释后的抗小鼠IgG或抗兔IgG,室温孵育1 h;(8)PBST洗膜,15 min×3次;(9)ECL显色系统于暗室曝光显影,定影,冲洗胶片,晾干,扫描并拍照。
1.2.5 PCR方法检测桔梗皂苷D对5637细胞p53、Bcl-2、Bax mRNA的表达按照NCBI数据库提供的核酸序列设计引物,扩增序列的突变体。Bcl-2上游引物:5′-CTGTACGGCCCCAGCATGCG-3′,下游引物:5′-GCTTTGTTTCATGGTACATC-3′。Bax上游引物:5′-GGGAATTCTGGAGCTGCAGAGGATGATT-3′,下游引物:5′-GCGGATCCAAGTTGCCATCAGCAAACAT-3′。p53上游引物:5′-TGTAG CTGAGACTC CTG CA-3′,下游引物:5′-AACCTCAGGTGGCTCATAG-3′。上、下游引物包含的酶切位点分别是FseⅠ和XbaⅠ点,PCR扩增产物的长度为326 bp,见表 1。反应条件:94℃ 10 min,94℃ 30 s,54℃ 40 s,72℃ 40 s,35个循环,72℃延伸10 min。PCR扩增结束后1%琼脂糖凝胶电泳分析。
参照试剂盒说明书进行染色。3%H2O2-甲醇,室温孵育20 min;枸橼酸缓冲液(pH:6.0)微波修复5 min;PBS冲洗,5 min×3次;10%山羊血清室温孵育20 min;倾去血清,分别加入50 μl单抗工作液,4℃过夜;PBS冲洗,5 min×3次;加入二抗工作液,37℃孵育60 min;PBS冲洗,5 min×3次;加入辣根酶标记链酶卵白素工作液,37℃孵育60 min;PBS冲洗,5 min×3次;DAB工作液,100 μl覆盖,显微镜下观察,自来水冲洗,终止显色,梯度脱水、染色、透明、中性树胶封片。Caspase-9以细胞核或胞质内出现棕黄色颗粒为阳性细胞;Caspase-8及Bcl-2以细胞质内出现棕黄色或棕褐色颗粒为阳性细胞;Caspase-3以细胞质内出现棕黄色或棕褐色颗粒为阳性细胞,极少部分阳性染色可位于细胞核内;Bax以细胞质内出现棕黄色颗粒为阳性细胞,选取3张涂片,每张涂片随机选取5个视野(×400),每个视野分别计数阳性细胞数和总细胞数,阳性表达率=阳性细胞数/总细胞数×100%,使用PBS代替一抗作阴性对照。
1.3 统计学方法统计学处理使用SPSS13.0软件分析,计量数据以(x±s)表示,采用t检验,P < 0.05为差异有统计学意义。
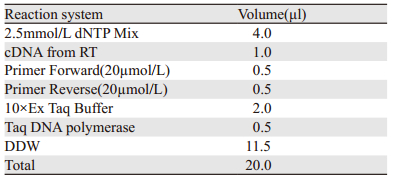
2 结果 2.1 桔梗皂苷D对5637细胞形态的影响HE染色结果显示,作用24 h时,对照组细胞生长状态良好,细胞数量多,排列紧密,细胞体积大,细胞核圆形,可见2~3个核仁,出现病理性核分裂相。20 μg/ml桔梗皂苷D组细胞数目明显减少,体积缩小,胞质染色加深,胞核体积变小,染色质浓缩,核仁不清晰,部分细胞出现胞质疏松化,说明细胞水肿和凋亡同时出现,见图 1。
|
| A: control group; B: platycodin D group (20μg/ml); control group: 0.9% NaCl 图 1 桔梗皂苷D对5637细胞作用24h后HE染色结果(×400) Figure 1 HE staining of 5637 cells treated with platycodin D for 24h (×400) |
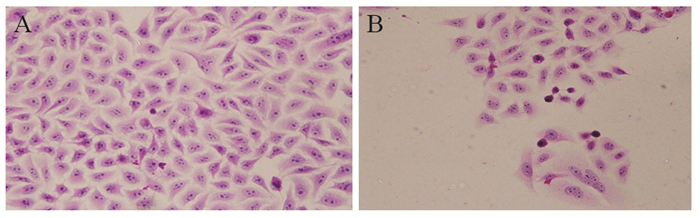
经透射电子显微镜观察发现,未经桔梗皂苷D处理的5637细胞核变大而且形状不规则,核仁大而致密,胞质内细胞器丰富;桔梗皂苷D处理组可以见变性死亡细胞增多,凋亡小体形成,有肿胀的细胞和发生坏死的细胞碎片。凋亡细胞特征性改变为细胞体积变小,染色质缩聚,呈块状或新月形,核出现裂解或消失的现象。细胞膜保存比较完整,细胞质内内质网扩张,线粒体可见肿胀,部分线粒体萎缩或者破坏消失,见图 2。
|
| A: control group; B: platycodin D group (20μg/ml) 图 2 桔梗皂苷D处理5637细胞24h后透射电子显微镜观察结果(×25000) Figure 2 5637 cells treated with platycodin D for 24h observed by transmission electron microscope (×25000) |
流式细胞术结果表明,20 μg/ml桔梗皂苷D作用于5637细胞24、48 h后,与对照组比较,细胞凋亡指数明显升高,差异均有统计学意义(P < 0.01),见表 2。
Western blot法检测结果显示,桔梗皂苷D作用于5637细胞24 h和48 h后,Survivin和Livin蛋白表达量明显下降,与对照组相比较,差异均有统计学意义(P < 0.05),见图 3。

|
| *: P < 0.05, compared with control group 图 3 桔梗皂苷D对5637细胞Survivin和Livin蛋白表达的影响 Figure 3 Influences of platycodin D on expression of survivin and livin protein in 5637 cells |
Western blot法检测结果发现,经桔梗皂苷D作用24 h和48 h后,5637细胞Caspase-9、Caspase-8、Caspase-3表达量增加,与对照组比较差异有统计学意义(P < 0.01),但是,用桔梗皂苷D处理24 h和48 h时差异无统计学意义,见图 4。

|
| *: P < 0.05, compared with control group 图 4 桔梗皂苷D对5637细胞Caspase-9、Caspase-8和Caspase-3蛋白表达的影响 Figure 4 Influences of platycodin D on expressions of Caspase-9, Caspase-8 and Caspase-3 protein in 5637 cells |
Western blot检测结果显示,桔梗皂苷D作用于5637细胞24 h和48 h后,Cyt-c蛋白表达明显增加,24 h组和48 h组与对照组比较差异有统计学意义(P < 0.05),但24 h组和48 h组间比较,差异无统计学意义,见图 5。
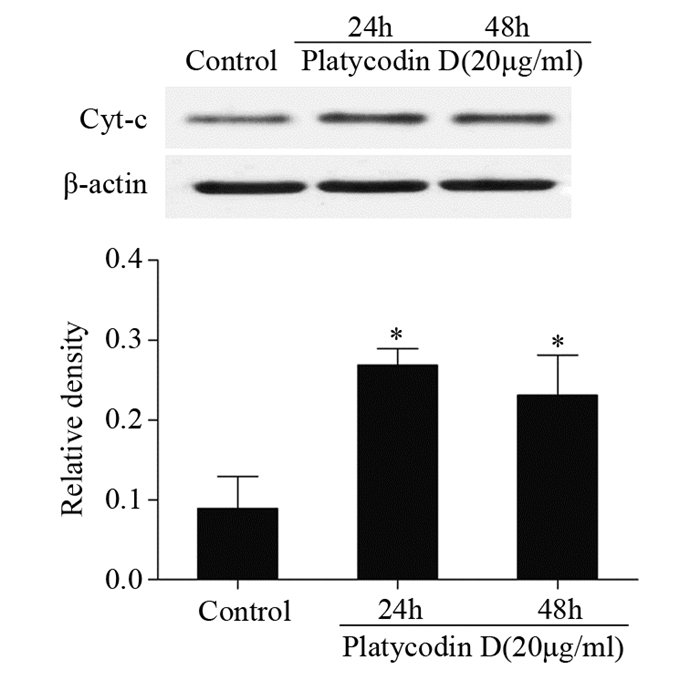
|
| *: P < 0.05, compared with β-actin control group 图 5 桔梗皂苷D对5637细胞Cyt-c蛋白表达的影响 Figure 5 Influences of platycodin D on Cyt-c protein expression in 5637 cells |
RT-PCR结果显示,桔梗皂苷D作用于5637细胞24 h和48 h后,随着药物作用时间的延长,5637细胞内p53、Bax mRNA的表达水平明显增高,与对照组相比,差异均有统计学意义(P < 0.01),Bcl-2 mRNA水平明显降低,与对照组相比,差异均有统计学意义,见图 6。
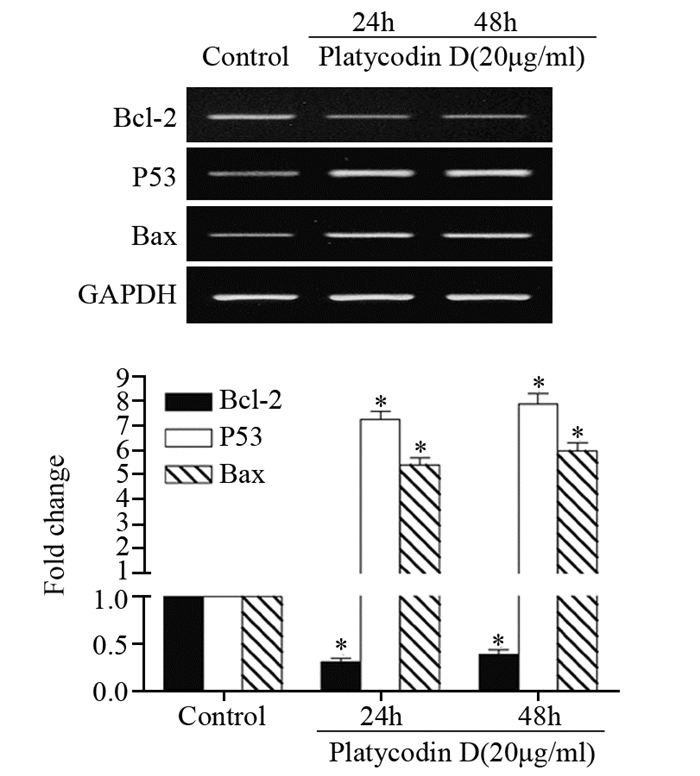
|
| *: P < 0.05, compared with control group 图 6 桔梗皂苷D对5637细胞内p53、Bcl-2、Bax mRNA表达的影响 Figure 6 Influences of platycodin D on expressions of p53, Bcl-2 and Bax mRNA in 5637 cells |
实验结果表明,桔梗皂苷D组5637细胞24 h后凋亡相关蛋白Bax、Caspase-9、Caspase-8和Caspase-3表达均明显增加,但Bcl-2表达降低。加药组的各项指标与对照组比较,差异均有统计学意义(P < 0.01),见表 3。

|
目前关于桔梗皂苷D对于泌尿系统肿瘤作用的研究很少,本实验结果发现,桔梗皂苷D作用于人移行细胞癌5637细胞株后,细胞体积缩小,部分细胞形态学改变符合细胞凋亡的特点,部分细胞失去了分裂增殖能力,进而坏死消失。本实验通过RT-PCR方法检测结果表明,桔梗皂苷D可明显增加5637细胞内p53的表达量,Bcl-2表达下调,而p53可调控众多凋亡基因的表达[8-9],对原癌基因起到抑制作用。因此认为,桔梗皂苷D可能通过上调p53基因进一步上调Bax,并且抑制Bcl-2的表达来诱导5637细胞凋亡。通过免疫组织化学、Western blot检测发现,桔梗皂苷D作用于5637细胞后,细胞的Cyt-C、Bax、Caspase-9、Caspase-8和Caspase-3表达明显增加,而Bcl-2表达下降,进一步引起级联反应,使Caspase-3表达增加,诱导细胞凋亡,而Caspase-9和Caspase-8分别是线粒体和死亡受体途径中的重要启动因子[10-11],所以推测,桔梗皂苷D可能是通过线粒体途径和死亡受体途径导致细胞凋亡,进而抑制肿瘤细胞的生长。
细胞凋亡受多种基因的调控,诱导细胞凋亡已经成为当前肿瘤药物发挥治疗作用的重要方式之一。众所周知,线粒体是细胞内产生ATP的场所,当线粒体被破坏后,会发生一系列的级联反应,最终引起细胞的凋亡。引起凋亡的使动因素有很多,但细胞色素C(Cyt-c)、氧自由基(ROS)、凋亡诱导因子(AIF)等蛋白被认为与激发线粒体途径密切相关。Cyt-c分子量为12~13 kDa,存在于线粒体膜,是呼吸链中的重要蛋白,当线粒体发生改变时,Cyt-c进入胞质,与凋亡蛋白酶激活因子(Apaf-1)相结合,两者结合后可使Pr℃aspase-9聚集,三者最终形成复合体,导致Caspase-9活化,进一步激活Caspase-3、Caspase-6、Caspase-7等凋亡执行蛋白,导致细胞凋亡[12]。ROS的产生是受Cyt-c影响的,当Cyt-c从线粒体膜释放的时候,呼吸链中的氧不能被及时传递,从而释放出来,形成ROS,大量的ROS可以破坏缺乏保护的线粒体引起凋亡,而且进一步破坏线粒体膜,造成线粒体通透性改变,使线粒体进一步释放Cyt-c,从而引起细胞凋亡[13-14]。当受到凋亡刺激时,线粒体膜的通透性改变,凋亡诱导因子(apoptosis inducible factor, AIF)被释放,进入细胞核降解DNA,同时激活异位酶,释放凋亡信号。Bcl-2蛋白家族与p53密切相关。研究表明p53依赖性细胞凋亡在细胞凋亡中起重要作用,其中Bcl-2蛋白家族调控的线粒体凋亡为主要途径。Bax是p53依赖性凋亡途径的重要靶蛋白之一,p53直接转录激活Bax基因启动子,增加Bax蛋白表达。Bcl-2属于抗凋亡蛋白,它通过定位到线粒体膜、调节线粒体膜通透性、抑制Caspase-3活化、Ca2+自内质网外流、磷脂酰丝氨酸外翻等来影响细胞凋亡。
Survivin在正常组织和细胞中没有表达,细胞转换及恶性肿瘤发生时,Survivin被广泛检测到[15]。Survivin被发现可以直接作用于Caspase-3和Caspase-7,从而直接阻断细胞凋亡的过程,进而起到抑制细胞凋亡的作用。Survivin在细胞有丝分裂的过程中,可以调节纺锤体的结合点,所以在恶性肿瘤发生时,可以使有纺锤体缺陷的细胞继续分裂增殖,或者是使不能重合的着丝点结合而继续进行有丝分裂[16]。Livin基因是最近几年发现的一个新型基因,具有凋亡抑制作用,其对凋亡的抑制作用主要分两个方面进行,第一是直接作用于Caspase-3和Caspase-7,从而使细胞凋亡直接终止,无论凋亡诱导因素是什么,包括抗癌药物;第二种方式是抑制TNF-α和ICE诱导的凋亡,此过程中,Livin激活MAP激酶HNK1来完成,而此过程独立于Caspase途径[17]。
为进一步探究桔梗皂苷D诱导人移行细胞癌5637细胞株凋亡机制,本实验检测了凋亡抑制基因Survivin、Livin的表达,结果表明桔梗皂苷D对Survivin表达具有明显抑制作用,同时,桔梗皂苷D可以抑制Livin表达,说明桔梗皂苷D抗肿瘤功能全面,对于Caspase家族以外的增殖因素也可以起到抑制作用。
综上所述,桔梗皂苷D可能是通过线粒体途径和死亡受体途径导致细胞凋亡,进而抑制肿瘤细胞的生长,本研究为桔梗皂苷D在临床上治疗泌尿系统肿瘤提供了实验依据。但桔梗皂苷D在体内是否也具有抗人移行细胞癌的作用,是否还通过其他机制以及通过何种信号通路发挥其抗肿瘤作用将是本研究组进一步探讨的内容。
| [1] | 国家药典委员会. 中华人民共和国药典:一部[M]. 北京: 化学工业出版社, 2005.] [ Chinese pharmacopoeia Commission. The pharmacopeia of People's Republic of China: 2005 Edition Volume Ⅰ[M]. Beijing: Chemical Industry Press, 2005. ] |
| [2] | Yang HY, Wang JD, Lo TC, et al. Occupational exposure to herbs containing aristolochic acids increases the risk of urothelial carcinoma in Chinese herbalists[J]. J Urol, 2013, 189(1): 48–52. DOI:10.1016/j.juro.2012.08.090 |
| [3] | Zhao HL, Kim YS. Determinaion of the kinetic properties of platycodin D for the inhibition of pancreatic lipase using a 1, 2-diglyceride-based colorimetric assay[J]. Arch Pharm Res, 2004, 27(9): 968–72. DOI:10.1007/BF02975852 |
| [4] | Park DI, Lee JH, Moon SK, et al. Induction of apoptosis and inhibition of telomerase activity by aqueous extract from platycodin grandiflorum in human lung carcinoma cells[J]. Pharmacol Res, 2005, 51(5): 437–43. DOI:10.1016/j.phrs.2004.11.003 |
| [5] | Luan X, Gao YG, Guan YY, et al. Platycodin D inhibits tumor growth by antiangiogenic activity via blocking VEGFR2-mediated signaling pathway[J]. Toxicol Appl Pharmacol, 2014, 281(1): 118–24. DOI:10.1016/j.taap.2014.09.009 |
| [6] | Li T, Chen X, Chen X, et al. Platycodin D potentiates proliferation inhibition and apoptosis induction upon AKT inhibition via feedback blockade in non-small cell lung cancer cells[J]. Sci Rep, 2016, 6: 37997. DOI:10.1038/srep37997 |
| [7] | Tao W, Su Q, Wang H, et al. Platycodin D attenuates acute lung injury by suppressing apoptosis and inflammation in vivo and in vitro[J]. Int Immunopharmacol, 2015, 27(1): 138–47. DOI:10.1016/j.intimp.2015.05.005 |
| [8] | Drosten M, Barbacid M. Ras and p53: An unsuspected liaison[J]. Mol Cell Oncol, 2015, 3(2): e996001. |
| [9] | Bisceglie F, Alinovi R, Pinelli S, et al. Autophagy and apoptosis: studies on the effects of bisthiosemicarbazone copper(ii) complexes on p53 and p53-null tumour cell lines[J]. Metallomics, 2016, 8(12): 1255–65. DOI:10.1039/C6MT00170J |
| [10] | He Y, Chen W, Hu Y, et al. E. adenophorum Induces Cell Cycle and Apoptosis of Renal Cells through Mitochondrial Pathway and Caspase Activation in Saanen Goat[J]. PLoS One, 2015, 10(9): e013850. |
| [11] | Sarkar A, Bhattacharjee S, Mandal DP. Induction of Apoptosis by Eugenol and Capsaicin in Human Gastric Cancer AGS Cells--Elucidating the Role of p53[J]. Asian Pac J Cancer Prev, 2015, 16(15): 6753–9. DOI:10.7314/APJCP.2015.16.15.6753 |
| [12] | Dewanjee S, Dua T K, Khanra R, et al. Water Spinach, Ipomoea aquatic (Convolvulaceae), Ameliorates Lead Toxicity by Inhibiting Oxidative Stress and Apoptosis[J]. PLoS One, 2015, 10(10): e0139831. DOI:10.1371/journal.pone.0139831 |
| [13] | Dua TK, Dewanjee S, Khanra R, et al. Cytoprotective and Antioxidant Effects of an Edible Herb, Enhydra fluctuans Lour. (Asteraceae), against Experimentally Induced Lead Acetate Intoxication[J]. PLoS One, 2016, 11(2): e0148757. DOI:10.1371/journal.pone.0148757 |
| [14] | Chien CC, Wu MS, Shen SC, et al. Activation of JNK contributes to evodiamine-induced apoptosis and G2/M arrest in human colorectal carcinoma cells: a structure-activity study of evodiamine[J]. PLoS One, 2014, 9(6): e99729. DOI:10.1371/journal.pone.0099729 |
| [15] | Zheng WY, Kang YY, Li LF, et al. Levels of effectiveness of gene therapies targeting survivin and its splice variants in human breast cancer cells[J]. Drug Discov Ther, 2011, 5(6): 293–8. DOI:10.5582/ddt.2011.v5.6.293 |
| [16] | Rodriguez-Berriguete G, Torrealba N, Ortega MA, et al. Prognostic value of inhibitors of apoptosis proteins (IAPs) and caspases in prostate cancer: caspase-3 forms and XIAP predict biochemical progression after radical prostatectomy[J]. BMC Cancer, 2015, 15: 809. DOI:10.1186/s12885-015-1839-z |
| [17] | Shiloach T, Berens C, Danke C, et al. tLivin displays flexibility by promoting alternative cell death mechanisms[J]. PLoS One, 2014, 9(6): e101075. DOI:10.1371/journal.pone.0101075 |
 2018, Vol. 45
2018, Vol. 45