文章信息
- 小檗碱通过调控IGF-1R信号通路抑制食管癌细胞增殖和诱导细胞凋亡的实验
- Berberine Inhibits Proliferation and Induces Apoptosis of Esophageal Cancer Cells via Inactivation of IGF-1R Signaling Pathway
- 肿瘤防治研究, 2018, 45(6): 362-366
- Cancer Research on Prevention and Treatment, 2018, 45(6): 362-366
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1500
- 收稿日期: 2017-12-26
- 修回日期: 2018-03-27
2. 453003 新乡,新乡医学院医学检验学院免疫学检验教研室
2. Department of Clinical Immunology, School of Laboratory Medicine, Xinxiang Medical University, Xinxiang 453003, China
食管癌是一种常见的消化道恶性肿瘤,发病率高且5年生存率低[1]。目前常用的治疗手段是手术和放化疗,但各有利弊,因而迫切需要寻找新的治疗药物。小檗碱又称黄连素,是从毛莨科黄连属植物黄连、黄柏的根茎中提取的异喹啉类生物碱。小檗碱最初是作为一种广谱的抗菌药应用,随着研究的深入,发现其具有广泛的药理作用,不仅对胃肠炎、腹泻、高血脂症等疾病具有一定的治疗效果,而且对多种肿瘤均具有抑制作用[2-13]。在体外,小檗碱对卵巢癌、结肠癌、乳腺癌等均具有显著的生长抑制作用[4-13]。在小鼠体内,小檗碱也显示出了良好的抗肿瘤活性,如在三阴性乳腺癌细胞MDA-MB-231裸鼠移植瘤模型中,小檗碱可显著抑制肿瘤的生长并增加Caspase9的表达,促进肿瘤的凋亡[6]。在胃癌BGC823裸鼠移植瘤中,小檗碱单独使用或与西妥昔单抗(Cetuximab)联合使用均可显著缩小肿瘤体积,抑制率分别为55%和66%[9]。
小檗碱可通过多种机制发挥抗肿瘤作用,如诱导细胞周期阻滞、促进细胞凋亡、抑制肿瘤细胞的侵袭和迁移、抑制肿瘤新生血管的形成、诱导肿瘤细胞发生自噬等[14]。尽管多项研究证实了小檗碱的抗肿瘤作用,但并未全面阐明其抗肿瘤作用机制。本研究检测了小檗碱在抑制食管癌细胞增殖和促进凋亡方面的作用,并研究其对胰岛素样生长因子受体1(insulin-like growth factor 1 receptor, IGF-1R)及其介导信号通路的影响,探索其发挥抗食管癌作用的机制。
1 材料与方法 1.1 材料 1.1.1 细胞系食管癌细胞系KYSE150、KYSE450、KYSE510及TE-7购买于中国医学科学院基础医学研究所细胞资源中心。细胞培养在含10%胎牛血清(Gibco公司,美国)、100 u/ml青霉素和100 μg/ml链霉素(碧云天生物技术研究所,中国江苏)的RPMI 1640培养基(Gibco公司,美国)中。当细胞密度达到80%~90%时,用0.25%胰酶-EDTA(Gibco公司,美国)进行消化并传代。
1.1.2 试剂小檗碱购于美国Selleck Chemicals公司,噻唑蓝(MTT)粉末购于美国Sigma公司。小檗碱用二甲基亚砜(dimethyl sulfoxide, DMSO)配置成50 mmol/L的母液,MTT用磷酸盐缓冲液配置成浓度为5 mg/ml的溶液,均于-20℃保存;DMSO购于北京索莱宝科技有限公司;细胞周期检测试剂盒和细胞凋亡检测试剂盒均购于江苏碧云天生物技术研究所;磷酸化-IGF-1R、磷酸化-AKT、磷酸化p38MAPK单克隆抗体以及IGF-1R、AKT、p38MAPK和β-actin单克隆抗体、HRP标记的山羊抗兔IgG抗体来自美国Cell signaling Technology公司。Western blot底物化学发光试剂盒购于美国Millipore公司。
1.2 实验方法 1.2.1 MTT实验检测小檗碱对食管癌细胞的增殖抑制作用取对数生长期的食管癌细胞(KYSE150、KYSE450、KYSE510及TE-7),用0.25%胰酶-EDTA消化并计数,按照2000个细胞每孔的密度接种于96孔板中,37℃、5%CO2培养24 h后,将不同浓度的小檗碱加入到96孔板中,每个浓度设置六个平行孔,同时设置无药物处理组及无细胞空白对照组。药物作用48 h后,每孔加入20 μl MTT溶液(5 mg/ml)放置37℃培养箱中继续孵育4 h。吸弃培养液上清液,每孔加入150 μl DMSO,用酶标仪检测570 nm处的吸光度值(A570)。细胞增殖抑制率=(A570加药组-A570空白组)/(A570对照组-A570空白组)×100%,GraphPad Prism 5软件分析绘图并计算IC50值。
1.2.2 PI染色法检测小檗碱对细胞周期的影响KYSE450细胞以3×105个/皿的密度接种至直径为60 mm的细胞培养皿中,37℃培养箱中培养24 h。弃去旧培养液,每皿加入含有10、30或60 μmol/L小檗碱的新鲜培养液4 ml,处理48 h后常规胰酶消化收集细胞。PBS洗涤细胞2次,之后将细胞沉淀重悬于1 ml冰冷的70%乙醇中,4℃固定细胞24 h。染色前1 000 r/min离心5 min,除去乙醇并用PBS洗涤细胞2次,细胞重悬于500 μl含有PI(50 mg/ml)和RNase A(100 mg/ml)的染色缓冲液中,37℃避光染色30 min,流式细胞仪测定细胞的荧光值并用Modfit软件分析处于G1、S和G2/M期的细胞比率。
1.2.3 Annexin V-FITC/PI双染法检测小檗碱对细胞凋亡的影响采用Annexin V-FITC和PI双染法结合流式细胞术检测小檗碱对食管癌细胞KYSE150、KYSE450的凋亡诱导作用。将KYSE150、KYSE450细胞按照1×105个/孔的密度接种至六孔板中,孵育24 h。弃去旧培养液,每孔加入含有10、30或60 μmol/L小檗碱的新鲜培养液3 ml,处理48 h,并设置不含药物的对照组。常规收集细胞包括培养液中漂浮的细胞,PBS洗涤三次。按照Annexin V-FITC细胞凋亡检测试剂盒说明书的操作要求,加入染色液,轻轻混匀,室温避光染色10 min,冰浴,流式细胞仪检测细胞的荧光强度。
1.2.4 Western blot实验检测细胞中IGF-1R表达水平及下游信号分子的表达采用Western blot技术检测4种食管癌细胞中IGF-1R的表达水平以及小檗碱对食管癌细胞KYSE450、KYSE510中IGF-1R及其下游信号通路中的关键分子(AKT和p38MAPK)的影响。细胞以1×106个的密度接种至100 mm的培养皿中,37℃培养24 h。每皿更换新鲜培养液并分别加入终浓度为10、30或60 μmol/L的小檗碱,处理细胞48 h,同时设置无药物处理组。将细胞接种至100 mm的培养皿后,37℃培养至80%~90%融合。用预冷的PBS洗涤3次,用细胞刮刀将细胞刮下,置于1.5 ml EP管中,4℃,1 000 r/min离心5 min。弃上清液,细胞沉淀用含有1 mmol/L PMSF的Western blot和免疫沉淀裂解液(碧云天生物技术研究所)重悬,并于冰上裂解30 min。4℃、10 000 g离心15 min,将上清液转移至新的EP管中,即为提取的细胞总蛋白。采用BCA蛋白定量试剂盒对细胞总蛋白进行定量。取30 μg总蛋白进行SDS-PAGE电泳,之后将蛋白电转至PVDF膜上,经过封闭(1% BSA室温封闭2 h)、与一抗孵育(1:1 000稀释,4℃孵育过夜)、洗涤(TBST洗涤3次,每次10 min)、与二抗孵育(1:4 000稀释,室温孵育1 h)、洗涤(TBST洗涤3次,每次10 min)后,在膜上覆盖适量化学发光显色液并置于Amersham Imager 600凝胶成像系统中成像并拍照。
1.3 统计学方法所有实验至少重复3次,数据采用平均数±标准差表示。数据的分析采用单因素方差分析或双尾t检验,P < 0.05为差异有统计学意义。
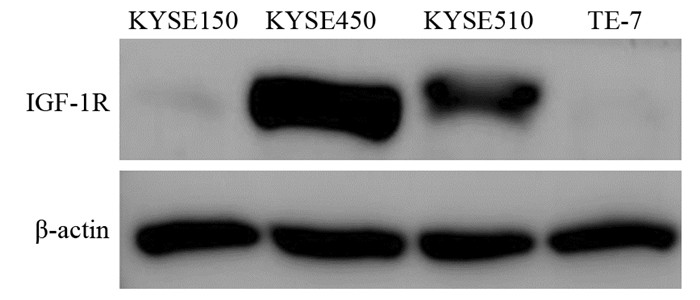
2 结果 2.1 食管癌细胞中IGF-1R表达水平检测Western blot结果显示,4种食管癌细胞中IGF-1R的表达存在明显差异。其中KYSE450细胞中IGF-1R的表达水平最高,而TE-7细胞的IGF-1R表达量最低,见图 1。
|
| 图 1 Western blot技术检测四种食管癌细胞中IGF-1R的表达水平 Figure 1 Expression levels of insulin-like growth factor 1 receptor in the four esophageal cancer cell lines measured by Western blot |
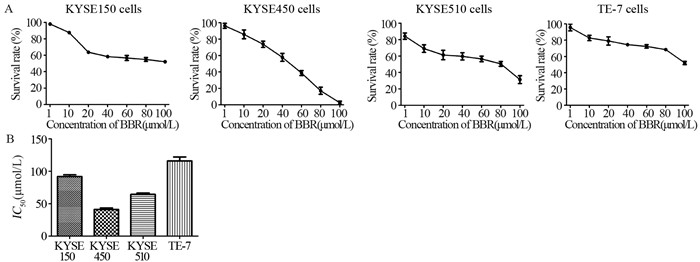
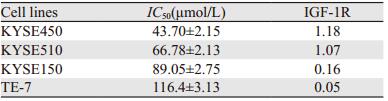
MTT实验结果显示,小檗碱对四种细胞系的增殖抑制作用均随着药物浓度的增加而增强,呈剂量依赖性,见图 2A。小檗碱对KYSE150、KYSE450、KYSE510和TE-7细胞的IC50值分别为89.05、43.7、66.78和116.4 μmol/L,见图 2B。为了检测小檗碱对食管癌细胞的增殖抑制作用是否与其IGF-1R的表达水平存在相关性,将图 1的结果用Image J软件进行灰度扫描,并采用Prism5软件进行相关性分析,结果显示,小檗碱对IGF-1R表达水平最高的KYSE450细胞的抑制作用最强,而对IGF-1R表达水平最低的TE-7细胞的抑制作用最弱,IC50值与IGF-1R表达水平之间存在着相关性(P < 0.05),见表 1。
|
| A: MTT assays were used to measure the effects of berberine on viability of four esophageal cancer cell lines; B: the IC50 values of berberine against four esophageal cancer cell lines; BBR: berberine 图 2 小檗碱对食管癌细胞生长增殖的影响 Figure 2 Effects of berberine on proliferation of esophageal cancer cells |
|
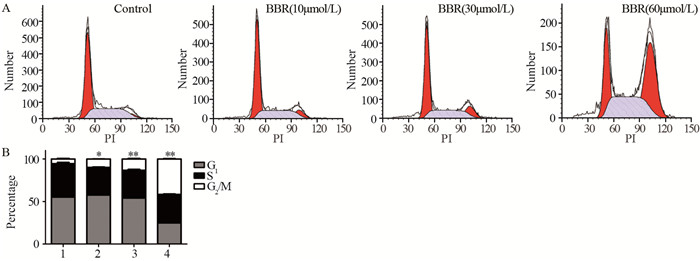
KYSE450细胞经小檗碱处理48 h后,细胞的周期分布与对照组细胞相比发生了显著变化。对照组细胞G1、S、G2/M期的比率分别为(55.12±1.0)%、(39.43±1.93)%和(5.46±0.93)%,而经10 μmol/L小檗碱处理后G1、S、G2/M期的比率分别为(57.64±1.07)%、(32.43±0.81)%和(9.93±0.27)%,G2/M期的细胞比率与对照组相比差异有统计学意义(P < 0.05)。30、60 μmol/L的小檗碱处理后G2/M期的细胞比率进一步上升,分别为(13.35±0.83)%和(41.64±0.62)%,与对照组相比,差异有统计学意义(P < 0.01),见图 3A、3B,表明小檗碱处理可使食管癌细胞阻滞于G2/M期。
|
|
1: Control; 2: BBR(10μmol/L); 3: BBR(30μmol/L); 4: BBR(60μmol/L) A: KYSE450 cells were treated with berberine at indicated concentrations for 48 h. Cells were then stained by PI and the fluorescence was detected by flow cytometry; B: the percentage of cells distributed in G1, S and G2/M phase in control group and berberine treatment groups; *: P < 0.05, **: P < 0.01, compared with control group 图 3 小檗碱对食管癌细胞周期的影响 Figure 3 Effects of berberine on cell cycle distribution of esophageal cancer |
选择了IGF-1R高表达的KYSE450细胞和IGF-1R低表达的KYSE150细胞,用10、30和60 μmol/L的小檗碱处理48 h后,采用Annexin V-FITC及PI进行双染,流式细胞仪测定荧光强度。随着小檗碱浓度的增加,细胞的凋亡率也随之升高。在KYSE150和KYSE450细胞中,小檗碱各浓度处理组的细胞凋亡比率均与对照组存在显著差异。这表明小檗碱可浓度依赖性地诱导食管癌细胞凋亡。值得关注的是,在相同浓度的小檗碱处理下,KYSE450细胞的凋亡比率高于KYSE150细胞,差异具有统计学意义,见图 4。
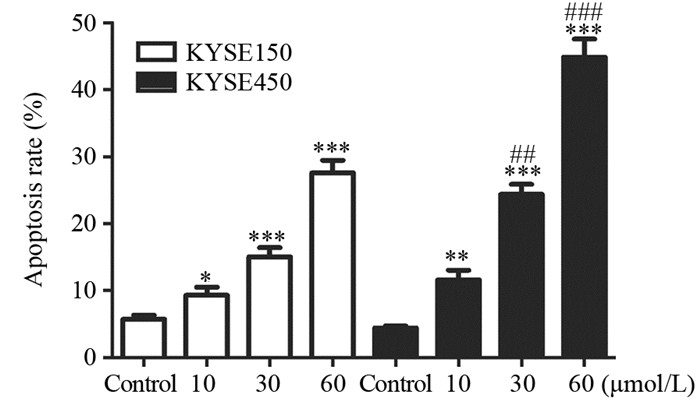
|
| KYSE150 and KYSE450 cells were exposed to berberine at indicated concentrations for 48 h. The cells were then stained with Annexin V-FITC and PI. The apoptotic cells were detected by flow cytometry. *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with corresponding control group; ##: P < 0.01, ###: P < 0.001, KYSE150 cells vs. KYSE450 cells at the same concentration 图 4 小檗碱对食管癌细胞凋亡的诱导作用 Figure 4 Effects of berberine on apoptosis of esophageal cancer cells |
不同浓度的小檗碱处理KYSE450和KYSE510细胞48 h后,采用Western blot技术检测小檗碱对IGF-1R的活化及其介导的下游信号通路的影响。结果显示:小檗碱可显著抑制IGF-1R的磷酸化,而且随着小檗碱浓度的增加,IGF-1R磷酸化水平也逐渐降低。IGF-1R下游信号通路中的两个关键分子,AKT和p38MAPK(ERK)的活化也受到小檗碱的抑制,当小檗碱浓度达到60 μmol/L时,几乎可以完全阻断IGF-1R的活化,进而抑制下游信号通路中AKT、ERK的磷酸化。但非磷酸化的IGF-1R、AKT和ERK的表达并未受到小檗碱处理的影响,见图 5。
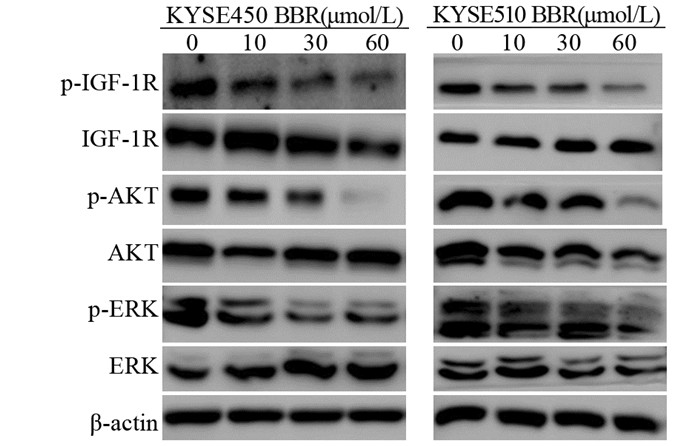
|
| KYSE450 and KYSE510 cells were treated with berberine at indicated concentrations for 48 h. The expressions of phosphorylated-IGF-1R, -AKT, -ERK and the total-IGF-1R, -AKT, -ERK were evaluated by Western blot 图 5 小檗碱对食管癌细胞中IGF-1R信号通路的影响 Figure 5 Effects of berberine on IGF-1R signaling pathways in esophageal cancer cells |
小檗碱除了具有抗菌、抗氧化和抗炎的作用之外,还可通过多种机制发挥抗肿瘤作用,包括干扰细胞DNA复制、阻断细胞周期和诱导细胞凋亡和自噬、抑制肿瘤的侵袭和迁移等。除此之外,有研究发现,小檗碱还可抑制多个细胞生长因子受体的活化,如表皮生长因子受体(EGFR)、人表皮生长因子受体2(HER2)和血管内皮生长因子受体(VEGFR)等[15]。本研究发现小檗碱对食管癌细胞的生长具有抑制作用,且抑制作用的强弱与细胞表面另一生长因子受体IGF-1R的表达水平呈正相关。小檗碱还可浓度依赖性地诱导食管癌细胞的凋亡,而且,在相同浓度小檗碱处理下,IGF-1R高表达的KYSE450细胞的凋亡率显著高于IGF-1R低表达的KYSE150细胞。这些结果均提示,小檗碱发挥抗肿瘤作用的机制可能与IGF-1R有关。而Western blot实验结果也证实了小檗碱可抑制IGF-1R的磷酸化,而且随着小檗碱浓度的增加,IGF-1R磷酸化水平也逐渐降低。
IGF-1R是胰岛素样生长因子(IGF)信号系统的成员之一,IGF信号系统由胰岛素样生长因子(IGF-1和IGF-2)、胰岛素样生长因子受体(IGF-1R和IGF-2R)以及胰岛素样生长因子结合蛋白(IGFBPs 1-6)组成。IGFBPs通过与IGF-1和IGF-2的结合与解离可调控其生理活性。IGF-1R可结合IGF-1和IGF-2,是IGF信号系统中主要的功能性受体。IGF-1R由α和β亚基组成,具有内源的酪氨酸激酶活性。它与胰岛素受体存在着70%的同源性,对细胞的存活、增殖和分化过程发挥着重要的调节作用。研究显示,在乳腺癌、结肠癌、非小细胞肺癌、前列腺癌等多种肿瘤细胞系中均存在IGF-1R的过表达现象[16]。日本科学家Adachi Y课题组对100例手术切除的食管癌标本进行了免疫组织化学检测,结果发现IGF-1R阳性的比例高达60%,且IGF-1R的阳性与肿瘤细胞的侵袭深度、淋巴结转移以及远端转移、术后一年复发率等呈正相关[17]。本课题组的前期研究也发现,在75例食管癌手术切除标本中,IGF-1R的阳性率高达82.7%,而在对应的正常食管上皮细胞中,IGF-1R的阳性率仅为44.9%[18]。因此,抑制IGF-1R的活性对于食管癌的治疗具有十分重要的意义。本研究发现小檗碱可以通过抑制IGF-1R及其介导的信号通路的活化而发挥抗食管癌效应,这不仅揭示了小檗碱新的作用机制,完善了小檗碱的分子调控网络,而且为小檗碱应用于食管癌的临床治疗提供了理论依据。有研究表明小檗碱与其他抗肿瘤药物或者放射联用,具有协同抗肿瘤的作用。因此,将小檗碱与食管癌常用化疗药物或放疗联合使用,检测不同联合方案的抗肿瘤疗效将是我们下一步工作的重点。
| [1] | Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol, 2013, 19(34): 5598–606. DOI:10.3748/wjg.v19.i34.5598 |
| [2] | Ortiz LM, Lombardi P, Tillhon M, et al. Berberine, an epiphany against cancer[J]. Molecules, 2014, 19(8): 12349–67. DOI:10.3390/molecules190812349 |
| [3] | 方慧华, 李洪娇, 何小蕾, 等. 小檗碱及其衍生物抗肿瘤作用研究进展[J]. 中国药学杂志, 2017, 52(6): 429–33. [ Fang HH, Li HJ, He XL, et al. Recent research advances in anti-tumor effects of berberine and its deribatives[J]. Zhongguo Yao Xue Za Zhi, 2017, 52(6): 429–33. ] |
| [4] | Hou D, Xu G, Zhang C, et al. Berberine induces oxidative DNA damage and impairs homologous recombination repair in ovarian cancer cells to confer increased sensitivity to PARP inhibition[J]. Cell Death Dis, 2017, 8(10): e3070. DOI:10.1038/cddis.2017.471 |
| [5] | Ruan H, Zhan YY, Hou J, et al. Berberine binds RXRα to suppress β-catenin signaling in colon cancer cells[J]. Oncogene, 2017, 36(50): 6906–18. DOI:10.1038/onc.2017.296 |
| [6] | Zhao Y, Jing Z, Lyv J, et al. Berberine activates caspase-9/cytochrome c-mediated apoptosis to suppress triple-negative breast cancer cells in vitro and in vivo[J]. Biomed Pharmacother, 2017, 95: 18–24. DOI:10.1016/j.biopha.2017.08.045 |
| [7] | Li M, Zhang M, Zhang ZL, et al. Induction of Apoptosis by Berberine in Hepatocellular Carcinoma HepG2 Cells via Downregulation of NF-κB[J]. Oncol Res, 2017, 25(2): 233–9. DOI:10.3727/096504016X14742891049073 |
| [8] | Jiang SX, Qi B, Yao WJ, et al. Berberine displays antitumor activity in esophageal cancer cells in vitro[J]. World J Gastroenterol, 2017, 23(14): 2511–8. DOI:10.3748/wjg.v23.i14.2511 |
| [9] | Wang J, Yang S, Cai X, et al. Berberine inhibits EGFR signaling and enhances the antitumor effects of EGFR inhibitors in gastric cancer[J]. Oncotarget, 2016, 7(46): 76076–86. |
| [10] | Wang J, Kang M, Wen Q, et al. Berberine sensitizes nasopharyngeal carcinoma cells to radiation through inhibition of Sp1 and EMT[J]. Oncol Rep, 2017, 37(4): 2425–32. DOI:10.3892/or.2017.5499 |
| [11] | Kalaiarasi A, Anusha C, Sankar R, et al. Plant Isoquinoline Alkaloid Berberine Exhibits Chromatin Remodeling by Modulation of Histone Deacetylase To Induce Growth Arrest and Apoptosis in the A549 Cell Line[J]. J Agric Food Chem, 2016, 64(50): 9542–50. DOI:10.1021/acs.jafc.6b04453 |
| [12] | Jin H, Jin X, Cao B, et al. Berberine affects osteosarcoma via downregulating the caspase-1/IL-1β signaling axis[J]. Oncol Rep, 2017, 37(2): 729–36. DOI:10.3892/or.2016.5327 |
| [13] | Ma W, Zhu M, Yang L, et al. Synergistic Effect of TPD7 and Berberine against Leukemia Jurkat Cell Growth through Regulating Ephrin-B2 Signaling[J]. Phytother Res, 2017, 31(9): 1392–9. DOI:10.1002/ptr.v31.9 |
| [14] | Sun Y, Xun K, Wang Y, et al. A systematic review of the anticancer properties of berberine, a natural product from Chinese herbs[J]. Anticancer Drugs, 2009, 20(9): 757–69. DOI:10.1097/CAD.0b013e328330d95b |
| [15] | Jabbarzadeh Kaboli P, Rahmat A, Ismail P, et al. Targets and mechanisms of berberine, a natural drug with potential to treat cancer with special focus on breast cancer[J]. Eur J Pharmacol, 2014, 740: 584–95. DOI:10.1016/j.ejphar.2014.06.025 |
| [16] | Singh P, Alex JM, Bast F. Insulin receptor (IR) and insulin-like growth factor receptor 1(IGF-1R) signaling systems: novel treatment strategies for cancer[J]. Med Oncol, 2014, 31(1): 805. DOI:10.1007/s12032-013-0805-3 |
| [17] | Imsumran A, Adachi Y, Yamamoto H, et al. Insulin-like growth factor-1 receptor as a marker for prognosis and a therapeutic target in human esophageal squamous cell carcinoma[J]. Carcinogenesis, 2007, 28(5): 947–56. |
| [18] | Cao HY, Guo XF, Zhu XF, et al. A ligand-based and enediyne-energized bispecific fusion protein targeting epidermal growth factor receptor and insulin-like growth factor-1 receptor shows potent antitumor efficacy against esophageal cancer[J]. Oncol Rep, 2017, 37(6): 3329–40. DOI:10.3892/or.2017.5606 |
 2018, Vol. 45
2018, Vol. 45


