文章信息
- pcDNA3.1-CD74-ROS1重组质粒构建与表达对肺癌细胞增殖及迁移的影响
- Construction of pcDNA3.1-CD74-ROS1 Recombinant Plasmid and Effect of CD74-ROS1 Expression on Proliferation and Migration of Lung Cancer Cells
- 肿瘤防治研究, 2018, 45(4): 199-204
- Cancer Research on Prevention and Treatment, 2018, 45(4): 199-204
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1486
- 收稿日期: 2017-11-22
- 修回日期: 2018-01-26
2. 121000 锦州,锦州医科大学附属第一医院眼科
2. Department of Ophthalmology, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
环境的日益恶化促使我国每年肺癌新发病例和死亡病例均居世界第一位。肺癌中80%~85%为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1-3]。由于非小细胞癌初期症状较轻,其中约75%的患者确诊时已处于中晚期,错过了手术的最佳时机,所以化疗是目前治疗中晚期非小细胞肺癌的主要方法,但化疗后的五年生存率也仅为15%[4-5],因此迫切需要一种新的有效的方式来治疗非小细胞肺癌。
随着分子水平研究的不断深入,以癌基因为靶点的分子靶向治疗兴起,非小细胞肺癌治疗进入靶向时代。在NSCLC中已发现超过十种致癌基因,目前已知的重要原癌基因有KRAS基因、表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、C-ros致癌基因1(ROS1)等。
ROS1属于受体酪氨酸激酶(RTKs)超家族成员,1987年在神经胶质细胞瘤中发现其基因重排[6]。NSCLC中ROS1突变率约为1%~2%,可以作为一种潜在的靶向治疗分子[7-8]。由于该基因的致癌机制仍不清楚,本文以人H2228 cDNA为模板扩增CD74和ROS1基因片段,利用融合PCR技术构建CD74-ROS1融合基因;将CD74-ROS1融合基因连接到pcDNA3.1真核表达载体中,构建重组质粒,并转染到人源细胞株中,为CD74-ROS1功能机制研究提供细胞模型,同时探讨了其对肺癌细胞迁移能力的影响。
1 材料与方法 1.1 材料与试剂pcDNA3.1(+)质粒购自美国Thermo Fisher Scientific公司,RNAiso Plus、PrimeSTAR高保真DNA聚合酶、T4 DNA连接酶、HincⅡ、KpnⅠ和XbaⅠ内切酶购自大连中国宝生物有限公司,DH5α感受态细胞和反转录试剂盒购自北京康为世纪生物公司,DNA胶回收试剂盒和去内毒素质粒小提试剂盒购自上海生工生物工程有限公司,兔抗人ROS1购自美国Cell Signaling Technology公司,鼠抗人β-actin、HRP标记的山羊抗兔和山羊抗鼠二抗购自北京中杉金桥公司,ECL化学发光试剂盒购自上海碧云天生物公司,其他实验用化学试剂均为国产分析纯。
1.2 方法 1.2.1 引物设计根据GenBank CD74-ROS1(No.EU236945)的功能序列和载体pcDNA3.1序列特点,选择KpnⅠ和XbaⅠ作为酶切位点,引物序列见表 1。
收集人非小细胞肺癌细胞株H2228样本,使用RNAiso Plus提取总RNA后依照康为世纪公司反转录试剂盒的操作说明进行反转录,获得人源cDNA。
1.2.3 PCR扩增目的片段PCR反应条件:98℃预变性30 s;98℃变性10 s,55℃退火5 s,72℃延伸10 s,30个循环;72℃充分延伸1 min。PCR产物进行琼脂糖凝胶电泳,紫外线下切取目的条带,胶回收纯化目的基因。
1.2.4 CD74-ROS1融合基因构建本实验共进行两轮PCR,利用融合PCR技术构建CD74-ROS1融合基因,具体步骤见表 2。扩增产物进行琼脂糖凝胶电泳,紫外线下观察并切取目的条带,胶回收。
利用KpnⅠ和XbaⅠ的双酶切体系分别对融合基因片段和pcDNA3.1载体进行酶切,酶切产物纯化后在T4 DNA连接酶的作用下将CD74-ROS1连入pcDNA3.1载体中形成重组质粒。
将重组质粒转化至感受态细胞DH5α中,在含氨苄霉素的固体LB(lysogeny broth)培养液中37℃过夜培养12~16 h,选取CD74-KpnⅠ-F1和ROS1-XbaⅠ-R2作为鉴定引物,利用菌落PCR技术筛选阳性克隆,并对阳性克隆进一步摇菌扩增,随后按照生工质粒小提试剂盒说明书提取质粒。
利用HincⅡ和XbaⅠ双酶切鉴定后将重组质粒送往北京博迈德公司测序。
1.2.6 A549细胞CD74-ROS1基因的稳定转染取对数期的A549细胞进行铺板,当细胞融合度达70%~80%时进行细胞转染,将pcDNA3.1-CD74-ROS1重组质粒和pcDNA3.1空载体分别与脂质体孵育,转染入A549细胞中,培养24 h后加入抗生素G418(600 ng/ml)进行筛选,2周后抗菌素浓度减半,进行维持。一月后挑取单克隆进行扩大培养及鉴定。
1.2.7 Real-time PCR检测CD74-ROS1 mRNA的表达收集各组单克隆细胞,提取总RNA,反转录成cDNA,利用实时荧光定量PCR技术检测CD74-ROS1 mRNA表达水平。
1.2.8 Western blot检测CD74-ROS1蛋白的表达提取各组单克隆细胞总蛋白,BCA法蛋白定量,稀释成3 μg/μl,上样量为30 μg。10%SDS-PAGE电泳、转印、封闭后,加入特异性识别ROS1的一抗,4℃杂交过夜,加入HRP标记的山羊抗兔IgG二抗,室温孵育2 h,加入ECL发光液暗室曝光检测蛋白表达水平。
1.2.9 MTT增殖检测将A549细胞株、转染空载体的A549细胞株和CD74-ROS1过表达的A549细胞株接种到96孔培养板中(细胞密度约为1×108个/升),分别在24、48、72 h加入20 μl MTT(5 g/L),继续培养4 h,弃去培养液并加入150 μl DMSO,振荡混匀后,于492 nm波长处测吸光度值。
1.2.10 结晶紫染色将转染前后的细胞接种到6孔板中(细胞密度约为5×107个/升),24 h后4%的多聚甲醛固定10 min,PBS洗涤3次,加入结晶紫染液(1%),染色10 min,PBS洗涤3次,倒置显微镜下观察拍照。
1.2.11 划痕实验分别将实验组(转染pcDNA3.1-CD74-ROS1组)和空载体对照组(转染pcDNA3.1组)消化后,4×105个/孔细胞种植到6孔板中,培养过夜,待细胞融合度达到80%时,用枪头尖划一条痕迹,PBS洗3次,加入无血清培养液继续培养,此时算作0 h,拍照并计时。24和48 h时观察细胞迁移情况并拍照。
1.3 统计学方法应用SPSS 16.0软件对实验数据进行统计分析。统计学数据用(x±s)表示,两样本均数比较采用t检验,P < 0.05为差异有统计学意义。
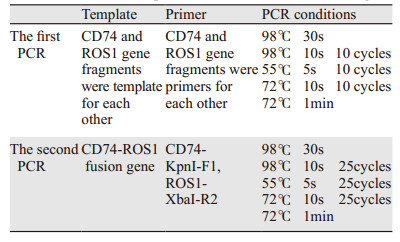
2 结果 2.1 PCR扩增CD74和ROS1片段以H2228 cDNA为模板进行PCR扩增,随后进行琼脂糖凝胶电泳,可见643 bp和1 488 bp的CD74和ROS1片段,与理论结果一致,见图 1。
|
| M: DL5000 DNA marker 图 1 CD74和ROS1目的片段的琼脂糖凝胶电泳结果 Figure 1 Agarose gel electrophoresis results of CD74 and ROS1 |
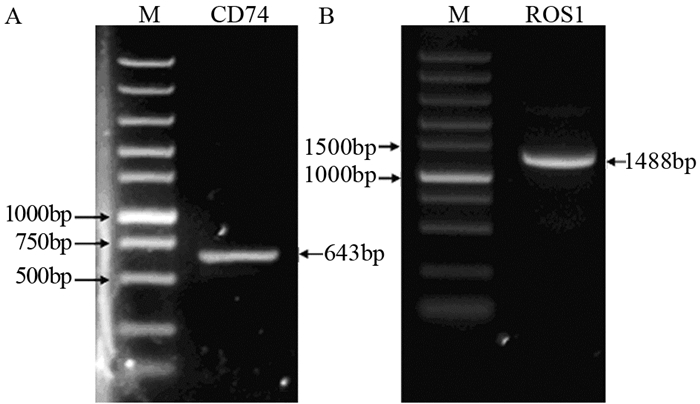
获得CD74和ROS1基因片段后,利用融合PCR技术构建CD74-ROS1融合基因。融合PCR电泳结果显示一条高亮条带,其分子量为2 112 bp,与理论结果一致,为目的片段,表明融合基因构建成功,见图 2。
|
| M: DL5000 DNA marker 图 2 CD74-ROS1融合基因琼脂糖凝胶电泳结果 Figure 2 Agarose gel electrophoresis results of CD74-ROS1 fusion gene |
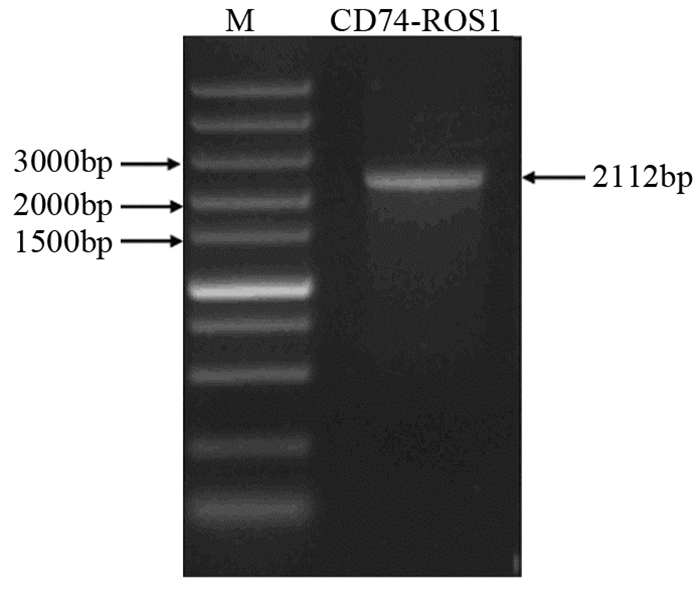
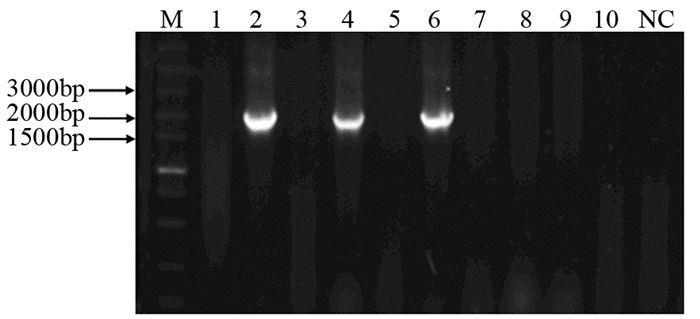
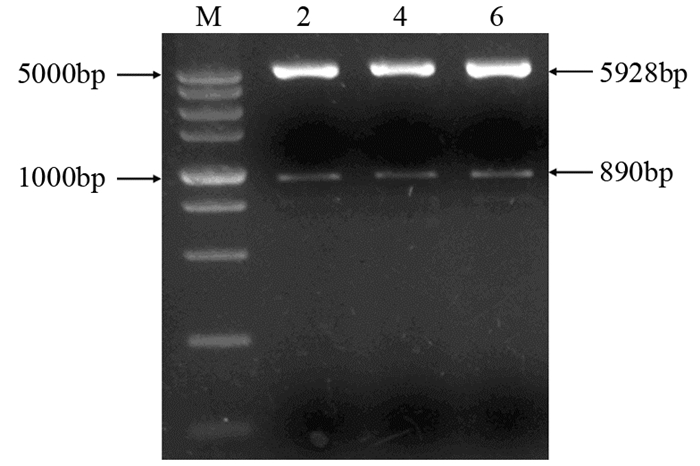
菌落PCR结果显示克隆2、4、6为阳性克隆,见图 3。选取阳性克隆进一步扩增后,使用内切酶HincⅡ和XbaⅠ对重组质粒进行双酶切鉴定,切得890 bp和5 928 bp的两个片段,与理论值相一致,见图 4。随后的测序结果通过NCBI中的Blast对比后,与Gene database公布的序列一致,插入方向正确。
|
| NC: Negative control; M: DL5000 DNA marker; 1-10: ten bacterial colonies were randomly selected and marked with numbers 图 3 菌落PCR琼脂糖凝胶电泳结果 Figure 3 Agarose gel electrophoresis results of colony PCR |
|
| M: DL5000 marker; 2, 4, 6: the three positive clones were identified by colony PCR 图 4 HincⅡ和XbaⅠ双酶切琼脂糖凝胶电泳结果 Figure 4 Agarose gel electrophoresis results of HincⅡ and XbaⅠ double digestion |
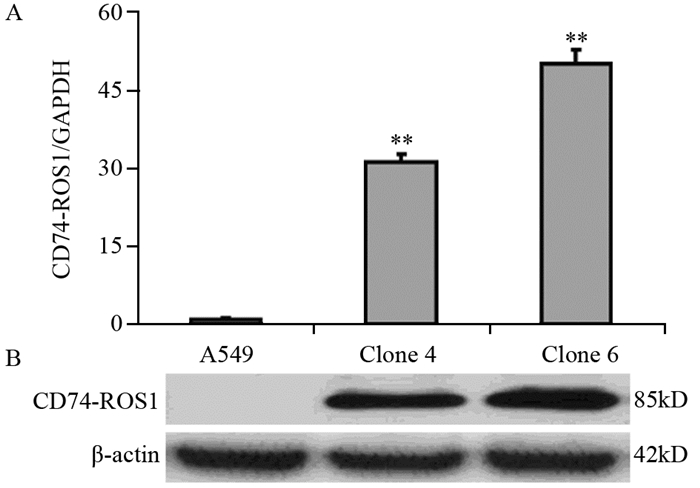
重组pcDNA3.1-CD74-ROS1质粒转染A549细胞,G418(600 ng/ml)筛选4周后挑取阳性克隆进行扩大培养,提取各组克隆的总RNA,Real-time PCR和Western blot检测CD74-ROS1 mRNA和蛋白表达水平,结果显示克隆4和6两组单克隆细胞的CD74-ROS1的表达均较对照组显著增高,表明pcDNA3.1-CD74-ROS1重组质粒及CD74-ROS1过表达稳转细胞系构建成功,见图 5。
|
| **: P < 0.01, compared with control group; n=3; A: Real-time PCR detection of CD74-ROS1 mRNA; B: Western blot detection of CD74-ROS1 protein level 图 5 Real-time PCR和Western blot检测CD74-ROS1的表达结果 Figure 5 Expression of CD74-ROS1 detected by real-time PCR and Western blot |
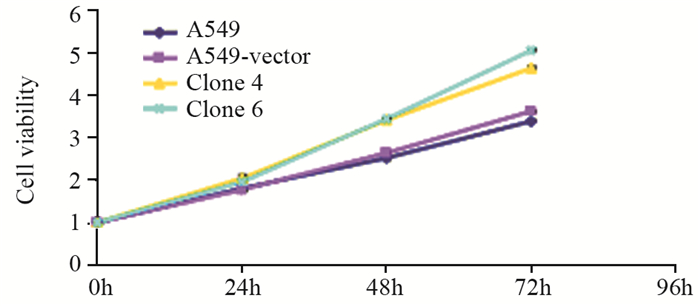
MTT结果显示转染空白质粒组(A549-vector)与未转染质粒的对照组相比,细胞增殖能力无明显改变,表明空白质粒对细胞的增殖活力无影响。转染CD74-ROS1融合基因组,细胞增殖能力显著提升,两组阳性克隆Clone 4和Clone 6增殖能力均高于转染空载体组,见图 6。
|
| 图 6 MTT检测CD74-ROS1对细胞增殖的影响 Figure 6 Effect of CD74-ROS1 on cell proliferation detected by MTT assay |
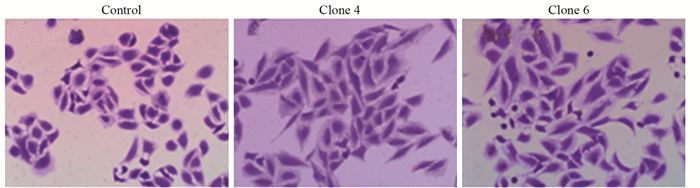
结晶紫染色观察CD74-ROS1质粒转染前后对肺癌细胞形态的影响,A549细胞中CD74-ROS1过表达能够促进细胞的上皮间质转化,细胞形态由规则的偏圆形转变为细长形,此种形态的细胞更具侵袭性,见图 7。
|
| 图 7 结晶紫染色检测CD74-ROS1对细胞形态的影响 Figure 7 Effects of CD74-ROS1 on cell morphology detected by crystal violet staining |
CD74-ROS1过表达导致细胞形态发生改变,划痕实验检测0、24、48 h划痕区生长细胞状况,并进行统计分析。CD74-ROS1过表达能够显著促进肺癌细胞的迁移,见图 8。
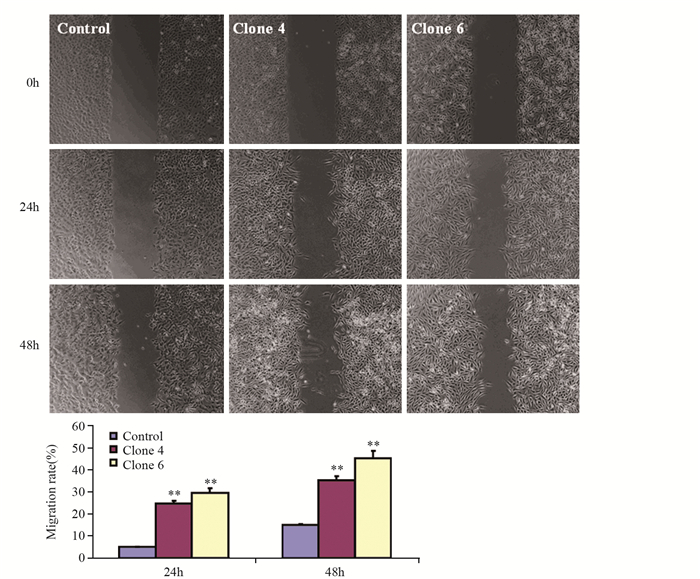
|
| **: P < 0.01, compared with control group; n=3 图 8 划痕检测CD74-ROS1对细胞迁移能力的影响 Figure 8 Effects of CD74-ROS1 on cell migration detected by wound healing assay |
在非小细胞肺癌患者中,癌驱动基因作为药物靶标被发现,酪氨酸激酶抑制剂(TKI)已成为一种成功的治疗方式[9-10]。最近一种受体酪氨酸激酶,c-ros原癌基因1(ROS1)被鉴定为NSCLC的新靶标,ROS1型肺癌仅占肺癌的0.9%~1.7%,但是相对于非小细胞肺癌庞大的患者群体来说,单独研究ROS1基因突变依旧是有意义且必要的[11]。
ROS1调节异常可能出现ROS1基因融合、过表达或者突变。异常的ROS1激酶活性可导致下游多个致癌基因通路激活,促进细胞癌变和增殖[12-14]。ROS1融合基因有多种形式,包括CD74、EZR、FIG 1、CCD6、SDC4和SLC34A2等。所有的重组均是由ROS1的3’端的激酶功能区和其他基因的5’端相融合组成的。融合基因空间构象的改变导致ROS1的组成型激活,持续发挥癌基因作用,促进细胞癌变及肿瘤的发生。其中最常见的重组形式是CD74-ROS1,约占总数的32%[15],因此针对CD74-ROS1这一重组类型进行研究,对其致癌机制的研究可更好地与临床治疗相结合,改善患者的生活质量。
关于CD74-ROS1融合基因的研究来源主要是CD74-ROS1阳性的非小细胞肺癌患者,通过提取细胞或基因进而研究其功能,目前尚没有稳定的细胞模型去深入研究其生物学功能及致癌机制,关于ROS1融合蛋白下游信号通路也尚未完全阐明。因此构建pcDNA3.1-CD74-ROS1重组质粒对进一步探讨CD74-ROS1的生物学功能具有非常重要的作用。
本研究利用融合PCR技术构建CD74-ROS1融合基因;分子克隆技术构建pcDNA3.1-CD74-ROS1重组质粒;脂质体转染技术构建CD74-ROS1过表达稳定转染细胞系。利用测序、Real-time PCR和Western blot技术证明重组质粒及稳转细胞系构建成功。随后的研究中,我们发现CD74-ROS1的表达能够促进细胞的增殖,此外结晶紫染色显示细胞上皮间质转化,表明CD74-ROS1在细胞的侵袭转移中可能发挥着重要的作用,划痕实验进一步验证了我们的猜想,CD74-ROS1能够增强细胞的迁移能力。有研究报道沉默FIG-ROS1能够显著降低细胞的迁移、侵袭能力[16],与划痕实验结果一致。
CD74-ROS1过表达稳转细胞系的成功构建为进一步深入探讨CD74-ROS1的生物学功能及其致癌的分子机制提供了细胞模型,有利于更深入地了解ROS1融合蛋白的致癌机制,促进ROS1酪氨酸激酶抑制剂的研发,完善肺癌的个体化治疗。靶向治疗不可避免地会导致耐药性的产生,其中基因拷贝数增加是导致患者耐药的一个重要原因[17],如能利用重组质粒技术转染临床患者体内抽取的癌细胞进行研究,将对靶向治疗药物疗效评判及耐药机制方面产生更重要的价值。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [2] | Chen W, Zhang R, Zhang S, et al. Report of cancer incidence and mortality in China, 2010[J]. Ann Transl Med, 2014, 2(7): 61. |
| [3] | DeSantis CE, Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2014[J]. CA Cancer J Clin, 2014, 64(4): 252–71. DOI:10.3322/caac.v64.4 |
| [4] | Thun MJ, DeLancey JO, Center MM, et al. The global burden of cancer: priorities for prevention[J]. Carcinogenesis, 2010, 31(1): 100–10. DOI:10.1093/carcin/bgp263 |
| [5] | Ettinger DS, Akerley W, Bepler G, et al. Non-small cell lung cancer[J]. J Natl Compr Canc Netw, 2010, 8(7): 740–801. DOI:10.6004/jnccn.2010.0056 |
| [6] | Birchmeier C, Sharma S, Wigler M. Expression and rearrangement of the ROS1 gene in human glioblastoma cells[J]. Proc Natl Acad Sci U S A, 1987, 84(24): 9270–4. DOI:10.1073/pnas.84.24.9270 |
| [7] | Bergethon K, Shaw AT, Ou SH, et al. ROS1 rearrangements define a unique molecular class of lung cancers[J]. J Clin Oncol, 2012, 30(8): 863–70. DOI:10.1200/JCO.2011.35.6345 |
| [8] | 张瑜, 彭枫. 克唑替尼治疗晚期非小细胞肺癌研究进展[J]. 肿瘤防治研究, 2017, 44(11): 774–8. [ Zhang Y, Peng F. Research advances of crizotinib in treatment of advanced non-small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(11): 774–8. DOI:10.3971/j.issn.1000-8578.2017.17.0319 ] |
| [9] | Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(2): 213–22. DOI:10.1016/S1470-2045(13)70604-1 |
| [10] | Muller IB, de Langen AJ, Giovannetti E, et al. Anaplastic lymphoma kinase inhibition in metastatic non-small-cell lung cancer: clinical impact of alectinib[J]. Onco Targets Ther, 2017, 10: 4535–41. DOI:10.2147/OTT |
| [11] | Rikova K, Guo A, Zeng Q, et al. Global survey of phosphotyrosine signaling identifies oncogenic kinases in lung cancer[J]. Cell, 2007, 131(6): 1190–203. DOI:10.1016/j.cell.2007.11.025 |
| [12] | Ogura H, Nagatake-Kobayashi Y, Adachi J, et al. TKI-addicted ROS1-rearranged cells are destined to survival or death by the intensity of ROS1 kinase activity[J]. Sci Rep, 2017, 7(1): 5519. DOI:10.1038/s41598-017-05736-9 |
| [13] | Song A, Kim TM, Kim DW, et al. Molecular Changes Associated with Acquired Resistance to Crizotinib in ROS1-Rearranged Non-Small Cell Lung Cancer[J]. Clin Cancer Res, 2015, 21(10): 2379–87. DOI:10.1158/1078-0432.CCR-14-1350 |
| [14] | Jun HJ, Johnson H, Bronson RT, et al. The oncogenic lung cancer fusion kinase CD74-ROS activates a novel invasiveness pathway through E-Syt1 phosphorylation[J]. Cancer Res, 2012, 72(15): 3764–74. DOI:10.1158/0008-5472.CAN-11-3990 |
| [15] | Bubendorf L, Büttner R, Al-Dayel F, et al. Testing for ROS1 in non-samll cell lung cancer: a review with recommendations[J]. Virchows Arch, 2016, 469(5): 489–503. DOI:10.1007/s00428-016-2000-3 |
| [16] | Deng G, Hu C, Zhu L, et al. Downregulation of ROS-FIG inhibits cell proliferation, colony-formation, cell cycle progression, migration and invasion, while inducing apoptosis in intrahepatic cholangiocarcinoma cells[J]. Int J Mol Med, 2014, 34(3): 661–8. DOI:10.3892/ijmm.2014.1823 |
| [17] | Pailler E, Oulhen M, Borget I, et al. Circulating Tumor Cells with Aberrant ALK Copy Number Predict Progression-Free Survival during Crizotinib Treatment in ALK-Rearranged Non-Small Cell Lung Cancer Patients[J]. Cancer Res, 2017, 77(9): 2222–30. DOI:10.1158/0008-5472.CAN-16-3072 |
 2018, Vol. 45
2018, Vol. 45