文章信息
- 靶向CD24分子3E10增强肝癌HuH-7细胞的化疗敏感度
- 3E10 Targeting CD24 Enhances Chemotherapy Sensitivity of Hepatocellular Carcinoma HuH-7 Cells
- 肿瘤防治研究, 2018, 45(8): 540-544
- Cancer Research on Prevention and Treatment, 2018, 45(8): 540-544
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1484
- 收稿日期: 2017-11-22
- 修回日期: 2018-03-19
2. 510120 广州,中山大学孙逸仙纪念医院心内科;
3. 510120 广州,广州医科大学附属第一医院检验科;
4. 510095 广州,南方医科大学皮肤病医院(广东省皮肤病医院)临床与实验研究中心
2. Department of Cardiology, The Sun Yat-sen Memorial Hospital of Sun Yat-sen University, Guangzhou 510120, China;
3. Department of Clinical Laboratory, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510120, China;
4. Clinical and Experimental Research Center, Dermatology Hospital, Southern Medical University (Guangdong Provincial Dermatology Hospital), Guangzhou 510095, China
肝癌是常见的恶性肿瘤性疾病,占全球癌症发病率的6%和致死率的9%,每年有70多万人死于肝癌,是仅次于肺癌的第二大致死性癌症。中国肝癌的新增病例数和死亡病例数占全球50%以上,远超第二名东中亚的20%和第三名欧洲的8%。我国每10万人中有超过20位肝癌患者,是欧美大部分地区肝癌发病率的4倍[1]。
目前,手术、放疗和化疗是治疗肝癌的主要手段,但仍有50%~70%的患者因复发、耐药在5年内死亡[2],其原因是这些治疗手段只能杀伤普通的肿瘤细胞,而对肿瘤干细胞(cancer stem cells, CSCs)作用有限。CSCs具有自我更新、不定向分化、高致瘤性、强耐药性等特点,是导致肿瘤复发、转移、耐药的重要原因[3]。因此寻找有效的CSCs治疗靶标,对于开发针对CSCs的药物或治疗策略,具有非常重要的意义。
CD24是肝癌CSCs的功能性分子标记[4]。研究表明,CD24在调节肿瘤细胞的生长、增殖及迁移能力方面具有重要作用,CD24的表达量和表达模式与患者生存率和预后等密切相关[5-6]。因此,本研究选择了针对肝癌细胞CD24的靶向分子3E10,研究其对肝癌HuH-7细胞的作用并探讨相关作用机制,旨在为肝癌治疗提供新的思路。
1 材料与方法 1.1 材料 1.1.1 细胞株人肝癌HuH-7细胞购自中国科学院细胞库。 1.1.2 试剂DMEM培养液(美国ThermoFisher Scientific公司,Cat. 11965092);胎牛血清(美国ThermoFisher Scientific公司,Cat. A31060802);100×GlutaMax(美国ThermoFisher Scientific公司,Cat. 35050061);100×青霉素-链霉素(美国ThermoFisher Scientific公司,Cat. 15140122);鼠源抗CD24单克隆抗体3E10(广州沃维公司,Cat. AW2985);顺铂(美国Sigma公司,Cat. 479306);Alexa Fluor 488-山羊抗小鼠IgG(美国ThermoFisher Scientific公司,Cat. A28175);细胞凋亡检测试剂盒(美国ThermoFisher Scientific公司,Cat. V13242);SYBR Premix Ex Taq(大连Takara公司,Cat. RR420A);pGEX-4T-2-CD24(本实验室保存);Normal IgG(美国Merck公司,Cat.12-371);其他Western blot用抗体购自武汉三鹰公司和北京博奥森公司;总RNA提取试剂盒(北京天根公司,Cat. DP419);引物由上海生物工程股份有限公司合成。
1.1.3 仪器Forma3110型CO2培养箱(美国ThermoFisher Scientific公司);LSR Fortessa SORP流式细胞仪(美国BD公司);CFX96实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养HuH-7细胞培养液为含10%胎牛血清、1×GlutaMax、1×青霉素-链霉素的DMEM培养液,培养条件为37℃、5%CO2恒温培养箱。
1.2.2 蛋白原核表达重组质粒pGEX-4T-2-CD24和空载pGEX-4T-2分别转化大肠杆菌BL21感受态细胞,挑取单克隆,于37℃、220 r/min条件振荡培养约6 h至细菌增殖到OD600=0.8,加入1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside, IPTG),37℃、220 r/min诱导4 h。4℃ 8 000 r/min离心5 min收集细菌,Western blot检测表达的重组蛋白GST-CD24、GST。
1.2.3 Western blot检测利用裂解液(20 mmol/L Tris,150 mmol/L NaCl,1%Triton X-100,1% SDS,2 mmol/L EDTA,1 mmol/L DTT,1×Cocktail protease inhibitor)提取细菌或细胞总蛋白,BCA法测定蛋白浓度。根据目的蛋白丰度取适量蛋白裂解液进行SDS-PAGE电泳,转NC膜,5%脱脂奶粉/TBST室温封闭1 h,加入一抗,室温孵育2 h或4℃过夜。TBST洗3次,每次10 min。加HRP标记的山羊抗鼠或兔IgG二抗(1:5 000),室温孵育1 h,同样方法洗膜3次,加入ECL底物液,室温反应5 min,X光胶片曝光检测化学发光信号。
1.2.4 流式细胞术收集2×106个HuH-7细胞,体积为500 μl。加入500 μl 8%多聚甲醛,室温固定细胞10 min。800 r/min离心5 min,1 ml PBS重悬细胞,800 r/min离心5 min,用1 ml含0.1% Triton X-100和5%血清的PBS重悬细胞,冰上放置10 min,800 r/min离心5 min。加入终浓度为1 μg/ml的3E10或IgG,冰上放置2 h,冷PBS洗3次。加入Alexa Fluor 488-山羊抗小鼠IgG二抗(1:1 000),冰上避光放置60 min后,冷PBS洗涤2次。加入0.5 ml 1%多聚甲醛重悬细胞,用于流式细胞仪分析。
1.2.5 细胞凋亡检测接种HuH-7细胞于6孔板内,每孔1×106细胞,37℃、5%CO2培养箱培养至80%密度。加入终浓度为1 µg/ml 3E10和18 µg/ml顺铂处理24 h。按照试剂盒说明进行细胞凋亡检测。细胞弃去培养液,冷PBS洗2次,用不含EDTA的0.25%胰酶消化2 min后收集细胞,加入100 μl的1×Annexin V结合液重悬细胞,使其浓度为1×106个每毫升。在细胞悬液中加入5 μl Annexin V-FITC染色液和1 μl 100 μg/ml的PI,混匀后室温避光孵育15 min。加入400 μl的1×Annexin V结合液,温和混匀后置于冰上,尽快用于流式细胞仪检测。
1.2.6 Real-time PCR接种1×106个HuH-7细胞于6 cm细胞培养皿内,37℃、5%CO2条件下培养细胞至占培养皿底面积的80%左右。加入终浓度为1 µg/ml 3E10或IgG处理24 h。收集5×106个细胞,用总RNA提取试剂盒提取细胞总RNA,取1 µg反转录为cDNA,SYBR Premix Ex Taq试剂盒检测mRNA水平变化,β-actin作为内参。Real-time PCR引物为:ABCB1:上游引物:5'-CAGCATTCAGTCAATCCGGGC-3’;下游引物:5'-AAAGAGAGCGAAGCGGCTGT-3’;ABCB5:上游引物:5'-GGAACTGCAGAAGAACAGCCAA-3’;下游引物:5'-GAAGGCAGGCTCCATTGACCA-3’;ABCC1:上游引物:5'-GACCCGCTCTGGGACTGGAA-3’;下游引物:5'-GCCCAGAGGTAAAAACAAGGCAC-3’;ABCC2:上游引物:5'-TGGTGAGTCTCCCTGTCCCTA-3’;下游引物:5'-AAAGGATGACCTTTCATCCCAACC-3’;ABCG2:上游引物:5'-TCCGCGGCACAAAGAGAAAGA-3’;下游引物:5'-ATGGTTCCAGTCAGCGTGGG-3’;β-actin:上游引物:5'-CAACACAGTGCTGTCTGGCG-3’;下游引物:5'-TACTTGCGCTCAGGAGGAGC-3’。25 μl Real-time PCR反应体系包括:12.5 μl SYBR Premix Ex Taq、10.5 μl H2O、0.5 μl上游引物(10 μmol/L)、0.5 μl下游引物(10 μmol/L)和1 μl模板。95℃ 30 s预热激活DNA聚合酶,PCR扩增条件为95℃ 5 s,60℃ 30 s,共40个循环。
1.3 统计学方法采用GraphPad Prism 6软件进行统计学分析。取3次实验数据,数据以(x±s)表示,组间比较采用单因素方差分析(One-way ANOVA),P < 0.05为差异有统计学意义。
2 结果 2.1 靶向分子3E10识别CD24蛋白和HuH-7细胞采用Western blot和流式细胞术检测靶向分子3E10结合CD24蛋白的特异性。抗CD24抗体3E10可以特异性识别外源表达的CD24。同时,3E10也可以识别HuH-7细胞及其内源表达的CD24,见图 1。结果表明,3E10可以作为HuH-7细胞CD24的靶向作用分子。
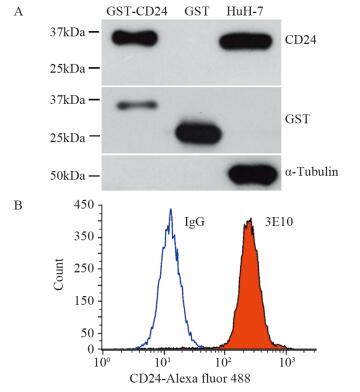
|
| A: antibody specificity was verified by Western blot; B: cell recognition property of the antibody was detected by flow cytometry 图 1 靶向分子3E10特异性识别CD24和HuH-7细胞 Figure 1 Target molecule 3E10 specifically recognized CD24 and HuH-7 cells |
通过Annexin V-FITC/PI双染色法检测3E10联合顺铂对HuH-7细胞的抑制作用,见图 2。与对照组相比CD24靶向分子3E10使顺铂对HuH-7细胞的抑制率由(10.3±3.0)%提高至(34.4±10.8)%,差异有统计学意义(P=0.031)。早晚期细胞凋亡总数以及死亡细胞数均显著提高(P=0.006, 0.047)。结果表明,3E10可显著增强HuH-7细胞对顺铂的敏感度。
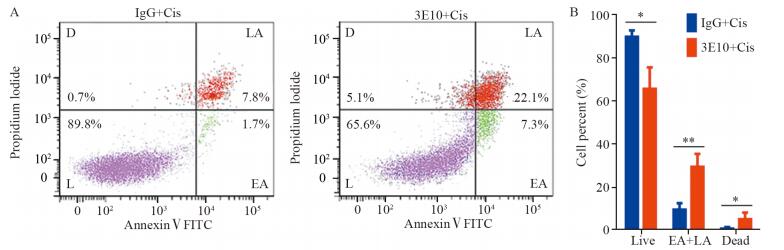
|
| L: Live; D: Dead; EA: early apoptosis; LA: late apoptosis; IgG: mouse normal IgG; 3E10: mouse anti-CD24 monoclonal antibody, clone 3E10; Cis: Cisplatin; A: cell apoptosis was detected by flow cytometry; B: statistical analysis of cell apoptosis; *: P < 0.05, **: P < 0.01 图 2 靶向分子3E10联合顺铂对HuH-7细胞的抑制作用 Figure 2 Inhibition of target molecule 3E10 and cisplatin on HuH-7 cells |
靶向分子3E10处理HuH-7细胞24 h,Real-time PCR检测ABC基因家族的表达情况,结果显示,与对照组相比,3E10处理组耐药基因ABCB1、ABCB5和ABCC1的转录水平显著下调(P < 0.05),分别下降(32.7±8.1)%(P=0.026)、(23.1±4.3)%(P=0.041)和(28.1±10.32)%(P=0.039)。Western blot检测结果显示,3种基因的蛋白质水平亦相应下调。3E10对ABCC2和ABCG2基因的表达水平没有显著影响,见图 3。
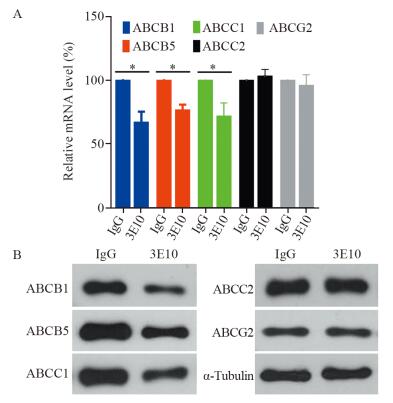
|
| Gene expression was detected by real-time PCR (A) and Western blot (B) respectively; *: P < 0.05 图 3 靶向分子3E10对HuH-7细胞中耐药基因ABC表达水平的影响 Figure 3 Effect of 3E10 on expression of drug-resistant gene ABC in HuH-7 cells |
用1 µg/ml靶向分子3E10处理HuH-7细胞24 h,Western blot检测HuH-7细胞的肿瘤干细胞标志物,结果显示,NANOG和CD24蛋白水平显著下调(P < 0.01),分别下降(68.4±5.8)%(P=0.0052)和(87.9±2.6)%(P=0.0029)。β-catenin总蛋白水平无明显变化,但其磷酸化水平显著下降(75.1±10.3)%(P=0.0067),见图 4。结果表明,3E10可以降低HuH-7细胞的肿瘤干性。
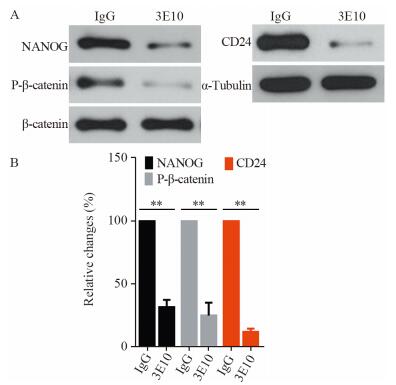
|
| A: protein levels were detected by Western blot; B: band intensity of figure A was quantified by Image J; **: P < 0.01 图 4 3E10对HuH-7细胞肿瘤干性的影响 Figure 4 Effect of 3E10 on tumor stemness of HuH-7 cells |
采用1 µg/ml 3E10处理HuH-7细胞24 h,Western blot检测JAK/STAT3和PI3K/AKT信号通路,STAT3、AKT总蛋白水平无明显变化,但二者磷酸化水平显著降低,分别下降(39.0±9.0)%(P=0.034)和(74.8±13.2)%(P=0.0075),见图 5。STAT3、AKT的磷酸化水平与其信号通路活性成正相关,结果说明,3E10可以降低HuH-7细胞的JAK/STAT3和PI3K/AKT信号通路活性。
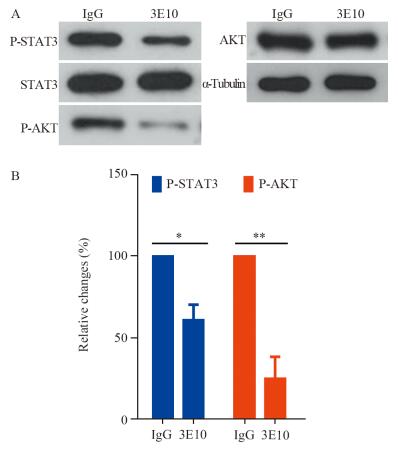
|
| A: protein phosphorylation levels were detected by Western blot; B: band intensity of figure A was quantified by Image J; *: P < 0.05, **: P < 0.01 图 5 靶向分子3E10对HuH-7细胞JAK/STAT3和PI3K/AKT信号通路的影响 Figure 5 Effect of 3E10 on JAK/STAT3 and PI3K/AKT signaling pathways of HuH-7 cells |
CD24是肝癌CSCs的功能性分子标志物[4],是一种低分子量高度糖基化的蛋白质,由27个氨基酸组成,通过糖基磷脂酰肌醇黏附在细胞膜上[7]。针对CD24分子对膀胱癌、结肠癌和胰腺癌进行治疗获得了正面的结果[8-9],但是尚未见到针对肝癌CD24分子治疗的报道。因此,本研究选取抗CD24抗体3E10作为靶向分子,探讨其是否对HuH-7细胞尤其是HuH-7细胞的化疗敏感度有影响,并藉以进一步解析相关分子机制。
顺铂是一种临床常用的广谱抗肿瘤药,它进入细胞后与DNA结合,引起交叉联结,造成DNA损伤,破坏DNA复制和转录,并抑制细胞有丝分裂,高浓度时也抑制RNA及蛋白质的合成,为一种细胞非特异性药物[10]。本研究结果显示,单独使用顺铂对HuH-7细胞的抑制率仅有10.3%,顺铂联合3E10共同作用可以使抑制率增加两倍以上,到达34.4%,说明3E10能够增强HuH-7细胞对顺铂的敏感度。
肿瘤耐药的重要原因是ABC基因,ABC蛋白转运家族是一类膜结合的能量依赖的外流性转运蛋白,通过介导化疗药的排出来增强肿瘤细胞的耐药性。在乳腺癌、卵巢癌、白血病、肺癌和胃癌等多种恶性肿瘤发生耐药时,细胞中均存在ABC基因的过表达[11]。3E10可以下调HuH-7细胞ABCB1、ABCB5、ABCC1基因的表达水平(P < 0.05),可能是3E10增强HuH-7细胞对顺铂敏感度的重要原因。
强耐药性的CSCs是肿瘤难以彻底治愈的重要原因,以杀伤CSCs为目的的治疗策略是目前肿瘤治疗的重要研究方向。美国癌症研究协会建议成功的癌症治疗应该清除CSCs,包括抑制CSCs的自我更新能力或诱导CSCs分化为对常规化疗药物更敏感的非肿瘤起源细胞。本研究中,靶向CD24分子3E10可以降低HuH-7细胞的肿瘤干性,低干性的HuH-7可能对顺铂更为敏感。
JAK/STAT3和PI3K/AKT信号通路在肿瘤发生、发展过程中扮演重要角色。STAT3是转录调节因子,45.5%的肝癌病例存在JAK/STAT3异常[1]。过度活化的STAT3可以上调抗凋亡基因Bcl2、细胞周期蛋白Cyclin D、促血管形成因子VEGF和促肿瘤转移因子MMP的表达,同时还有利于肿瘤免疫逃避[12]。类似的,过度激活的PI3K/AKT信号通路可通过下调肿瘤抑制蛋白p53、刺激蛋白合成、抑制细胞凋亡等导致肿瘤细胞的无限增殖[13]。分别以JAK/STAT3和PI3K/AKT信号通路为肿瘤分子靶向治疗的研究和临床应用取得了积极的效果。因此,3E10使HuH-7细胞STAT3和AKT的磷酸化水平下降,活性降低,对于抑制HuH-7细胞活性,增强顺铂敏感度具有重要作用。
综上所述,靶向CD24分子3E10可以增强肝癌HuH-7细胞对顺铂的敏感度,其机制可能是通过下调耐药基因ABC表达、降低肿瘤干性、下调JAK/STAT3和PI3K/AKT信号通路活性来实现的。这一发现为进一步研究靶向CD24分子抗肝癌机制和开发新的肝癌治疗策略提供了理论基础和实验依据。
| [1] | Stewart BW, Wild CP. World Cancer Report 2014[M]. WHO: International Agency for Research on Cancer, 2014: 403-13. |
| [2] | Le Grazie M, Biagini MR, Tarocchi M, et al. Chemotherapy for hepatocellular carcinoma: The present and the future[J]. World J Hepatol, 2017, 9(21): 907–20. DOI:10.4254/wjh.v9.i21.907 |
| [3] | Chiba T, Iwama A, Yokosuka O. Cancer stem cells in hepatocellular carcinoma: Therapeutic implications based on stem cell biology[J]. Hepatol Res, 2016, 46(1): 50–7. DOI:10.1111/hepr.12548 |
| [4] | Castelli G, Pelosi E, Testa U. Liver Cancer: Molecular Characterization, Clonal Evolution and Cancer Stem Cells[J]. Cancers (Basel), 2017, 9(9): pii: E127. |
| [5] | Muinao T, Deka Boruah HP, Pal M. Diagnostic and prognostic biomarkers in ovarian cancer and the potential roles of cancer stem cells-An updated review[J]. Exp Cell Res, 2018, 362(1): 1–10. DOI:10.1016/j.yexcr.2017.10.018 |
| [6] | Liu G, Liu GX, Fang Y, et al. Clinicopathological and prognostic value of CD24 expression in breast cancer: a meta-analysis[J]. Int J Biol Markers, 2017, 32(2): e182–9. DOI:10.5301/jbm.5000254 |
| [7] | Tan Y, Zhao M, Xiang B, et al. CD24: from a hematopoietic differentiation antigen to a genetic risk factor for multiple autoimmune diseases[J]. Clin Rev Allergy Immunol, 2016, 50(1): 70–83. DOI:10.1007/s12016-015-8470-2 |
| [8] | van Kessel KE, Zuiverloon TC, Alberts AR, et al. Targeted therapies in bladder cancer: an overview of in vivo research[J]. Nat Rev Urol, 2015, 12(12): 681–94. DOI:10.1038/nrurol.2015.231 |
| [9] | Shapira S, Pleban S, Kazanov D, et al. Terpinen-4-ol: A Novel and Promising Therapeutic Agent for Human Gastrointestinal Cancers[J]. PLoS One, 2016, 11(6): e0156540. DOI:10.1371/journal.pone.0156540 |
| [10] | Jain A, Jahagirdar D, Nilendu P, et al. Molecular approaches to potentiate cisplatin responsiveness in carcinoma therapeutics[J]. Expert Rev Anticancer Ther, 2017, 17(9): 815–25. DOI:10.1080/14737140.2017.1356231 |
| [11] | Begicevic RR, Falasca M. ABC Transporters in Cancer Stem Cells: Beyond Chemoresistance[J]. Int J Mol Sci, 2017, 18(11): E2362. DOI:10.3390/ijms18112362 |
| [12] | Huynh J, Etemadi N, Hollande F, et al. The JAK/STAT3 axis: A comprehensive drug target for solid malignancies[J]. Semin Cancer Biol, 2017, 45: 13–22. DOI:10.1016/j.semcancer.2017.06.001 |
| [13] | Lv D, Guo L, Zhang T, et al. PRAS40 signaling in tumor[J]. Oncotarget, 2017, 8(40): 69076–85. |
 2018, Vol. 45
2018, Vol. 45


