文章信息
- 乳腺癌患者多西他赛药时曲线下面积与中性粒细胞减少的相关性
- Relationship Between Docetaxel AUC and Neutropenia in Patients with Breast Cancer
- 肿瘤防治研究, 2018, 45(5): 285-288
- Cancer Research on Prevention and Treatment, 2018, 45(5): 285-288
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1459
- 收稿日期: 2017-11-17
- 修回日期: 2018-03-01
乳腺癌是一种严重影响妇女身心健康的最常见的恶性肿瘤之一,且目前全球发病率呈逐年上升趋势[1]。多西他赛作为乳腺癌最常用的化疗药物之一,被广泛应用于其一线的化疗方案中[2-3]。目前,多西他赛的给药剂量根据体表面积(body surface area, BSA)计算。有研究表明,当基于BSA给药时,多西他赛在不同患者间的药代动力学(pharmacokinetics, PK)差异较大,其个体间清除率差异可达到7倍以上[4]。患者药代动力学间差异被认为是引起化疗药物不良反应的主要原因[5-6]。应用多西他赛治疗的患者中, 中性粒细胞减少是主要剂量限制性毒性[7-8]。
胶乳增强免疫比浊法(latex enhanced immunity against turbidity, LEITA)是一种具有高特异性、高灵敏度的免疫检测方法,该方法简便、快速,准确度高,可在生化分析仪上实现批量测定,目前在临床上已得到广泛应用[9]。本研究采用胶乳免疫比浊法测定患者给药后血浆中多西他赛的浓度,计算其药时曲线下面积(area under curve, AUC),探讨由多西他赛引起的中性粒细胞减少的血液学毒性与AUC之间的相关性,为优化患者个体化治疗方案、降低药物毒性提供理论依据。
1 资料与方法 1.1 临床资料本研究经郑州大学附属肿瘤医院医学伦理学委员会批准,选取2016年12月—2017年7月该院乳腺二病区收治的女性乳腺癌患者94例。患者纳入条件:病理诊断为乳腺恶性肿瘤且化疗方案为AC-T方案(多柔比星联合环磷酰胺序贯多西他赛)的术后辅助化疗患者;年龄20~80岁之间;距离末次化疗时间不少于3周;心肾肝肺功能正常;PS评分0~2分。所有患者均签署了知情同意书。
1.2 方法 1.2.1 治疗方法94例患者均使用AC-T治疗方案一线化疗。多西他赛给药剂量为75 mg/m2,每周期第一天静脉滴注1 h;21天为1周期,共4周期。
1.2.2 血药浓度测定及药代动力学参数计算所有患者均于化疗第一周期多西他赛滴注结束前10 min内采集外周静脉血1次,输注结束后30 min采集外周静脉血1次。两份血样的采集量均为2~3 ml,置于K2EDTA抗凝采血管中,3 000 r/min离心10 min,取200 μl血浆加入离心管内,于2℃~8℃冷藏待测。采用美可安多西他赛测定试剂盒(上海复兴长征生物制品公司)胶乳免疫比浊法测定患者静脉输注DTX后的血药浓度,采用MycareTM药物暴露软件计算多西他赛AUC。
1.2.3 血液学毒性评估所有患者均在多西他赛第一周期化疗前1~2天及化疗结束后每隔2~3天进行血常规检查。依据美国癌症研究所通用毒性标准(NCI-CTC)3.0版对血液学毒性进行评估,血液学毒性分为0~Ⅳ级。具体标准为:中性粒细胞量 > 2.0×109/L为0度,(1.5~1.9)×109/L为Ⅰ度,(1.0~1.4)×109/L为Ⅱ度,(0.5~0.9)×109/L为Ⅲ度,< 0.5×109/L为Ⅳ度。对化疗前后中性粒细胞减少的百分比进行统计分析。中性粒细胞减少的百分比=(化疗前的中性粒细胞数量-化疗后的中性粒细胞数量最低值)/化疗前的中性粒细胞数量×100%。
1.3 统计学方法采用SPSS18.0统计软件进行数据分析,计量数据用平均值±标准差表示。服从正态分布的数据比较采用t检验,不服从正态分布的数据采用χ2检验,P < 0.05为差异有统计学意义。
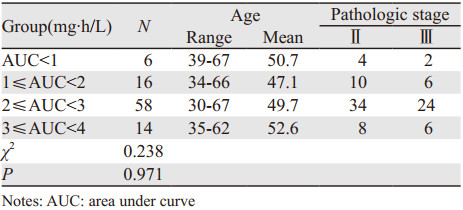
2 结果 2.1 多西他赛AUC分布情况所有患者均完成了标准剂量的DTX静脉滴注。经计算,患者AUC范围为(0.7~3.9)mg·h/L,平均值为(2.34±0.7)mg·h/L,个体间最大差距可达5.6倍,见图 1。患者间AUC的变异系数(CV%)为30%,可见基于体表面积给药的DTX血药浓度AUC差异较大。
|
| 图 1 乳腺癌患者AUC分布情况 Figure 1 AUC of docetaxel in patients with breast cancer |
根据血药浓度测定结果,将患者化疗后多西他赛的AUC分布情况分成四组:AUC < 1 mg·h/L、1≤AUC < 2 mg·h/L、2≤AUC < 3 mg·h/L、3≤AUC < 4 mg·h/L。其中2≤AUC < 3 mg·h/L组患者所占比例最大,为61.7%。四组患者的临床特征差异均无统计学意义(P > 0.05),见表 1。可见多西他赛的AUC受患者临床病理特征的影响较小。
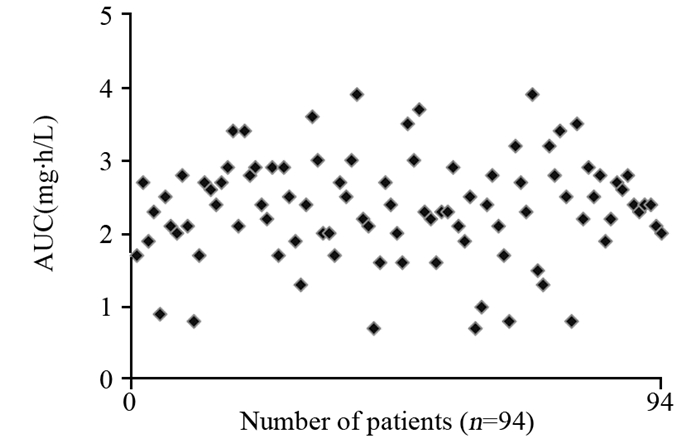
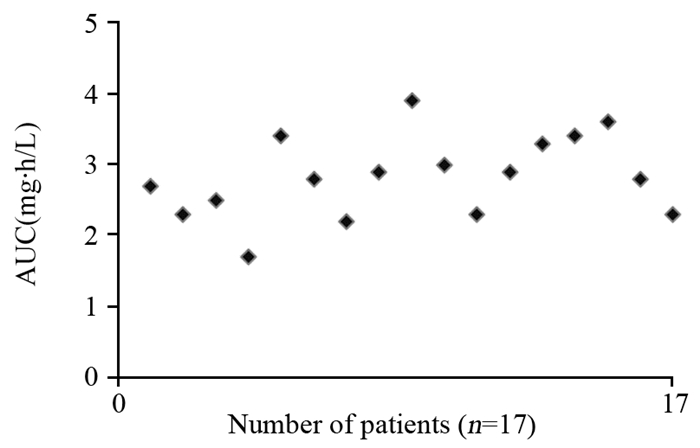
本研究发现,患者采用多西他赛化疗后发生的不良反应主要为血液系统毒性、恶心、呕吐等。其中,患者中性粒细胞减少是DTX主要的血液学不良反应。在化疗过程中出现3~4级中性粒细胞减少的患者有17例(18%)。发生3~4级中性粒细胞减少患者与发生0~2级中性粒细胞减少的患者的平均AUC分别为2.82 mg·h/L与2.29 mg·h/L,二者差异有统计学意义(P=0.003),见图 2~3。
|
| 图 2 3~4级中性粒细胞减少的乳腺癌患者AUC分布情况 Figure 2 AUC of docetaxel in breast cancer patients with grade 3-4 neutropenia |
|
| 图 3 发生0~2级中性粒细胞减少的乳腺癌患者AUC分布情况 Figure 3 AUC of docetaxel in breast cancer patients with grade 0-2 neutropenia |
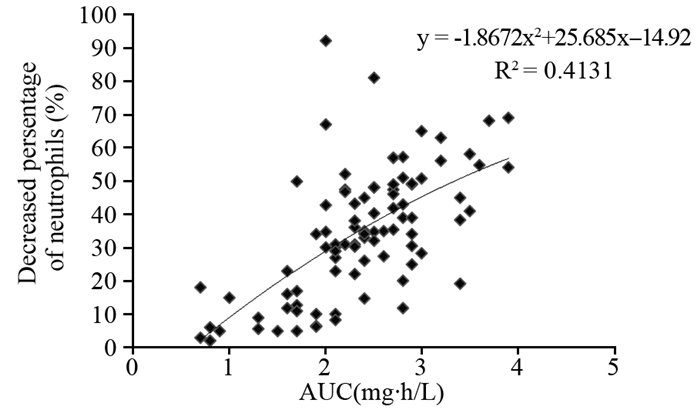
统计多西他赛化疗前后中性粒细胞减少百分比,结果发现,化疗后中性粒细胞数量较化疗前平均降低38.2%。统计分析多西他赛AUC与中性粒细胞减少百分比之间的关系,发现中性粒细胞减少的百分比随着AUC增加而上升。以DTX血药浓度AUC为横坐标X,中性粒细胞减少百分比为纵坐标Y, 进行回归分析,建立利用AUC预测中性粒细胞减少百分比的数学模型,见图 4。回归方程为:y=-1.8672x2+25.658x-14.92,其中x为AUC,y为中性粒细胞减少百分比,r=0.643。
|
| 图 4 AUC与中性粒细胞减少百分比之间的关系 Figure 4 Relationship between AUC and decreased percentage of neutrophils |
乳腺癌是女性常见的恶性肿瘤,近年来发病率和死亡率都有增高趋势[10]。辅助化疗作为乳腺癌综合治疗的重要组成部分,可以明显减少复发转移,改善患者的生活质量,延长生存期[11]。目前,AC-T方案被认为是乳腺癌患者术后辅助化疗的一线方案[12]。然而此方案中DTX血液学毒性较严重,本研究显示,采用该方案化疗的患者3~4级中性粒细胞减少的发生率达18%。
DTX的血液学毒性一直是限制其剂量应用的主要因素。目前发现DTX血药浓度AUC为最有效的用来预测DTX临床毒性的药代动力学参数[13]。本研究结果表明,随着AUC的增加,中性粒细胞减少的百分比、3~4级中性粒细胞减少的发生率也随之增加。因此,监测患者给药后的AUC并进行个体化调节将有助于降低血液学毒性的发生率。
本研究结果发现,当采用y=-1.8672x2+25.658x-14.92所代表的曲线进行拟合时相关系数最大,r=0.643。因此建立了利用AUC预测中性粒细胞减少百分比的数学模型。该模型将会根据患者化疗前中性粒细胞的数量与AUC值来预测化疗后的中性粒细胞数量,为临床医生提供更准确的血液学毒性预测信息。对于具有严重血液学毒性风险的患者,医生可采取降低DTX剂量或预防性给予粒细胞刺激因子等治疗措施,从而减少药物毒性对患者带来的危害,改善治疗效果,延长患者生存时间。
在降低血液学毒性的同时,我们也需要考虑其临床疗效。有研究证实,多西他赛的血药浓度与其疗效具有一定相关性[14]。本研究尝试分析乳腺癌患者多西他赛AUC与临床疗效之间的关系,试图找出一个能够平衡临床疗效与血液学毒性的AUC范围。但发现第一周期多西他赛AUC与患者的临床疗效不存在统计学上的相关性,可能与样本量较小以及观察时间不足有关。因此,要获得多西他赛在乳腺癌患者人群中的理想治疗窗还需进行大样本的研究。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69–90. DOI:10.3322/caac.v61:2 |
| [2] | 王建逵. 吡柔比星和环磷酰胺联合多西他赛对乳腺癌的临床疗效观察[J]. 实用癌症杂志, 2015, 30(4): 537–40. [ Wang JK. Clinical efficacy of pirarubicin and cyclophosphamide combined with docetaxel for breast cancer[J]. Shi Yong Ai Zheng Za Zhi, 2015, 30(4): 537–40. ] |
| [3] | 郝静, 赵鹏飞. 多西他赛与阿霉素和环磷酰胺新辅助治疗局部晚期乳腺癌的临床研究[J]. 中国临床药理学杂志, 2014, 30(4): 303–5. [ Hao J, Zhao PF. Clinical efficacy of TCA vs. CMF neo-adjuvant chemotherapy on patients with locally advanced breast cancer[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2014, 30(4): 303–5. ] |
| [4] | Krens SD, McLeod HL, Hertz DL. Pharmacogenetics, enzyme probes and therapeutic drug monitoring as potential tools for individualizing taxane therapy[J]. Pharmacogenomics, 2013, 14(5): 555–74. DOI:10.2217/pgs.13.33 |
| [5] | Engels FK, Loos WJ, van der Bol JM, et al. Therapeutic drug monitoring for the individualization of docetaxel dosing: a randomized pharmacokinetic study[J]. Clin Cancer Res, 2011, 17(2): 353–62. DOI:10.1158/1078-0432.CCR-10-1636 |
| [6] | Joerger M, Kraff S, Huitema AD, et al. Evaluation of a pharmacology-driven dosing algorithm of 3-weekly paclitaxel using therapeutic drug monitoring: a pharmacokinetic-pharmacodynamic simulation study[J]. Clin Pharmacokinet, 2012, 51(9): 607–17. DOI:10.1007/BF03261934 |
| [7] | 陈卓, 王芳, 李林, 等. 多西他赛血液毒性人群间差异回顾分析及临床观察[J]. 肿瘤基础与临床, 2016, 29(1): 68–70. [ Chen Z, Wang F, Li L, et al. A retrospective analysis and cllinical observation of the differences in the blood toxicity of docetaxel[J]. Zhong Liu Ji Chu Yu Lin Chuang, 2016, 29(1): 68–70. ] |
| [8] | Cline DJ, Zhang H, Lundell GD, et al. Development and evaluation of a nanopartical-based immunossay for determining paclitaxel concentrations on routine clinical analyzers[J]. Ther Drug Monit, 2013, 35(6): 809–15. DOI:10.1097/FTD.0b013e318296be01 |
| [9] | 贾萌萌, 张俊, 左莉华, 等. 胶乳增强免疫比浊法测定人血浆多西他赛浓度方法学评价及其临床应用[J]. 中国医院药学杂志, 2016, 36(24): 2184–7. [ Jia MM, Zhang J, Zuo LH, et al. Evaluation of latex-enhanced turbidimetric immunoassy for determining docetaxel concentrations and its clinical application[J]. Zhongguo Yi Yuan Yao Xue Za Zhi, 2016, 36(24): 2184–7. ] |
| [10] | DeSantis C, Ma J, Bryan L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 53–62. |
| [11] | 沈坤炜, 李宏为. 乳腺癌的现代治疗模式:多学科综合诊治[J]. 外科理论与实践, 2014, 19(5): 369–71. [ Shen KW, Li HW. The modern treatment model of breast cancer: multidisciplinary comprehensive diagnosis and treatment[J]. Wai Ke Li Lun Yu Shi Jian, 2014, 19(5): 369–71. ] |
| [12] | 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J]. 中国癌症杂志, 2015, 25(9): 692–754. [ CACA-CBCS. Guidelines and specifications for the diagnosis and treatment of breast cancer (2015 Version)[J]. Zhongguo Ai Zheng Za Zhi, 2015, 25(9): 692–754. ] |
| [13] | Joerger M. Metabolism of the taxanes including nab-paclitaxel[J]. Expert Opin Drug Metab Toxicol, 2015, 11(5): 691–702. DOI:10.1517/17425255.2015.983074 |
| [14] | Lévy P, Gligorov J, Antoine M, et al. Influence of ABCB1 polymorphisms and docetaxel pharmacokinetics on patological response to neoadjuvant chemotherapy in breast cancer patients[J]. Breast Cancer Res Treat, 2013, 139(2): 421–8. DOI:10.1007/s10549-013-2545-7 |
 2018, Vol. 45
2018, Vol. 45