文章信息
- 胃黏膜瘤变过程中差异蛋白的表达
- Proteomics Research on Gastric Intraepithelial Neoplasia
- 肿瘤防治研究, 2018, 45(8): 576-582
- Cancer Research on Prevention and Treatment, 2018, 45(8): 576-582
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1439
- 收稿日期: 2017-11-15
- 修回日期: 2018-03-19
一直以来,早期胃癌、癌前病变及胃低/高级别上皮内瘤变(即异型增生)的组织病理学诊断标准存在分歧,给精准病理诊断带来了困难,也不利于临床对胃癌前病变和早期胃癌的治疗。目前关于胃癌的研究很多,但鲜有应用蛋白质组学技术筛选胃癌发生发展的不同阶段分子标志物的研究。因此,我们以胃窦部肠型胃癌为研究对象,用非标记蛋白质组学(label-free)联合液性色谱质谱(LC-MC/MC),筛选各组间差异蛋白质,并评估差异蛋白潜在的生物学功能。
1 材料和方法 1.1 材料 1.1.1 标本研究对象选自2005年1月至2010年1月在兰州大学第二医院接受胃镜内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)、内镜黏膜下切除术(endoscopic mucosal resection, EMR)或胃切除患者,所选组织均为10%的中性缓冲福尔马林固定的石蜡包埋组织,回顾性分析相对应的HE染色切片。
1.1.2 蛋白质组学结果分析软件MaxQuant 1.3.0.5(Max Planck Institute of Biochemistry in Martinsried, Germany)。
1.2 方法 1.2.1 实验分组选取5组共150例石蜡包埋组织。胃窦部无异型增生的相对正常的胃黏膜、反应性增生(reactive hyperplasia)胃黏膜、低级别上皮内瘤变(low-grade intraepithelial neoplasia)的胃窦病变黏膜、高级别上皮内瘤变(high-grade intraepithelial neoplasia)的胃窦黏膜病变、胃窦部黏膜内癌(intramucosal carcinoma)各30例,分别称为A、B、C、D、E组。5组相应的HE代表性标准图片,见图 1。分组后进行的蛋白质组学实验分为筛选和验证二个阶段,将每组30例临床样本再随机分为三小组,即A1、A2、A3,B1、B2、B3,C1、C2、C3,D1、D2、D3,E1、E2、E3共15小组。每一例选二个蜡块,二者均具有完全相同的HE形态及病理诊断,一个蜡块用于蛋白质组学检测,另一个蜡块用于免疫组织化学法验证蛋白质学的可靠性。
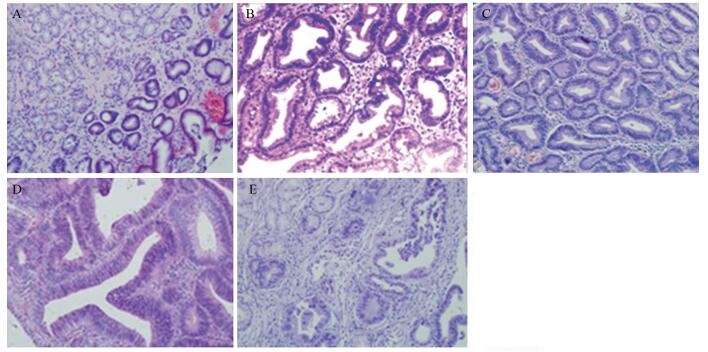
|
| A: normal tissue; B: reactive hyperplasia; C: low-grade intraepithelial neoplasia; D: high-grade in traepithelial neoplasia; E: intramucosal carcinoma 图 1 蛋白质组学入组的5组石蜡包埋组织代表性病理图片 Figure 1 Representative pathologic figures of five groups of paraffin-embedded tissuses for proteomics |
将每个10%中性缓冲福尔马林固定石蜡包埋标本(FFPE),对应的HE切片置于普通光学显微镜下观察,将各组典型病变细胞用记号笔标记出来,将HE切片对应于相应的蜡块,标记出目的细胞在蜡块所在的部位,一次性刀片在蜡块上将目的细胞所在的区域与周围组织划一道较深的痕迹再切片,每片4~10 μm厚,将每一张切片中的目的细胞与周围组织分离,保证所送蛋白质组学的每一份材料均为典型病变的细胞,最大程度去除杂质,保证实验结果的可靠性,将15小组精心挑选的蜡片储存在PC管中,低温保存。
1.2.3 蛋白质组学检测(1)组织标本预处理:15小组的EP管依次加入已配制好的二早苯脱蜡30 min,然后用移液枪将二甲苯吸去,再加入二甲苯,如此重复脱蜡三次,其间一直用振荡器,以保证充分脱蜡。每一小管依次加入梯度酒精(90%、80%、70%)各30 min,以充分去除二甲苯,移液枪将酒精吸去,加热10 min,水化3次,每次10 min,-80℃低温保存,干冰运输,委托上海中科新生命生物科技有限公司进行蛋白质组学检测。(2)LC-MS/MS预实验:将15小组样品各取200 μl通过SDS-PAGE电泳,LC-MS/MS(质谱仪器):LTQ-Velos,经过匀浆+SDT裂解,通过软件Proteome Discoverer-SEQUEST进行分析及结果评价。(3)LC-MS/MS实验:进行蛋白质的裂解和定量,SDS-PAGE电泳,再进行蛋白质的FASP酶解,采用LC-MS/MS分析酶解产物,采用HPLC液相系统EASY-nLC1000进行分离。溶液为0.1%甲酸乙腈水溶液(乙腈为2%)和0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱为Thermo EASY column SC200 150 μm 100 mm。样品自动上样到Thermo EASY column SC001 traps,采用色谱柱分离。酶解产物通过毛细管高效液相色谱分离后进行质谱分析。
1.2.4 数据分析(1)MaxQuant的非标记分析:15个原始文件用MaxQuant软件(版本号1.3.0.5)查库,Label-free定量分析。数据库为uniprot human 146704_20150720.fasta(2015-07-20)。(2)Perseus的统计学和生物信息学分析:采用Perseus软件分析MaxQuant所获得的查库文件,Perseus软件版本号为1.3.0.4(Max Planck Institute of Biochemistry in Martinsried, Germany)。(3)差异表达蛋白质Gene Ontology(GO)富集分析:GO是基因功能分类体系,是动态更新的标准化体系,它从三个方面描述蛋白质的属性:①生物过程(biological process),②分子功能(molecular function),③细胞组分(cellular component)。④KEGG通路富集分析:KEGG是常用于通路研究的数据库之一。
2 结果 2.1 蛋白质组学预实验结果与分析通过软件ProteomeDiscoverer-SEQUEST分析及结果评价,确定样品制备及酶解正常,质谱鉴定结果及样品评介均正常,且组内和组间所有样品平行性好,可以进行后续实验。
2.1.1 蛋白质浓度测定蛋白质浓度测定结果表明总量满足2次或2次以上实验,见表 1。
由考染图谱来看,蛋白提取结果正常,检测图谱如下所示,电泳条带清晰,表明质量满足实验要求,见图 2。
|
| 图 2 五组样品的SDS-PAGE电泳图谱 Figure 2 SDS-PAGE electroph-oretogram of five groups of samples |
LC-MS/MS分析过程是酶解后的肽段先经过色谱柱进行分离,然后串联进入质谱检测器中进行一级和二级质谱分析。该方法适用于复杂样品的分析,可以增加低丰度蛋白质被鉴定出的概率。Basepeak图是在该过程中将每个时间点质谱检测信号最强的肽段的强度值连续描绘得到的图谱。如图 3、图 4(图 4为以E1组为例,选取质谱分析中一小段Basepeak图放大)所示,横坐标为肽段在色谱中的保留时间,纵坐标为质谱信号强度,主要峰上的数字标记分别为信号峰强度最高的肽段的保留时间和质荷比。Basepeak图主要反映样品的色谱分离度、肽段信号强度(可以结合上样体积判断样品酶解情况)、样品中蛋白质的构成复杂程度等。如果从色谱图上看到在不同时间洗脱的峰较多,而且相对丰度较高,则说明样品中的肽段种类较多,复杂程度较高。
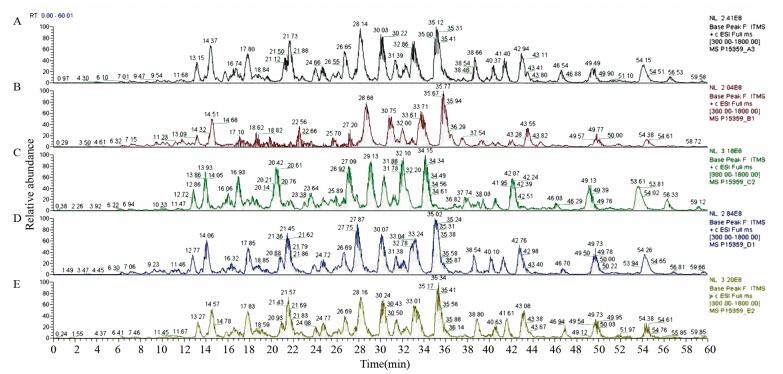
|
| 图 3 A、B、C、D、E 5组代表性的Basepeak图谱 Figure 3 Representative Basepeak spectrum of five groups |
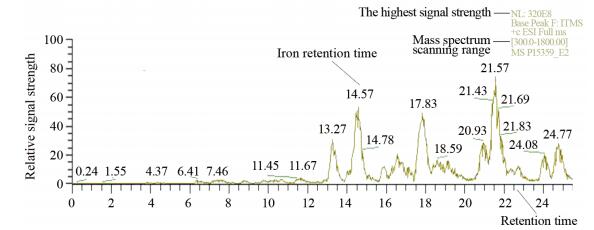
|
| 图 4 E1组Basepeak图谱 Figure 4 Basepeak spectrum of group E1 |
以OD280吸收值对酶解后肽0.431段的相对浓度进行评估,实验测得的各组肽段浓度见表 2。
本次实验共鉴定肽段数17 443个,蛋白质组数2 807个。
2.3 生信分析结果根据Correa[1]提出的癌变模式:无异型增生的正常胃窦黏膜(A)-反应性增生(B)-低级别上皮内瘤变(C)-高级别上皮内瘤变(D)-黏膜内癌(E)为顺序(即A-B-C-D-E)进行生物信息学分析。
2.3.1 聚类分析5组原始数据中定性到蛋白质共2 777个,其中以筛选Ratio标准大于或小于1.2且P < 0.05筛选到差异蛋白质数目为355个。355个蛋白质构成的聚类图中红色代表蛋白质的表达量上调,蓝色代表蛋白质的表达量下调,颜色深浅代表上调或下调的程度聚类分析,见图 5。在相似性的基础上对数据进行分组、归类,聚类分组的结果显示,组内样本的数据模式相似性较高,即正常胃黏膜A1、A2、A3三组间相似性较高,反应性增生B1、B2、B3三组间相似性较高,低级别上皮内瘤变C1、C2、C3三组间相似性较高,高级别上皮内瘤变D1、D2、D3三组间相似性较高,黏膜内癌E1、E2、E3三组间相似性较高,证明了筛选的目标蛋白质的合理性。而组间的数据模式变量相似性较低,即A、B、C、D、E五大组之间相似性较低,表示生物学处理对样本没有造成显著影响;我们可以从目标蛋白质的聚类结果中直观地区分具有不同表达模式的蛋白质子集合,具有相近表达模式的蛋白质可能具有相似的功能或参与相同的生物学途径,或者在通路中处于临近的调控位置。
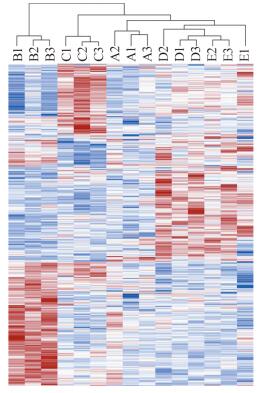
|
| Red: up-regulation; Blue: down-regulation 图 5 差异表达蛋白质的聚类图 Figure 5 Cluster analysis of differentially-expressed proteins |
通过Fisher精确检验,来评价某个GO term蛋白质富集度的显著性水平。GO富集分析从16个方面评价了癌变过程中蛋白质变化的显著性,各类蛋白质变化的具体比例见GO term富集图,见图 6。
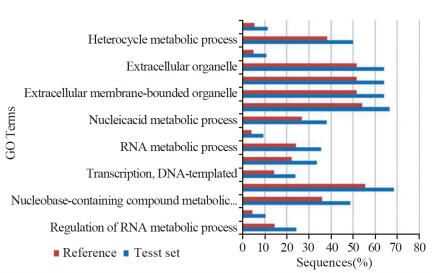
|
| 图 6 显著富集的GO term富集图 Figure 6 Enrichment analysis of GO term |
对355个差异蛋白质的GO注释可以从参与的生物学过程、分子功能及细胞组分三个方面对这些差异蛋白质进行分类,在生物学过程发生变化的有18个,其中明显变化的11个生物学过程为:cellular process, metabolic process, single-organism process, biological regulation, response to stimulas, localization, cellular component organization, biogenesis, multicellular-organism process, development process, signaling等,分子功能有13个,其中最明显的分子功能变化有二个:binding, catalytic activity。在细胞组分有11个成份变化,变化明显的主要有6个方面:cell, organelle, extracellular region, membrane, macromolecular complex, membrane-enclosed lumen。
2.3.4 KEGG通路富集分析在癌变的过程中有大量蛋白质发生明显变化,在生物体中,蛋白质并不独立行使其功能,通路分析可以更系统更全面地了解细胞的生物学过程和疾病的发生机制等。发生变化的355个差异显著的蛋白质主要表现为内质网中蛋白质变化、氧化磷酸化为主的多条代谢及信号途径。
2.3.5 免疫组织化学验证根据通路富集分析、蛋白质的表达量及与胃癌相关性大小,选定8个蛋白质进行验证。和正常黏膜相比,在反应性不典型性-低级别上皮内瘤变-高级别上皮内瘤变及黏膜内癌的发展过程中,LAMN1、ERGIC1、UQCRFS1、UQCRH、CISD1这5个蛋白质的表达量逐渐降低,表达量逐渐升高的蛋白质有HMGB1、DNA-PKcs、14-3-3。用免疫组织化学验证蛋白组学的可靠性,免疫组织化学预实验结果同蛋白质组学结果相符,提示这8个蛋白质在胃癌的发生、发展中具有重要意义。ERGIC1在各组的免疫组织化学染色结果见图 7,DNA-PKcs在各组的免疫组织化学染色结果见图 8。
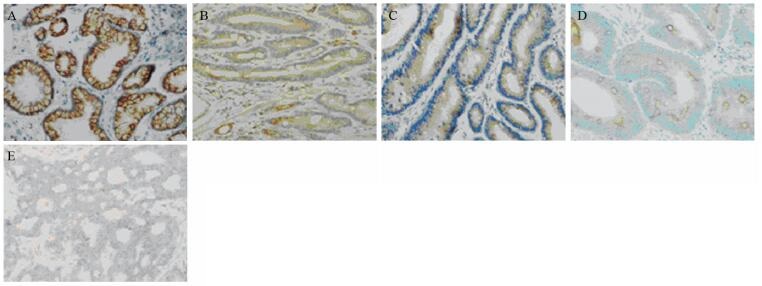
|
| A: normal gastric antrum mucosa; B: reactive hyperplasia; C: low-grade intraepithelial neoplasia; D: high-grade intraepithelial neoplasia; E: early mucosal cancer 图 7 ERGIC1在各组的免疫组织化学染色(IHC ×40) Figure 7 Immunohistochemical staining of ERGIC1 in five groups (IHC ×40) |
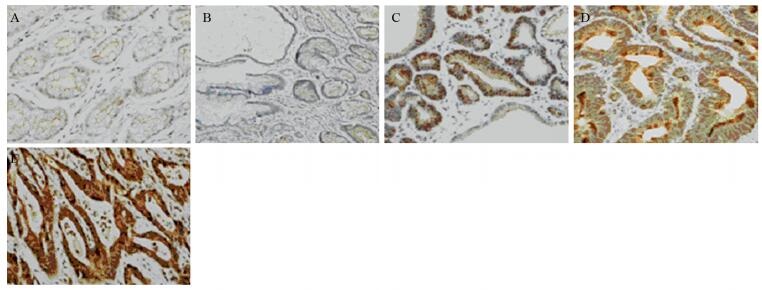
|
| A: normal gastric antrum mucosa; B: reactive hyperplasia; C: low-grade intraepithelial neoplasia; D: high-grade intraepithelial neoplasia; E: early mucosal cancer 图 8 DNA-PKcs在各组的免疫组织化学染色(IHC ×40) Figure 8 Immunohistochemical staining of DNA-PKcs in five groups (IHC ×40) |
内质网是蛋白质折叠、组装的重要场所。任何原因导致的蛋白质没有折叠或错误折叠都无法正常经内质网转运,从而在内质网内异常积聚,引发内质网应激。细胞为了适应这种应激,在进化过程中逐渐形成了高度保守、具有自我保护功能的信号转导通路,又称未折叠蛋白反应(unfold protein response, UPR)。内质网应激和未折叠蛋白反应与许多疾病的发生都有关系,如胃癌、糖尿病、神经退行性疾病和脑缺血等。
内质网蛋白质处理过程与癌症关系密切,与我们的蛋白质组学结果相符。本研究发现,和正常黏膜相比,在反应性增生-低级别上皮内瘤变-高级别上皮内瘤变及黏膜内癌的发展过程中,LAMN1、ERGIC1、UQCRFS1、UQCRH、CISD1这5个蛋白质的表达量逐渐降低,HMGB1、DNA-PKcs、14-3-3表达量逐渐升高。而其中的ERGIC1、DNA-PKcs与内质网功能密切相关,本研究蛋白质组学结果生信分析表明,在癌变过程中,在内质网中有关蛋白质加工途径的蛋白质变化数量最多,表明胃癌癌变过程与内质网中蛋白质的处理过程有密切关系。
目前ERGIC1被认为是一种循环蛋白,在内质网、中间体及高尔基体之间的选择性囊泡转运及内质网的蛋白质分泌过程中起着重要的作用[2]。因此,ERGIC1的表达下降有可能导致内质网的蛋白折叠加工发生异常,结果致使蛋白在内质网异常聚集。研究表明,内质网应激在多种肿瘤中发挥作用[3],包括胃癌。内质网应激能够激活NF-κβ、ROS及JNK等多条信号途径[4],引起慢性炎性反应,最终导致癌症的发生。在本研究中观察到ERGIC1的表达量随着胃癌发生的过程逐渐下降。因此,本研究认为ERGIC1在胃癌发生发展中具有一定的作用。
DNA-PKcs在非同源末端连接(non-homologous end joining, NHEJ)途径的激活中发挥着重要作用[5-6],当细胞发出DNA损伤信号后,DNA-PKcs能够识别并启动损伤反应,Ku70/80会连接到损伤的DNA的末端,诱导DNA-PKcs变为DNA-PK,激发非同源末端连接修复反应[7],NHEJ过度激活可以调节细胞周期停滞、细胞调亡、染色体重组和基因组的不稳定性,与肿瘤的发生密切相关[8]。本研究发现DNA-PKcs在胃癌组织中表达上调,并且与胃癌的进展密切相关。此外,本研究还发现DNA-PKcs在胃癌发生过程的不同阶段逐渐增高,因此DNA-PKcs的过表达可能与胃癌的发生有关。然而,除可能异常激活NHEJ途径,DNA-PKcs表达异常在胃癌发生发展中具体作用机制尚未阐明,因此未来研究应对此进一步探究。
14-3-3蛋白[9]主要通过识别并结合磷酸化的苏氨酸和丝氨酸而参与细胞凋亡、分裂以及信号通路转导、跨膜转运等在内的很多细胞生命活动调节过程,并与肿瘤的生长、侵袭、转移等生命活动有关。近年来有研究表明14-3-3蛋白在肿瘤(包括胃癌)的发生发展过程中起重要的作用,与控制器官大小的Hippo信号通路有关[10],其作用机制尚待进一步阐明。
另外,根据我们的蛋白质组学结果,除了内质网中蛋白质加工途径,蛋白质差异表达明显的为氧化磷酸化通路,有21个蛋白质参与这条途径,本研究发现的差异显著的8个蛋白中的UQCRFS及UQRCH均为氧化磷酸化相关的蛋白质,相关文献报道均较少,UQCRFS1与乳腺癌、胃癌及急性淋巴细胞淋巴瘤相关,在相关组织中表达均是升高的,均为癌基因[11],锌指蛋白331(ZNF331)被鉴定为肿瘤抑制基因,ZNF331的10个下游靶标被鉴定为与细胞生长和转移的调节相关。UQRCH在乳腺癌中部分报道为癌基因[12],部分为抑癌基因[13],而蛋白质组学结果显示胃癌中二者的表达均是降低的。CISD为格列酮结合为主的线粒体膜外蛋白,据报道在乳腺中为代谢性癌基因,与胃癌的关系尚不明确[14],本结果中,CISD在胃癌中低表达,值得进一步研究其临床相关性及生物学功能。
近几年来,运用蛋白质组学的各种质谱方法,研究癌症标志物的研究很多。Jiang等[15]选取胃癌及癌旁正常组织,采用相对定性定量的同位素标记的蛋白质组学(iTRAQ)联合液相色谱-电喷射离子化串联质谱技术,从胃癌组织中检测差异表达蛋白质,研究结果显示FABP1及FASN共同表达可以作为早期发现胃癌的分子标志物。
综上所述,本研究中发现的LAMN1、ERGIC1、UQCRFS1、UQCRH、CISD1、HMGB1、DNA-PKcs和14-3-3这8个差异蛋白在胃癌发生过程中具有重要的意义,这些差异蛋白具有成为胃癌早期诊断及靶向分子治疗标志物的潜能。
| [1] | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention[J]. Cancer Res, 1992, 52(24): 6735–40. |
| [2] | Lieber MR, Gu J, Lu H, et al. Nonhomologous DNA end joining (NHEJ) and chromosomal translocations in humans[J]. Subcell Biochem, 2010, 50: 279–96. DOI:10.1007/978-90-481-3471-7 |
| [3] | Chapman JR, Taylor MR, Boulton SJ. Playing the end game: DNA double-strand break repair pathway choice[J]. Mol Cell, 2012, 47(4): 497–510. DOI:10.1016/j.molcel.2012.07.029 |
| [4] | Iurlaro R, Muñoz-Pinedo C. Cell death induced by endoplasmic reticulum stress[J]. FEBS J, 2016, 283(14): 2640–52. DOI:10.1111/febs.13598 |
| [5] | Lu M, Lawrence DA, Marsters S, et al. Opposing unfolded-protein-response signals converge on death receptor 5 to control apoptosis[J]. Science, 2014, 345(6192): 98–101. DOI:10.1126/science.1254312 |
| [6] | Xue H, Lu J, Yuan R, et al. Knockdown of CLIC4 enhances ATP-induced HN4 cell apoptosis through mitochondrial and endoplasmic reticulum pathways[J]. Cell Biosci, 2016, 6: 5. DOI:10.1186/s13578-016-0070-1 |
| [7] | Lei Y, Henderson BR, Emmanuel C, et al. Inhibition of ANKRD1 sensitizes human ovarian cancer cells to endoplasmic reticulum stress-induced apoptosis[J]. Oncogene, 2015, 34(4): 485–95. DOI:10.1038/onc.2013.566 |
| [8] | Logue SE, Cleary P, Saveljeva S, et al. New directions in ER stress-induced cell death[J]. Apoptosis, 2013, 18(5): 537–46. DOI:10.1007/s10495-013-0818-6 |
| [9] | Qing Y, Sun L, Yang C, et al. Dysregulated 14-3-3 Family in Peripheral Blood Leukocytes of Patients with Schizophrenia[J]. Sci Rep, 2016, 6: 23791. DOI:10.1038/srep23791 |
| [10] | Liu XX, Ye H, Wang P, et al. Identification of 14-3-3ζ as a potential biomarker in gastric cancer by proteomics-based analysis[J]. Mol Med Rep, 2017, 16(5): 7759–65. DOI:10.3892/mmr.2017.7496 |
| [11] | Yu J, Liang QY, Wang J, et al. Zinc-finger protein 331, a novel putative tumor suppressor suppresses growth and invasiveness of gastric cancer[J]. Oncogene, 2013, 32(3): 307–17. DOI:10.1038/onc.2012.54 |
| [12] | Lu H, Yang Y, Allister EM, et al. The identification of potential factors associated with the development of type 2 diabetes: a quantitative proteomics approach[J]. Mol Cell Proteomics, 2008, 7(8): 1434–51. DOI:10.1074/mcp.M700478-MCP200 |
| [13] | Modena P, Testi MA, Facchinetti F, et al. UQCRH gene encoding mitochondrial Hinge protein is interrupted by a translocation in a soft-tissue sarcoma and epigenetically inactivated in some cancer cell lines[J]. Oncogene, 2003, 22(29): 4586–93. DOI:10.1038/sj.onc.1206472 |
| [14] | Bai F, Morcos F, Sohn YS, et al. The Fe-S cluster-containing NEET proteins mitoNEET and NAF-1 as chemotherapeutic targets in breast cancer[J]. Proc Natl Acad Sci U S A, 2015, 112(12): 3698–703. |
| [15] | Jiang Z, Shen H, Tang B, et al. Quantitative proteomic analysis reveals that proteins required for fatty acid metabolism may serve as diagnostic markers for gastric cancer[J]. Clin Chim Acta, 2017, 464: 148–54. DOI:10.1016/j.cca.2016.11.032 |
 2018, Vol. 45
2018, Vol. 45




