文章信息
- 自噬在视网膜母细胞瘤Y79细胞顺铂耐药中的作用及其机制
- Role of Autophagy in Cisplatin Resistance of Retinoblastoma Y79 Cells and Its Mechanism
- 肿瘤防治研究, 2018, 45(8): 517-522
- Cancer Research on Prevention and Treatment, 2018, 45(8): 517-522
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1438
- 收稿日期: 2017-11-15
- 修回日期: 2018-03-01
视网膜母细胞瘤(retinoblastoma, Rb)是源于光感受器前体细胞的肿瘤,是一种婴幼儿时期恶性程度很高的眼底肿瘤[1]。在我国患儿的生存率约65%[2],远低于发达国家的95%[3]。虽然近年来发展了激光光凝治疗、经瞳孔温热疗法、冷冻疗法、选择性动脉灌注化疗、光动力疗法、巩膜敷贴器放疗等辅佐性治疗等多种疗法[4],然而前主要的治疗方法仍是手术摘除眼球和术后铂类制剂化疗[5]。但大多数患儿对化疗不敏感,预后较差,远期生存率低[6-7]。因此,寻找视网膜母细胞瘤对顺铂耐药的靶点及机制尤为重要。本文将通过细胞实验研究顺铂诱导的自噬对视网膜母细胞瘤细胞耐药的作用和机制。
1 材料与方法 1.1 试剂和仪器顺铂纯品(深圳豪地华拓生物, 中国),1640培养液、胎牛血清(Gibco, 澳州),CCK-8细胞增殖及细胞毒性检测试剂盒(Beyotime, 中国),3-Methyladenine(Selleck, 美国),Annexin V-FICT/PI双染细胞凋亡检测试剂盒(Sigma, 美国),MDC试剂盒(南京凯基生物, 中国),RNA提取试剂盒(Sigma, 美国),SYBR Green qPCR试剂盒(Thermo, 美国),反转录试剂盒(Fermentas, 立陶宛),DL2000 DNA Marker(TINGEN, 中国),Fluo-4 AM钙离子荧光探针(Solarbio)抗体(Abcam, 德国)。酶标仪(Thermo MULTISKAN MK3, 美国)、流式细胞仪(BD Biosciences FACSCalibur, 美国)等。
1.2 细胞培养视网膜母细胞瘤Y79细胞购自豪地华拓生物。细胞置于37℃、5%CO2及饱和湿度条件的恒温培养箱中,用含有10%胎牛血清的1640培养液培养。每2天更换1次培养液,取对数生长期的细胞进行实验。
1.3 CCK-8法测定细胞顺铂IC50取处于对数生长期,生长状态良好的Y79细胞,胰蛋白酶消化成细胞悬液,调整细胞密度为5×104个每毫升接入96孔板,每孔100 µl细胞悬液,同时设空白对照(96孔板周围加入PBS),37℃、5%CO2培养箱中培养过夜后加入顺铂培养(浓度为0、1、5、10、20 μmol/L)处理细胞培养48 h,每孔加入10 µl CCK-8,孵育4 h,酶标仪测定各孔吸光值OD450,计算得出IC50。
1.4 细胞分组及处理Y79细胞进行如下分组:Y79对照组,正常培养;Cis组,Y79细胞加入Cis(终浓度为1.5 μmol/L)培养;Cis+3-MA组,Y79细胞加入5 μmol/L 3-MA预处理1 h,PBS漂洗后加入Cis(终浓度为1.5 μmol/L)培养,按上述分组处理培养48 h。
1.4.1 MDC染色法测定自噬水平细胞密度为2×105个每毫升接入6孔板,按上述分组处理细胞后,根据MDC染色试剂盒说明,加入终浓度为0.05 mmol/L的MDC,37℃温育1 h,用流式细胞仪355波长检测。
1.4.2 透射电子显微镜观察自噬小体消化离心细胞用2.5%的戊二醛0.1 mol/L磷酸缓冲液4℃固定2~4 h,0.1 mol/L磷酸缓冲液漂洗3次,每次15 min,1%的锇酸0.1 mol/L磷酸缓冲液室温固定2 h,0.1 mol/L磷酸缓冲液(pH7.4)漂洗3次,每次15 min,脱水、渗透、包埋切片后铀铅双染色(2%醋酸铀饱和水溶液,枸橼酸铅,各染色15 min),切片室温干燥过夜,电子显微镜观察自噬小体。
1.4.3 CCK-8法测定细胞顺铂抑制率细胞密度为5×104个每毫升接入96孔板,每孔100 µl细胞悬液,按上述分组处理细胞,每组4个复孔,培养48 h,每孔加入10 µl CCK-8,孵育4 h,酶标仪测定各孔吸光值OD450,绘制抑制率曲线。
1.4.4 Annexin V-FITC/PI双染法检测各组细胞凋亡率用不含EDTA的0.25%胰酶消化细胞,终止消化后收集细胞,1 500 r/min,5 min离心,去上清液,加PBS重悬;用PBS将细胞润洗2次,1 500 r/min 5 min,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒操作说明进行:加入500 μl Binding Buffer,重悬细胞;5 μl AnnexinV-FITC混匀后加入5 μl PI,混匀;室温避光反应5~15 min,同时设阴性对照,即正常细胞不加Annexin和PI,流式细胞仪上机检测。
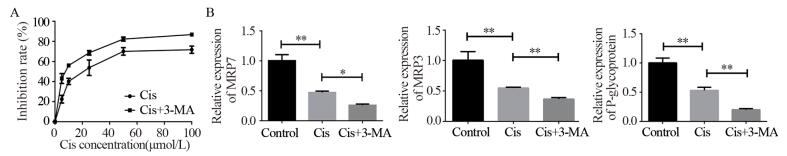
1.4.5 q-PCR法检测各组细胞凋亡和多耐药基因表达收集各组细胞,用PBS吹洗2次,离心后按照RNA提取试剂盒剂说明书提取RNA,用紫外分光光度计测定RNA的纯度和浓度。根据反转录试剂盒说明书进行反转录,利用SYBR Green qPCR试剂盒配置反应体系,并分别加入1 μl β-actin和1 μl cDNA点样,每个样本的每个基因保证3个复孔,在MX3000P实时荧光定量PCR仪进行q-PCR反应,结果数据采用2-ΔΔCt法进行分析,q-PCR引物序列,见表 1。
细胞密度为2×105个每毫升接入激光共聚焦小皿,按上述分组处理细胞后,根据说明书加入10 μmol/L Fluo-4 AM,避光孵育30 min,用无钙缓冲液冲洗PBS反复离心洗涤2次,激光共聚焦显微镜观察。
1.4.7 Western blot检测各组细胞CaMKK2、p-AMPK、mTORC1、LC3Ⅱ的表达每组细胞加400 μl含PMSF的裂解液,提取总蛋白;BCA法检测蛋白浓度;各组取总蛋白40 μg进行SDS-PAGE凝胶电泳;转膜;用含5%脱脂奶粉的TBST封闭2 h。封闭液稀释一抗,4℃孵育过夜;用封闭液稀释HRP标记二抗,37℃摇床孵育2 h;洗膜;ECL显色系统显色,用BandScan分析胶片灰度值。
1.5 统计学方法采用SPSS21.0统计软件进行数据分析,所有数据以均值±标准差(x±s)表示,不同组间两两比较采用单因素方差分析(One-way ANOVA)中的LSD法(最小显著性法),P < 0.05为差异有统计学意义。
2 结果 2.1 视网膜母细胞瘤Y79细胞IC50测定顺铂浓度为0、1、5、10、20 μmol/L时,对细胞的抑制率分别为0、20.19%、32.90%、41.35%、64.34%,计算后得出IC50浓度为13.99(±1.05)μmol/L,后续实验加入顺铂浓度为14 μmol/L。
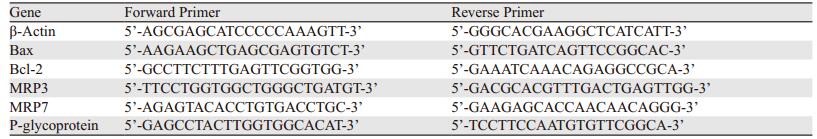
2.2 顺铂对视网膜母细胞瘤Y79细胞自噬的影响顺铂对视网膜母细胞瘤Y79细胞自噬的影响,见图 1。顺铂处理细胞后,透射电子显微镜观察到双层或多层膜的球状结构的自噬小体明显增多,应用自噬阻断剂3-MA后,自噬小体数量减少。Western blot结果灰度值计算:Control组LC3Ⅱ/LC3Ⅰ的值为0.29(±0.03)、Cis组为0.53(±0.06)、Cis+3-MA组为0.39(±0.05),Cis组与Control组比较,Cis+3-MA组与Cis组比较差异均有统计学意义(P=0.01, P=0.04)。MDC染色流式细胞仪测定OD355:Cis组OD值明显大于Control组,应用自噬阻断剂后,OD值下降。
|
| *: P < 0.05, **: P < 0.01; A: electronic micrographs of autophagosome in Y79 cells; B: LC3II expression in each group; C: the OD values of MDC in each group 图 1 顺铂诱导视网膜母细胞瘤Y79细胞发生自噬 Figure 1 Cisplatin induced autophagy in retinoblastoma Y79 cells |
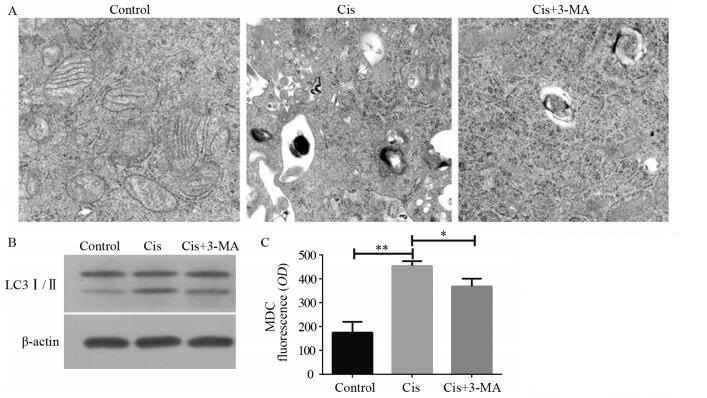
顺铂诱导的自噬对视网膜母细胞瘤细胞凋亡的影响见图 2。凋亡结果显示,Cis组凋亡率为(18.51±1.54)%,Cis+3-MA组凋亡率上升为(25.94±0.92)%,两组比较差异有统计学意义(P=0.01)。q-PCR法检测各组细胞凋亡抑制基因Bcl-2与促凋亡基因Bax结果显示,与Cis组比较,Cis+3-MA组Bcl-2转录水平明显下调(P=0.002),Bax明显上调(P=0.036)。
|
| *: P<0.05, **: P<0.01 图 2 顺铂诱导的自噬对Y79细胞凋亡的影响 Figure 2 Cisplatin-induced autophagy inhibited Y79 cells apoptosis |
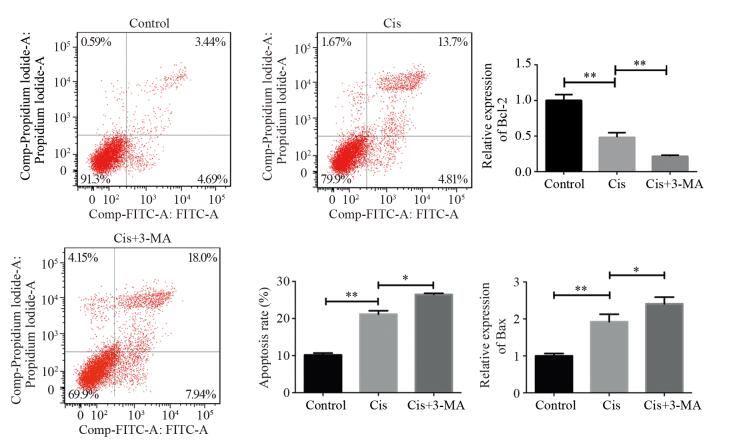
自噬对网膜母细胞瘤细胞耐药的影响,见图 3。应用自噬阻断剂3-MA预处理细胞后,各浓度点顺铂抑制率均大于单独应用顺铂处理的细胞。q-PCR法检测各组细胞耐药相关基因MRP3(P=0.001)、MRP7(P=0.001)和P-glycoprotein(P=0.005),结果显示与Cis组比较,Cis+3-MA组各个耐药基因转录水平都明显下调。
|
| *: P < 0.05, **: P < 0.01; A: effects of autophagy on cisplatin inhibition rate; B: the expression levels of MRPs and P-glycoprotein in each group 图 3 顺铂诱导的自噬对Y79细胞耐药的影响 Figure 3 Cisplatin-induced autophagy caused multidrug resistance in Y79 cells |
顺铂对钙离子激活AMPK/mTORC1通路的影响见图 4。Fluo-4 AM钙离子探针染色激光共聚焦显微镜观察结果显示,顺铂处理肿瘤细胞后,细胞内钙离子荧光明显高于对照组。Western blot结果显示,与Control组比较,Cis组钙调素依赖的蛋白激酶激酶2(CaMKK2)(P=0.001)、p-AMPK(P=0.003)、LC3Ⅱ(P=0.003)明显上调,mTORC1(P=0.02)下调。
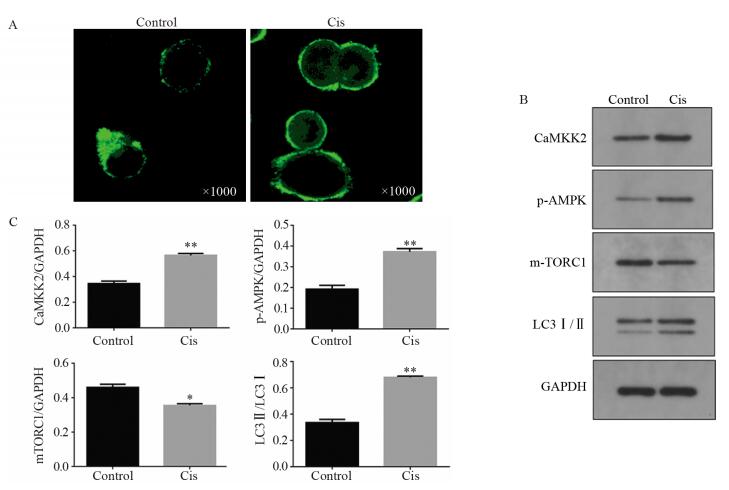
|
| A: the fluorescence expression of calcium of each group; B: the expression of AMPK/mTORC1-related proteins CAMKK2, p-AMPK, mTORC1 and LC3Ⅰ/Ⅱ; C: the relative expression levels of CAMKK2, p-AMPK, mTORC1 and LC3Ⅰ/Ⅱ; *: P < 0.05; **: P < 0.01, compared with control group 图 4 顺铂对钙调AMPK/mTORC1通路相关蛋白的影响 Figure 4 Effect of cisplatin on calmodulin- related proteins of AMPK/mTORC1 pathway |
自噬(autophagy)是细胞通过溶酶体降解内源性底物的重要过程, 具有高度的进化保守性。自噬在营养缺乏、低氧应激和药物诱导时出现, 对细胞自我更新和内环境稳态的维持起重要作用。自噬高度依赖于细胞种类、所处的环境和强度以及持续时间。在维持细胞内外环境稳定中,自噬可形成自噬性死亡,而在应激的情况下,可形成自噬性保护作用。同样,化疗诱导肿瘤细胞的自噬也具有这两种作用:不同抗肿瘤化疗可诱导肿瘤细胞的自噬依赖性死亡抑或自噬作为肿瘤细胞的存活机制而对化疗产生抵抗[8-9]。最近研究已表明自噬在肺癌、卵巢癌、结肠癌、胃癌等多种肿瘤细胞参与化疗耐受[10-13],但顺铂诱导视网膜母细胞瘤自噬的作用却鲜有报道。
本研究结果表明,顺铂可以诱导视网膜母细胞瘤Y79细胞发生自噬,运用自噬阻断剂3-MA后,顺铂诱导产生的自噬水平明显下降,对肿瘤细胞的抑制率提高,诱导凋亡作用增强,敏感度增加。当自噬阻断剂与顺铂联合应用时,凋亡通路的促凋亡基因Bcl-2转录水平上调,抑凋亡基因Bax上调,这可能是由于肿瘤细胞在受到化疗药物作用后,虽然很快发生了线粒体膜电位的损伤,但并没有激活明显的内源性凋亡发生,而是发生了自噬,损伤的线粒体很快被自噬清除,以至于没有足够的细胞色素c释放以激活下游的凋亡通路,从而抑制了细胞死亡[14]。我们还观察到,抑制自噬后,肿瘤多耐药相关蛋白(MRPs)基因MRP3、MRP7和P-糖蛋白(P-glycoprotein, P-gp)受到抑制,P-gp和MRPs主要是作为药物排出泵, 导致细胞内的化疗药物浓度降低, 使肿瘤细胞对多种抗肿瘤药物产生耐药[15]。这说明自噬参与了视网膜母细胞瘤细胞的耐药,在顺铂化疗的过程中降低了其对细胞诱导凋亡的作用,对细胞起保护作用。
为了探究顺铂诱导Y79细胞自噬的机制,我们做了进一步探究。有文献报道,化疗药物可以引起质膜上肌醇三磷酸(IP3)的水平增高,促使内质网释放Ca2+,增加细胞内钙离子浓度[16],我们的钙离子探针实验在Y79细胞中也证明了这一点。Western blot结果得出,顺铂处理Y79细胞后,CaMKK2表达上调,AMPK磷酸化水平上调,mTORC1表达下调。CaMKK2是重要的钙调激酶,Ca2+作为第二信使,可以激活CaMKK2,促使其下游的AMPK磷酸化。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是调节自噬水平的中心分子,激活的mTORC1可以抑制自噬起始分子ULK1,抑制自噬的发生。而AMPK磷酸化可以抑制mTORC1的表达,促进自噬标志蛋白LC3Ⅰ转化为LC3Ⅱ[17],加强了自噬小泡的形成,从而上调自噬水平。由此推测,顺铂作用的Y79细胞可能是激发内质网Ca2+释放,释放的钙离子激活了钙调蛋白,触发下游AMPK通路从而产生了自噬。
综上所述,顺铂可能是通过钙离子激活CaMKK2/AMPK/mTORC1通路诱导Y79细胞自噬,这种自噬参与了肿瘤细胞的耐药,在化疗过程中对细胞起保护作用。这为临床提高视网膜母细胞瘤顺铂化敏感度提供了新的思路和理论基础。
| [1] | Rodriguez-Galindo C, Orbach DB, Vanderveen D. Retinoblastoma[J]. Pediatric Clin North Am, 2015, 62(1): 201–23. DOI:10.1016/j.pcl.2014.09.014 |
| [2] | Canturk S, Qaddoumi I, Khetan V, et al. Survival of retinoblastoma in less-developed countries impact of socioeconomic and health-related indicators[J]. Br J Ophthalmol, 2010, 94(11): 1432–6. DOI:10.1136/bjo.2009.168062 |
| [3] | Ford JS, Chou JF, Sklar CA, et al. Psychosocial Outcomes in Adult Survivors of Retinoblastoma[J]. J Clin Oncol, 2015, 33(31): 3608–14. DOI:10.1200/JCO.2014.60.5733 |
| [4] | 陆烨, 童剑萍. 视网膜母细胞瘤的发生机制及诊断和治疗进展[J]. 现代肿瘤医学, 2016, 24(6): 1077–14. [ Lu Y, Tong JP. The pathogenesis, diagnosis and treatment of retinoblastoma[J]. Xian Dai Zhong Liu Yi Xue, 2016, 24(6): 1077–14. ] |
| [5] | Honavar SG, Manjandavida FP, Reddy VAP. Orbital retinoblastoma: An update[J]. Indian J Ophthalmol, 2017, 65(6): 435–42. DOI:10.4103/ijo.IJO_352_15 |
| [6] | Chawla B, Singh R. Recent advances and challenges in the management of retinoblastoma[J]. Indian J Ophthalmol, 2017, 65(2): 133–9. DOI:10.4103/ijo.IJO_883_16 |
| [7] | Liu X, Sun K, Wang H, et al. Knockdown of retinoblastoma protein may sensitize glioma cells to cisplatin through inhibition of autophagy[J]. Neurosci Lett, 2016, 620: 137–42. DOI:10.1016/j.neulet.2016.04.001 |
| [8] | Dikic I, Johansen T, Kirkin V. Selective autophagy in cancer development and therapy[J]. Cancer Res, 2010, 70(9): 3431–4. DOI:10.1158/0008-5472.CAN-09-4027 |
| [9] | Li YJ, Lei YH, Yao N, et al. Autophagy and multidrug resistance in cancer[J]. Chin J Cancer, 2017, 36(1): 52. DOI:10.1186/s40880-017-0219-2 |
| [10] | Fu W, Li X, Lu X, et al. A novel acridine derivative, LS-1-10 inhibits autophagic degradation and triggers apoptosis in colon cancer cells[J]. Cell Death Dis, 2017, 8(10): e3086. DOI:10.1038/cddis.2017.498 |
| [11] | Pagotto A, Pilotto G, Mazzoldi EL, et al. Autophagy inhibition reduces chemoresistance and tumorigenic potential of human ovarian cancer stem cells[J]. Cell Death Dis, 2017, 8(7): e2943. DOI:10.1038/cddis.2017.327 |
| [12] | Wei F, Jiang X, Gao HY, et al. Liquiritin induces apoptosis and autophagy in cisplatin (DDP)-resistant gastric cancer cells in vitro and xenograft nude mice in vivo[J]. Int J Oncol, 2017, 51(5): 1383–94. DOI:10.3892/ijo.2017.4134 |
| [13] | Yang X, Bai F, Xu Y, et al. Intensified Beclin-1 Mediated by Low Expression of Mir-30a-5p Promotes Chemoresistance in Human Small Cell Lung Cancer[J]. Cell Physiol Biochem, 2017, 43(3): 1126–39. DOI:10.1159/000481754 |
| [14] | Sun WL, Chen J, Wang YP, et al. Autophagy protects breast cancer cells from epirubicin-induced apoptosis and facilitates epirubicin-resistance development[J]. Autophagy, 2014, 7(9): 1035–44. |
| [15] | Poźniak B, Pawlak A, Obmińska-Mrukowicz B. Flow cytometric assessment of P-glycoprotein and multidrug resistance-associated protein activity and expression in canine lymphoma[J]. In vivo, 2015, 29(1): 149–53. |
| [16] | Filippi-Chiela EC, Viegas MS, Thomé MP, et al. Modulation of Autophagy by Calcium Signalosome in Human Disease[J]. Mol Pharmacol, 2016, 90(3): 371–84. DOI:10.1124/mol.116.105171 |
| [17] | Hoxhaj G, Hughes-Hallett J, Timson RC, et al. The mTORC1 Signaling Network Senses Changes in Cellular Purine Nucleotide Levels[J]. Cell Re, 2017, 21(5): 1331–46. DOI:10.1016/j.celrep.2017.10.029 |
 2018, Vol. 45
2018, Vol. 45