文章信息
- TIP方案一线治疗晚期中高危睾丸生殖细胞肿瘤的回顾性分析
- Efficacy and Safety of Paclitaxel, Ifosfamide and Cisplatin as First-line Treatment on Patients with Intermediate- or Poor-risk Advanced Testicular Cancer
- 肿瘤防治研究, 2018, 45(6): 400-403
- Cancer Research on Prevention and Treatment, 2018, 45(6): 400-403
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1417
- 收稿日期: 2017-11-09
- 修回日期: 2018-01-17
生殖细胞肿瘤(germ cell tumors, GCT)是15~35岁男性中最常见的实体肿瘤,多发生于睾丸或腹膜后。20世纪70年代以铂类为基础的联合化疗大大改善了转移性生殖细胞肿瘤的预后,使其成为可治愈的实体肿瘤。BEP(博来霉素+依托泊苷+顺铂)或EP(依托泊苷+顺铂)方案是目前转移性睾丸癌常用的诱导化疗方案,然而仍有20%~30%的患者出现疾病进展或复发[1],主要集中在晚期(TNM分期为Ⅲ期)患者。国际生殖细胞癌协作组根据肿瘤原发部位、内脏转移情况、肿瘤标志物水平等将睾丸癌的预后划分为低危、中危及高危三组[2]。故有必要探索新的治疗方案以进一步提高晚期中高危睾丸癌患者的预后。
紫杉醇、异环磷酰胺和顺铂(TIP)的联合方案既往被用于睾丸原发生殖细胞肿瘤经治后复发的二线治疗,优于传统的挽救化疗方案(例如依托泊苷、异环磷酰胺联合顺铂或长春碱、异环磷酰胺联合顺铂[3])。因此可以考虑将TIP方案试用于晚期睾丸癌的一线治疗。本研究回顾性分析了我中心一线应用TIP方案治疗晚期中高危睾丸生殖细胞肿瘤患者的疗效和安全性,以期为临床治疗和后续研究提供指导和帮助。
1 资料与方法 1.1 研究对象选取2009年11月1日至2017年1月31日北京大学肿瘤医院暨北京市肿瘤防治研究所肾癌黑色素瘤内科收治的晚期中高危男性睾丸生殖细胞肿瘤患者,一线给予TIP方案治疗。入组标准:(1)病理经我院会诊符合生殖细胞肿瘤,包括精原细胞瘤、非精原细胞瘤(胚胎癌、畸胎瘤、卵黄囊瘤、绒癌等)以及混合成分;(2)按照第七版AJCC分期为Ⅲ期、国际生殖细胞癌协作组(IGCCCG)危险分层为中高危;(3)良好的脏器功能。排除标准:(1)既往接受过一线方案化疗;(2)对紫杉醇过敏,不能应用该方案进行治疗。
共20例患者符合以上条件入组本研究,平均年龄30.6岁,范围17~52岁。所有患者均为男性。病理为精原细胞瘤的患者有3例,非精原细胞瘤3例(均为胚胎性癌),其余14例为混合性生殖细胞肿瘤,大部分含有胚胎性癌成分,其余成分包含精原细胞瘤、畸胎瘤、卵黄囊瘤、绒癌等。原发于睾丸者18例,其余2例原发于腹膜后。所有患者治疗前均存在远处转移,最常见的转移部位为肺(13例,65%),其次为腹盆腔(10例,50%)和远处淋巴结(5例,25%),晚期病例可见肝、脑转移(各1例),部分患者肿瘤侵及肠管、输尿管,另外可见腹直肌及腰大肌等其他部位转移(共5例)。AFP(α-fetoprotein)阳性13例,β-HCG(human chorionic gonadotropin)阳性9例,LDH(lactate dehydrogenase)阳性9例,标志物阳性共19例。按国际生殖细胞癌协作组(International Germ Cell Cancer Collaborative Group, IGCCCG)的标准进行预后分组,有11例患者属于中危,9例患者属于高危,接受术后辅助治疗者2例。
1.2 治疗方案TIP方案:紫杉醇175 mg/m2, d1,异环磷酰胺1.4 g/m2, d2~4,顺铂25 mg/m2, d2~4,同时给予美司钠预防出血性膀胱炎,每28天为一周期。直至肿瘤评效进展或不能耐受不良反应或治疗满6周期。
1.3 疗效及不良反应评估所有患者基线进行胸腹盆腔CT检查,根据患者症状及临床体征进行必要的其他部位检查(头CT/MRI、骨扫描等),并每周期监测血清肿瘤标志物AFP、β-HCG以及LDH。疗效评定应用RECIST1.1标准,对于生殖细胞肿瘤需结合血清标志物水平进行评定。完全缓解(CR)定义为影像学病灶消失,且血清标志物正常,也包括残留病灶手术完全切除的病例。部分缓解(PR)定义为影像学部分缓解且血清标志物正常。CR和PR的病例被视为客观有效。此外还包括按照RECIST标准评效为疾病稳定(SD)和进展(PD)的病例。所有患者的不良反应应用NCT-CTCAE 4.0标准进行评估。
1.4 随访及统计学方法采用查阅患者的住院及门诊病历获取临床资料,电话随访获得患者的无进展生存期(PFS)和总生存期(OS)。统计分析应用SPSS 22.0软件,以Kaplan-Meier法进行生存分析,并进行Log rank检验,单因素分析影响预后的因素。
2 结果 2.1 临床疗效20例患者平均接受了4.25周期的TIP方案治疗。20例患者均参与疗效评价,其中6例(30%)患者获得CR(complete response),7例(35%)PR(partial response),6例SD(30%),1例(5%)高危患者出现进展(progressive disease, PD),客观有效率(objective response rate, ORR)为65%。
末次随访日期截至2017年10月31日,中位随访时间25月(7~96月)。3例患者化疗后接受了手术,其中1例患者术后继续接受2周期的TIP方案辅助化疗。1例患者对残留病灶进行了放疗。2例患者既往术后接受过辅助治疗,复发转移后接受了TIP方案化疗。至随访结束,有3例患者因肿瘤进展死亡。2年的无进展生存率(PFS)为72.9%(95%CI: 62.5%~83.3%),其中中危患者为90%(95%CI: 80.5%~99.5%)、高危患者为50.8%(95%CI: 33.1%~68.5%),见图 1。2年的总生存(OS)率为89.1%(95%CI, 81.8%~96.4%),其中中危患者为100%,高危患者为74.1%(58.0%~90.2%),见图 2。单因素分析显示,不同年龄(按 < 35岁和≥35岁划分)、病理类型之间预后无统计学差异(P=0.785和0.670),既往接受过辅助治疗者预后更差(P=0.001),IGCCCG危险分层为高危组的PFS(P=0.056)及OS(P=0.028)更短。
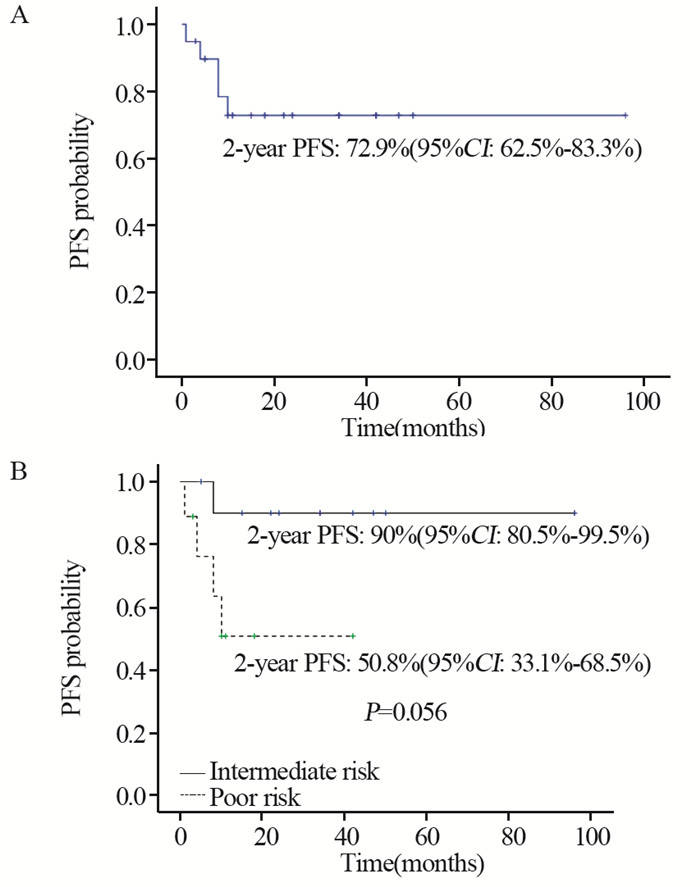
|
| PFS: progression-free survival; IGCCCG: International Germ Cell Cancer Collaborative Group 图 1 所有男性睾丸生殖细胞肿瘤患者的PFS曲线(A)和按IGCCCG危险分组的PFS曲线(B) Figure 1 Progression-free survival curves of entire group (A) and stratified by IGCCCG risk group (B) |
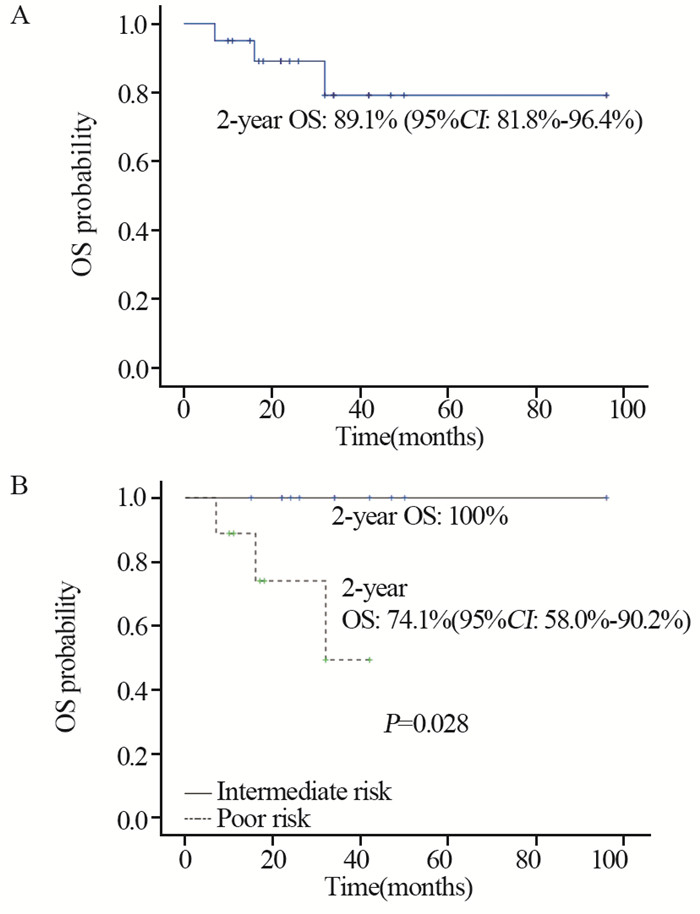
|
| OS: Overall survival 图 2 所有男性睾丸生殖细胞肿瘤患者的OS曲线(A)和按IGCCCG危险分组的OS曲线(B) Figure 2 Overall survival curves of entire group(A) and stratified by IGCCCG risk group (B) |
血液学毒性为最常见的不良反应,并未发生粒细胞缺乏性发热,4例患者因血液学毒性延期治疗,及时给予粒细胞集落刺激因子支持治疗,延期时间均不超过1周。无治疗相关死亡事件发生,其余常见不良反应见表 1。

|
睾丸生殖细胞肿瘤对化疗敏感,以顺铂为基础的联合化疗在睾丸癌中取得了良好的疗效。目前普遍方案是低危患者给予3周期BEP或4周期EP方案化疗,中高危患者给予4周期BEP方案治疗。睾丸癌治疗目标是治愈,早期低危患者选用低毒方案就能取得良好的效果,而晚期中高危患者采用经典方案治疗效果差强人意,仍有20%~30%的患者会出现转移或复发。为了进一步提高治疗效果,多个中心进行了一系列临床研究,主要方向包括提高已有方案的化疗剂量、高剂量化疗后联合干细胞移植,以及应用挽救化疗情况下已经证实具有疗效的药物等等,很多探索并未证实比BEP方案更优选[4-6]。
我们选择了二线治疗方案中疗效较高的TIP方案试用于一线治疗,选择患者人群为晚期中高危睾丸生殖细胞肿瘤,观察其疗效和安全性。统计分析结果显示,2年的PFS为72.9%,OS为89.1%。根据Hinton等在Cancer发表的论著,应用标准BEP方案2年的PFS为60%,OS为71%[7],本研究较之提高了中高危患者2年的PFS率和OS率。另外一项Ⅲ期研究则按照IGCCCG危险分层报道2年OS,中危患者为83%,高危患者为69%[8],而本研究应用TIP方案进行治疗得出中危患者2年OS率100%,高危患者74.1%的结果也较之有所提高。经过本研究的初步探索发现,TIP方案用于晚期中高危生殖细胞肿瘤的一线治疗延长了患者的2年无进展生存期和总生存期,结果令人鼓舞,为后续进一步研究提供了基础。
不良反应主要集中在血液学毒性和消化道反应。最常见的不良反应是血液学毒性,3~4级中性粒细胞减少的发生率为30%,但没有出现粒细胞缺乏伴发热的病例,及时给予粒细胞集落刺激因子支持治疗,并未造成超过1周的延迟治疗或化疗脱落。随着化疗辅助用药的发展,长效升白制剂的推广应用可以更好的保证化疗安全且按时进行。其他主要的不良反应依次为消化道反应、肝酶升高、神经毒性等,虽然都很常见但均为1~2级,给予相关支持治疗所有不良反应均可控制,并且无治疗相关死亡病例。总体上国人对该方案可以耐受。
Motzer教授团队在斯隆-凯特林纪念癌症中心进行了相似研究,结果2016年发表于JCO杂志[9]。该研究选取中高危进展期生殖细胞肿瘤患者给予TIP方案一线治疗,进行统计分析的56例患者客观有效率80%,3年PFS率为71.6%。我们的研究与之相比,治疗方案给予的剂量强度低,总体有效率稍低,但3年PFS率(72.9%)高于国外研究,且不良反应发生率明显要低,患者的总体耐受性更好,适于在国内应用。目前头对头对比TIP和经典的BEP方案一线治疗晚期中高危睾丸癌的随机对照研究正在进行中(NCT01873326),相信该研究的结果能为是否可确立TIP作为一线化疗地位提供更多的证据。但欧美人群的结果并不能完全预测亚洲人的反应,经过本研究的探索,初步证实了该方案的有效性和安全性,后续可考虑在国内进行进一步的大样本研究。
文献报道,睾丸癌预后与肺外器官的转移、血清标志物水平、有无绒癌成分等因素相关[10]。本文预后分析显示,综合了上述因素的IGCCCG危险分层划分的中危和高危患者的生存曲线明显分开,提示该分类方法可以很好的提示预后。本研究还显示,既往接受辅助治疗后出现复发转移的患者预后更差,可能原因为复发后接受一线方案化疗与辅助化疗有部分交叉耐药。但从图中可见,治疗后无进展生存期超过2年的患者以及总生存期超过3年的患者生存曲线不再下降,提示无论初始的IGCCCG风险分层如何,在随后数年都有极大机会存活且无病。这与来自加拿大、美国、澳大利亚的癌症工作者研究转移性睾丸生殖细胞肿瘤患者一线药物治疗后的条件生存结果相一致[11]。
晚期睾丸癌的预后仍有诸多问题需要深入探讨,其背后的生物学行为和分子机制也需要进一步研究。国外有研究对睾丸生殖细胞肿瘤进行全基因组关联分析,找出19个与之相关的危险位点,从遗传学角度揭示不同基因突变对生物学行为的影响[12],未来可能会从基因的层面指导临床实践,为睾丸生殖细胞肿瘤提供精准治疗。
本研究应用TIP方案作为一线化疗对晚期中高危睾丸生殖细胞肿瘤进行治疗,客观缓解率与既往文献报道相当,而2年的无进展生存率和总生存率较前有所提高,不良反应可控,后续可考虑进行更大样本的前瞻性试验进一步研究。
| [1] | Hanna NH, Einhorn LH. Testicular cancer--discoveries and updates[J]. N Engl J Med, 2014, 371(21): 2005–16. DOI:10.1056/NEJMra1407550 |
| [2] | International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group[J]. J Clin Oncol, 1997, 15(2): 594–603. DOI:10.1200/JCO.1997.15.2.594 |
| [3] | Kurobe M, Kawai K, Oikawa T, et al. Paclitaxel, ifosfamide, and cisplatin (TIP) as salvage and consolidation chemotherapy for advanced germ cell tumor[J]. J Cancer Res Clin Oncol, 2015, 141(1): 127–33. DOI:10.1007/s00432-014-1760-x |
| [4] | Daugaard G, Skoneczna I, Aass N, et al. A randomized phase Ⅲ study comparing standard dose BEP with sequential high-dose cisplatin, etoposide, and ifosfamide (VIP) plus stem-cell support in males with poor-prognosis germ-cell cancer. An intergroup study of EORTC, GTCSG, and Grupo Germinal (EORTC 30974)[J]. Ann Oncol, 2011, 22(5): 1054–61. DOI:10.1093/annonc/mdq575 |
| [5] | de Wit R, Skoneczna I, Daugaard G, et al. Randomized Phase Ⅲ Study Comparing Paclitaxel-Bleomycin, Etoposide, and Cisplatin (BEP) to Standard BEP in Intermediate-Prognosis Germ-Cell Cancer: Intergroup Study EORTC 30983[J]. J Clin Oncol, 2012, 30(8): 792–9. DOI:10.1200/JCO.2011.37.0171 |
| [6] | Huddart RA, Gabe R, Cafferty FH, et al. A randomised phase 2 trial of intensive induction chemotherapy (CBOP/BEP) and standard BEP in poor-prognosis germ cell tumours (MRC TE23, CRUK 05/014, ISRCTN 53643604)[J]. Eur Urol, 2015, 67(3): 534–43. DOI:10.1016/j.eururo.2014.06.034 |
| [7] | Hinton S, Catalano PJ, Einhorn LH, et al. Cisplatin, etoposide and either bleomycin or ifosfamide in the treatment of disseminated germ cell tumors: final analysis of an intergroup trial[J]. Cancer, 2003, 97(8): 1869–75. DOI:10.1002/cncr.11271 |
| [8] | Motzer RJ, Nichols CJ, Margolin KA, et al. Phase Ⅲ randomized trial of conventional-dose chemotherapy with or without high-dose chemotherapy and autologous hematopoietic stem-cell rescue as first-line treatment for patients with poor-prognosis metastatic germ cell tumors[J]. J Clin Oncol, 2007, 25(3): 247–56. DOI:10.1200/JCO.2005.05.4528 |
| [9] | Feldman DR, Hu J, Dorff TB, et al. Paclitaxel, Ifosfamide, and Cisplatin Efficacy for First-Line Treatment of Patients With Intermediate- or Poor-Risk Germ Cell Tumors[J]. J Clin Oncol, 2016, 34(21): 2478–83. DOI:10.1200/JCO.2016.66.7899 |
| [10] | Nishikawa M, Miyake H, Muramaki M, et al. Efficacy and tolerability of TIP (paclitaxel, ifosfamide and cisplatin) incorporated into induction chemotherapy for patients with intermediate- or poor-risk metastatic germ cell tumors[J]. Med Oncol, 2014, 31(12): 296. DOI:10.1007/s12032-014-0296-x |
| [11] | Ko JJ, Bernard B, Tran B, et al. Conditional Survival of Patients With Metastatic Testicular Germ Cell Tumors Treated With First-Line Curative Therapy[J]. J Clin Oncol, 2016, 34(7): 714–20. DOI:10.1200/JCO.2015.64.7909 |
| [12] | Litchfield K, Levy M, Orlando G, et al. Identification of 19 new risk loci and potential regulatory mechanisms influencing susceptibility to testicular germ cell tumor[J]. Nat Genet, 2017, 49(7): 1133–40. DOI:10.1038/ng.3896 |
 2018, Vol. 45
2018, Vol. 45


