文章信息
- 前列腺周围脂肪对前列腺癌术前分期和分级的影响
- Influence of Periprostatic Adiposity Measurement Parameters on Preoperative Staging and Grading of Prostate Cancer
- 肿瘤防治研究, 2018, 45(7): 488-491
- Cancer Research on Prevention and Treatment, 2018, 45(7): 488-491
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1382
- 收稿日期: 2017-10-30
- 修回日期: 2018-04-12
2. 266003 青岛,青岛大学附属医院泌尿外科;
3. 200092 上海,上海交通大学附属新华医院泌尿外科
2. Department of Urology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China;
3. Departmentof Urology, Xinhua Hospital Affiliated to Shanghai Jiaotong University School of Medcine, Shanghai 200092, China
前列腺癌的术前分期、分级对前列腺癌治疗方式的选择及预后评估有着重要的临床指导作用,目前研究发现前列腺癌患者术前与术后分期、分级存在低估现象,其中PSA及年龄被认为是危险因素[1-2]。目前,肥胖与前列腺癌发生、进展等相关性研究最为广泛,而前列腺周围脂肪与前列腺癌发生、发展是研究的热点之一。本研究分析前列腺周围脂肪对前列腺癌患者术前与术后分期、分级差异的影响,以便更好地指导临床进行治疗方式的选择及预后评估。
1 资料与方法 1.1 研究对象选取2006年3月至2012年10月间于上海交通大学医学院附属新华医院泌尿外科行前列腺癌根治性切除术的184例局限性前列腺癌患者为研究对象进行回顾性分析,所有患者均于术前行直肠指诊、前列腺直肠超声、前列腺核磁共振成像检查、全身骨扫描检查、胸部X线检查来进行术前前列腺进展的评估及分期、分级;术前均经前列腺穿刺活检术明确诊断,术后切除前列腺标本予以进行病理分期、分级;所有患者均行开放性根治性前列腺切除术,术前均未接受内分泌药物及放射等非手术治疗。
1.2 研究方法 1.2.1 临床基本资料查阅患者病历,收集并记录患者术前年龄、身高、体重、术前PSA、分期、分级(Gleason)、前列腺体积、前列腺移行区体积,术后病理分期、分级等相关资料与数据。
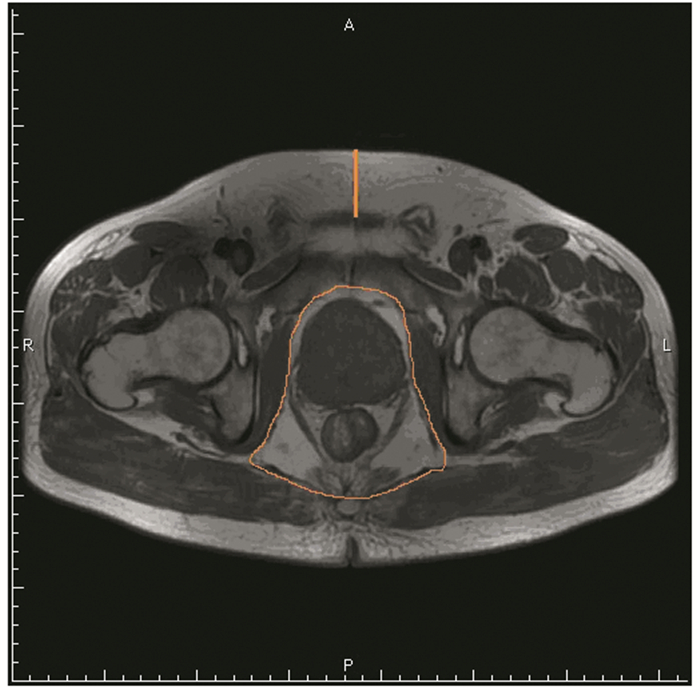
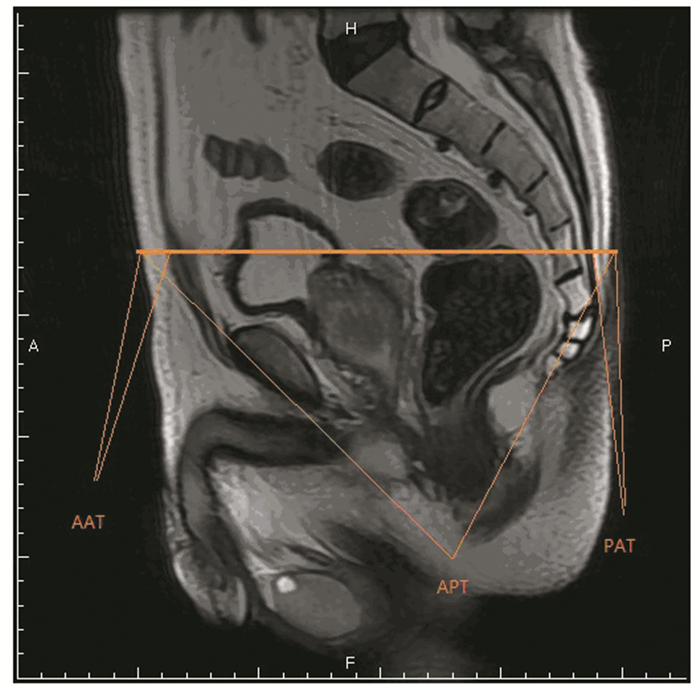
1.2.2 前列腺癌周围脂肪测定(1)体重指数计算。查询患者术前记录体重及身高,根据公式体质量指数(BMI)=体重(kg)/身高2(m2),根据国际健康组织标准设定BMI < 25为正常体重,25~30为超重,BMI≥30为肥胖。(2)应用MRI测定前列腺癌周围脂肪的相关指标。收集184例前列腺癌患者术前前列腺MRI,由一位有经验的磁共振成像诊断高级医师采用盲法进行阅片并测量前列腺癌周围脂肪的相关指标。包括皮下脂肪厚度(SFT)、前列腺周围脂肪面积(PFA)、前腹壁脂肪厚度(AAT)、后腹壁脂肪厚度(PAT)以及腹部矢状位直径(APT)。选择前列腺MRI T2加权像经股骨头及股骨大转子的横断面进行测量SFT及PFA,见图 1;选择前列腺MRI T2加权像经脐、膀胱、前列腺、尿道的中轴矢状面进行测量AAT、PAT及APT,见图 2;根据公式计算内脏脂肪比率(Ratio):Ratio=(APT-(AAT+PAT))/APT。
|
| 图 1 MRI T2加权像经股骨头及股骨头大转子的横断面进行测量SFT及PFA Figure 1 Subcutaneous fat thickness (SFT) and periprostatic fat area (PFA) were obtained in MRI (T2- weighed) image of the transverse section at the level of femoral head and greater trochanter of the femur |
|
| 图 2 MRI T2加权像经脐、膀胱、前列腺、尿道的中轴矢状面进行测量AAT、PAT及APT(经中轴矢状面前后共三个平面测定取平均值) Figure 2 Anterior abdominal fat thickness (AAT), posterior abdominal fat thickness (PAT) and anteroposterior diameter (APT) were obtained in MRI (T2-weighed) image of the midline section at the level of umbilicus, bladder, prostate and urethra |
采用SPSS13.0软件进行统计处理,实验数据以(x±s)表示。根据数据是否符合正态分布,脂肪测定指标及细胞因子水平与临床病理学特征的相关性,分别采用方差分析、t检验和秩和检验,并在数据之间进行相关分析;脂肪测定指标与细胞因子水平间相关性分析采用Pearson相关系数表示;采用Logistic回归分析对前列腺癌患者进展性进行评估;以P < 0.05为差异有统计学意义。
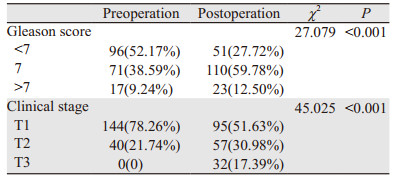
2 结果 2.1 前列腺癌患者术前与术后分期及Gleason评分基本分布本组184例前列腺癌患者术前、术后分期及Gleason评分存在差别,从表 1中可以看出术前分期及Gleason评分与术后相比存在低估现象(P < 0.001)。
|
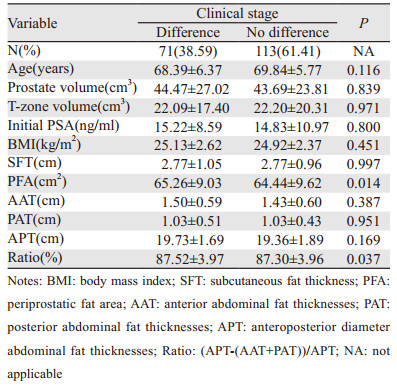
71例患者存在术前临床分期与术后病理分期差别,占全部病例的38.59%;PFA及Ratio在本组前列腺癌临床分期与病理分期差异组和非差异组之间差异有统计学意义(P=0.014, P=0.037)。在前列腺癌分期差异组患者中有更多的脂肪组织分布(P < 0.05);BMI在分期差异组与非差异组之间差异无统计学意义(P=0.451),见表 2。
|
在排除相关临床干扰因素后,Logistic回归结果显示前列腺周围脂肪测定指标PFA、Ratio可作为预测前列腺癌根治性术前、术后分期差异的因素(P=0.031, P=0.002),见表 3。
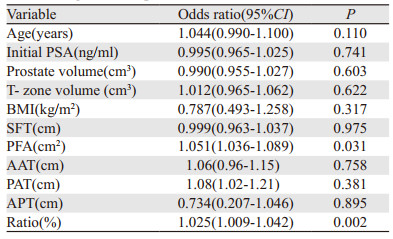
|
本组184例前列腺癌患者术前与术后Gleason评分差异,见表 4,82例患者术前穿刺病理结果Gleason评分与根治术后Gleason评分之间存在差异,占全部病例的44.57%;在术前穿刺病理结果Gleason评分与根治术后Gleason评分差异组和非差异组之间,PFA脂肪测定指标方面差异有统计学意义(P=0.017)。前列腺体积及移行区体积在Gleason评分差异组和非差异组之间差异有统计学意义(P=0.049, 0.020)。BMI在Gleason评分差异组和非差异组之间差异无统计学意义(P=0.576)。
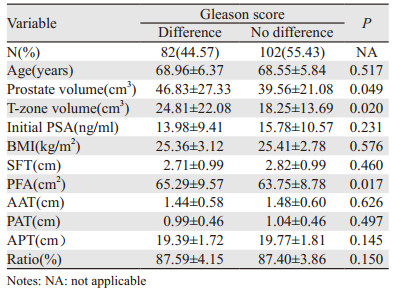
|
在排除相关临床干扰因素后,Logistic回归结果显示前列腺周围脂肪测定指标PFA及前列腺移行区体积可作为预测前列腺癌根治性术前、术后Gleason评分差异的因素(P=0.018,0.028),见表 5。
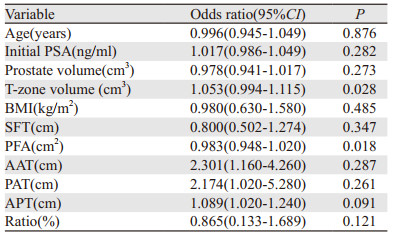
|
目前临床上测定肥胖的方法有多种,最常用的方式有体质量指数(BMI),体现腹部肥胖的腰围(WC)及腰臀比(WHR)以及能够准确测定前列腺周围脂肪的MRI、CT等。通过测定患者的身高及体质量来计算患者的体质量指数,进而判断患者肥胖程度,具有简便性,因此BMI在进行肥胖与前列腺癌发生、进展等相关性研究时应用最早、也最为广泛。但目前研究认为BMI与前列腺癌的发生、发展的相关性存在争议[3-4]。本研究通过术前测量患者的BMI,回顾性分析了患者BMI与前列腺癌进展的相关性,结果发现BMI与前列腺癌患者术前、术后分期及分级的差异并无明显相关性,不能作为术前危险度评估的因素,而CT及MRI被认为可以更为快速、准确的测定前列腺癌周围脂肪的分布[5]。目前研究发现前列腺周围脂肪与前列腺癌的发生、发展有着密切的相关性[6-7]。此外,术前行前列腺MRI是诊断及评估前列腺癌进展的重要检查手段,应用MRI对前列腺癌患者前列腺周围脂肪的分布情况进行分析不会增加患者的经济负担。本研究通过MRI测量前列腺周围脂肪,计算出PFA与Ratio能够较好地反映前列腺周围脂肪的分布,并且发现PFA与前列腺癌患者术前及术后的分期、分级差异具有相关性,能够作为预测前列腺癌根治性术前及术后分期、分级差异的危险因素。
术前对前列腺癌患者分期及分级进行准确的评估是十分重要的,因为它影响着局限性前列腺癌患者的治疗选择及预后的正确评估。据研究发现前列腺癌术前分期往往存在低估现象,其发生率为24%~60%[2],本研究结果显示术前分期低估比率为38.59%,属于这一正常的低估区间。此外,本研究结果显示术前穿刺活检的Gleason评分与术后组织病理Gleason评分的差异性比率为44.57%,也与其他研究相近[1]。术前血清PSA水平、前列腺系统穿刺阳性率及前列腺穿刺与行前列腺根治性手术间隔时间被认为是导致前列腺癌患者术前分期、分级被低估的重要因素[1]。本研究结果发现肿瘤体积与前列腺癌患者术后病理Gleason评分低估现象具有相关性,这可能与术前进行前列腺系统穿刺活检时由于前列腺体积导致穿刺阳性率下降的因素有关[8]。本研究结果显示前列腺周围脂肪与前列腺癌患者术前、术后分期、分级的差异具有相关性,前列腺周围脂肪含量越高其越容易在术前分期、分级诊断中出现低估现象,这需要我们高度重视,因为前列腺周围脂肪对前列腺癌分期、分级的影响可能暗示着中心型肥胖的前列腺癌患者需要接受不同的治疗及较差的预后。前列腺周围脂肪导致前列腺癌分期、分级被低估发生的原因,可能是由于以下几点:(1)在应用MRI进行术前分期时,前列腺周围脂肪组织影响了对前列腺包膜浸润,精囊浸润以及盆腔淋巴结转移的判断;(2)前列腺周围脂肪对前列腺系统穿刺活检的阳性结果有一定的影响,这也间接的导致了术前Gleason评分被低估的情况;(3)前列腺周围脂肪分泌的细胞因子可能对术前血清PSA水平的准确性有影响,而术前血清PSA水平与前列腺癌术前分期及分级的低估现象有关。
综上所述,前列腺癌患者术前MRI检查不仅可以对其作出诊断及分期评估,也可以通过测定前列腺周围脂肪来预测前列腺癌根治性术前、术后分期差异,进而更好的为患者预后提供指导性的意见。
| [1] | Khoddami M, Khademi Y, Kazemi Aghdam MK, et al. Correlation between Gleason scores in needle biopsy and corresponding radical prostatectomy specimens: a twelve-year review[J]. Iran J Pathol, 2016, 11(2): 120–6. |
| [2] | Epstein JI, Feng Z, Trock BJ, et al. Upgrading and downgrading of prostate cancer from biopsy to radical prostatectomy: incidence and predictive factors using the modified gleason grading system and factoring in tertiary grades[J]. Eur Urol, 2012, 61(5): 1019–24. DOI:10.1016/j.eururo.2012.01.050 |
| [3] | Chamie K, Oberforell S, Kwan L, et al. Body mass index and prostate cancer severity: do obese men harbor more aggressive disease on prostate biopsy?[J]. Urology, 2013, 81(5): 949–55. DOI:10.1016/j.urology.2013.01.021 |
| [4] | Zhang Q, Sun LJ, Qi J, et al. Periprostatic Adiposity Measured on Magnetic Resonance Imaging Correlates with Prostate cancer Aggressiveness[J]. Urol J, 2014, 11(4): 1793–9. |
| [5] | Poonawalla AH, Sjoberg BP, Rehm JL, et al. Adipose tissue MRI for quantitative measurement of central obesity[J]. J Magn Reson Imaging, 2013, 37(3): 707–16. DOI:10.1002/jmri.v37.3 |
| [6] | De Nunzio C, Albisinni S, Freedland SJ, et al. Abdominal obesity as risk factor for prostate cancer diagnosis and high grade disease: a prospective multicenter Italian cohort study[J]. Urol Oncol, 2013, 31(7): 997–1002. DOI:10.1016/j.urolonc.2011.08.007 |
| [7] | Venkatasubramanian PN, Brendler CB, Plunkett BA, et al. Periprostatic adipose tissue from obese prostate cancer patients promotes tumor and endothelial cell proliferation: a functional and MR imaging pilot study[J]. Prostate, 2014, 74(3): 326–35. DOI:10.1002/pros.22756 |
| [8] | Gordetsky J, Epstein J. Grading of prostatic adenocarcinoma: current state and prognostic implications[J]. Diaqn Pathol, 2016, 11: 25. |
 2018, Vol. 45
2018, Vol. 45


