文章信息
- ZMYND11在多形型胶质母细胞瘤中的表达及意义
- Expression and Clinical Significance of ZMYND11 in Glioblastoma Multiforme
- 肿瘤防治研究, 2018, 45(8): 560-565
- Cancer Research on Prevention and Treatment, 2018, 45(8): 560-565
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1362
- 收稿日期: 2017-10-26
- 修回日期: 2018-05-11
2. 050000 石家庄,河北医科大学第二医院全科医学科;
3. 051130 石家庄,元氏县中医院神经外科
2. Department of General Practice, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China;
3. Department of Neurosurgery, Yuanshi County Hospital of Traditional Chinese Medicine, Shijiazhuang 051130, China
多形性胶质母细胞瘤(glioblastoma multiforme, GBM)是最常见及恶性程度最高的颅内原发性胶质瘤之一。GBM致死性极高,2年生存率不超过10%,严重威胁人类健康[1]。虽然GBM的化疗及放疗较前已取得巨大的进步,但GBM患者的总体生存期仍然很短[2]。基因治疗已成为当今GBM治疗中新的热点,含MYND结构的锌指蛋白11(zinc finger MYND domain-containing protein 11, ZMYND11)已被广泛认为是一种潜在的抑癌基因[3],但对ZMYND11在GBM中的表达及作用尚未被研究,本研究收集GBM患者及正常脑组织标本各20例,探讨ZMYND11在GBM中表达及其作用。
1 资料与方法 1.1 一般资料收集2015年1月—2016年12月于河北医科大学第二医院手术治疗的GBM患者肿瘤标本共20例,其中男11例、女9例,年龄41~67岁,平均(49.7±2.57)岁,并收集同期间变性星形细胞瘤(anaplastic astrocytoma, AA)患者10例,其中男6例、女4例,年龄39~56岁,平均(46.41±4.18)岁,上述GBM及AA患者术前均未接受任何放疗及化疗。所有GBM及AA患者的诊断均由两名经验丰富的病理医师根据WHO 2007年标准认定,收集同期20例重度颅脑外伤的患者行去骨瓣减压术中无肿瘤的脑组织标本作为对照,其中男14例、女6例,年龄21~58岁,平均(34.87±5.21)岁,上述脑外伤患者各系统均无肿瘤发生。
1.2 仪器与试剂DMEM/High-Glucose培养基购于Hyclone中国公司,双抗及10%特级胎牛血清购于美国Gibco公司,ZMYND11及GAPDH的引物是由北京Invitrogen公司合成,ZMYND11及GAPDH购于英国Abcam公司,仪器主要包括美国Thermo Fisher Scientific公司的Thermo Forma 3111二氧化碳培养箱,苏州苏净集团安泰空气技术公司的SW-CJ-IFD净化工作台,Thermo公司的精密移液枪,美国Ohaus公司的AP250D-0电子天平,英国Ultra Bioscience公司的超纯水仪,中国北京DYCZ-24DN型双垂直电泳仪,美国伯腾公司BioTek Synergy HT多功能酶标仪,日本SANYO公司MLS-3020CH高压蒸汽灭菌器。日本Olympus公司光学显微镜和倒置相差显微镜,美国Life Technologies公司Applied Biosystems 9700实时荧光定量PCR仪。
1.3 蛋白质免疫印迹法检测蛋白的表达冰浴中充分研磨组织或细胞并加入适量的RIPA蛋白裂解液中,采用蛋白测定试剂盒(BCA,Pierce)测量蛋白浓度,按样品体积与上样缓冲液体积的比值为4:1计算需要加入的5×上样缓冲液的体积,封口膜封紧管口,煮沸5 min,分装置于-20℃保存。在预先制好的12%聚丙烯酰胺凝胶板的每个孔内加入90 μg的蛋白电泳,按照海绵、滤纸、凝胶、PVDF膜、滤纸、海绵的顺序放好,转膜约1.5 h。取5%脱脂奶粉的TBST缓冲液封闭1 h,加入兔抗人ZMYND11多克隆抗体,4℃冰箱过夜。次日添加二抗,室温避光孵育2 h。用1×TBST清洗3次,每次15 min,后于双色红外激光成像系统进行扫描,采集显影条图像,用Image-Pro Plus 6软件进行灰度定量分析。每组实验重复3次。GAPDH作为内参照,计算目的条带与内参条带的灰度比值。
1.4 实时荧光定量PCR检测mRNA的表达采用qRT- PCR检测待测样品的ZMYND11和GAPDH的mRNA水平,根据miRcute Plus miRNA Detection Kit说明书提取标本总RNA,用紫外分光光度计测定其吸光度,其中OD260/OD280的值在1.6~2.0之间的RNA质量最好,测定RNA浓度,将上述总RNA反转录成cDNA,根据SuperReal PreMix Plus(SYBR Green)试剂盒说明书进行Real-time PCR进行扩增,GAPDH作为内参照。引物设计如下:ZMYND11上游引物: 5’-AAACCATGGAGCAGTCCTGCGTTAAC-3’, 下游引物:5’-AAAGGTAGGTCATGCTGACTGGCCGCATATG-3’,GAPDH上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。
1.5 细胞培养人胶质母细胞瘤细胞株U87购自中国科学院,培养基包括10%FBS、100 u/ml青霉素、100 μg/ml链霉素的DMEM高糖培养液,置于37℃、5%的CO2及饱和湿度下进行培养,每日于显微镜下观察细胞生长状况,每两日更换培养基一次,当细胞处于对数生长期时进行细胞转染及功能学实验。
1.6 ZMYND11过表达慢病毒的载体构建及转染购买由上海吉凯公司构建并合成的ZMYND11过表达的慢病毒及相应的对照空载慢病毒,将其转染至处于对数生长期的U87细胞系中,通过荧光显微镜下观察绿色荧光显现情况及Western blot检测转染效果,MOI值取5,当细胞融合率至40%左右时,算出病毒用量并根据病毒滴度得出相应病毒体积,利用溴化己二甲铵及转染增效试剂辅助慢病毒的转染,转染14 h更换培养液,72 h后荧光显微镜下观察绿色荧光。
1.7 CCK、Transwell及流式细胞学分析等功能学实验CCK实验:将转染后的ZMYND11过表达U87细胞系及对照细胞系种植于96孔板上,每组取4个副孔,细胞密度为4×103个每孔,培养液100 μl,之后分别于24、36、48、72 h,加入10 μl CCK8试剂,加试剂前更换培养液,孵育4 h后于酶标仪上测吸光度值,空白孔内添加100 μl完全培养液及10 μl CCK8试剂。Transwell实验:将转染后细胞种植于24孔板的小室上,细胞密度为1×105个每孔,取100 μl无血清的培养液孵育,小室底部铺纤维连接蛋白膜,小室外加600 μl 30%血清浓度的培养液,培养箱放置18 h后,轻轻擦去小室面膜上的细胞后于膜的下表面添加甲醇固定30 min,结晶紫染色20 min后清水洗涤3遍,100倍显微镜下计数每视野内的细胞,共随机选取6个视野并拍照。凋亡流式细胞学分析:将两组细胞胰酶消化后取预冷的PBS缓慢冲洗两遍,离心后弃上清液,工作液冲悬细胞后依次添加10 μl 7-AAD及5 μl Annexin V试剂,室温避光放置15 min后上机。细胞周期流式细胞学分析:两组细胞消化后预冷PBS冲洗后离心,弃上清液后取1 ml 70%酒精固定细胞,添加PI试剂后避光放置10 min后上机检测。
1.8 裸鼠成瘤实验20只裸鼠(4周雌鼠)购于南京常州卡文斯实验动物有限公司,将ZMYND11过表达的U87细胞注入10只裸鼠背部皮下称为实验组,相应对照的U87细胞注入另外10只裸鼠背部皮下称为对照组,即每只裸鼠注射5×106个细胞,于无菌饲养室饲养,每周测量一次成瘤的长径及短径,饲养6周后断颈处死裸鼠并取出瘤体,称重拍照。
1.9 统计学方法所得数据采用SPSS 17.0统计软件处理。计量资料以均数±标准差表示,采用t检验比较两组计量资料,P < 0.05为差异有统计学意义。
2 结果 2.1 GBM肿瘤组织及U87细胞系中ZMYND11的表达Western blot结果显示:在蛋白水平,GBM肿瘤组织中ZMYND11的相对表达量平均值为0.4457±0.0372,无肿瘤脑组织中ZMYND11的相对表达量为0.7200±0.0328,可见ZMYND11蛋白在肿瘤组织中的表达显著低于无肿瘤脑组织(t=5.539, P=0.0000),上述两组ZMYND11蛋白表达情况及相对值见图 1A,qRT-PCR结果显示:在mRNA水平,GBM肿瘤中ZMYND11的相对表达量为0.4910±0.038,在对照组中其相对表达量为0.7495±0.034,其mRNA在肿瘤组织中表达也明显低于无肿瘤脑组织(t=4.615, P=0.000188),两组ZMYND11 mRNA表达情况,见图 1B。
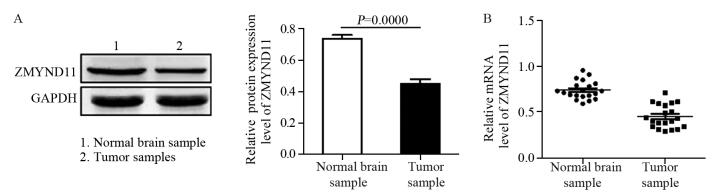
|
| A: the protein expression level of ZMYND11 was significantly decreased in GBM(glioblastoma multiforme) samples than that in non-neoplasm brain samples measured by Western blot; B: the mRNA level of ZMYND11 was remarkably lower in GBM samples than that in normal brain tissues detected by qRT-PCR 图 1 ZMYND11在无肿瘤脑组织与多形性胶质母细胞瘤组织中的表达 Figure 1 Relative expression levels of ZMYND11 mRNA and protein in non-neoplasm brain and GBM tissues |
Western blot结果显示:GBM组中ZMYND11蛋白的相对表达量为0.44318±0.0387,AA肿瘤组织中ZMYND11蛋白的相对表达量为0.4761±0.042,两组差异无统计学意义(t=0.7589, P=0.3965),上述两组ZMYND11蛋白表达情况及相对值见图 2A,qRT-PCR结果显示:GBM组中ZMYND11的mRNA相对表达量为0.4510±0.0297,AA肿瘤组织中ZMYND11的mRNA相对表达量为0.4850±0.037,两组差异无统计学意义(t=0.7247, P=0.2875),两组ZMYND11的mRNA表达情况见图 2B。
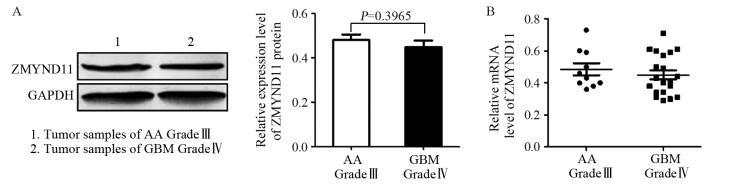
|
| AA: anaplastic astrocytoma; A: there was no significantly difference of ZMYND11 protein expression levels between AA and GBM; B: there was no significantly difference of ZMYND11 mRNA expression level between AA and GBM 图 2 ZMYND11在间变性星形细胞瘤(AA)与多形性胶质母细胞瘤(GBM)中的表达 Figure 2 Relative expression levels of ZMYND11 mRNA and protein in anaplastic astrocytoma (AA) and GBM tissues |
Western blot结果显示:ZMYND11过表达的慢病毒转染后U87细胞中ZMYND11的蛋白表达水平明显高于对照组(t=12.29, P=0.0000),见图 3A。CCK实验结果表明:ZMYND11过表达细胞系的细胞活力显著弱于对照细胞系(t=8.971, P=0.0000),两组细胞450 nm吸光度值变化曲线及第5天吸光度值比较情况见图 3B、表 1;细胞周期流式细胞学结果提示:ZMYND11过表达细胞系中处于G1/G0期的细胞比例为(45.30±4.38)%,对照组为(36.12±3.41)%,ZMYND11过表达细胞系处于G1/G0期的细胞比例明显多于对照细胞系(t=4.37, P=0.00032),而且ZMYND11过表达细胞系中处于S期的细胞比例(18.71±3.75)%明显少于对照细胞系中S期的细胞比例(31.47±4.01)%,其差异有统计学意义(t=5.70, P=0.0000),两组细胞周期中G1/G0期与S期分布情况见图 3C。
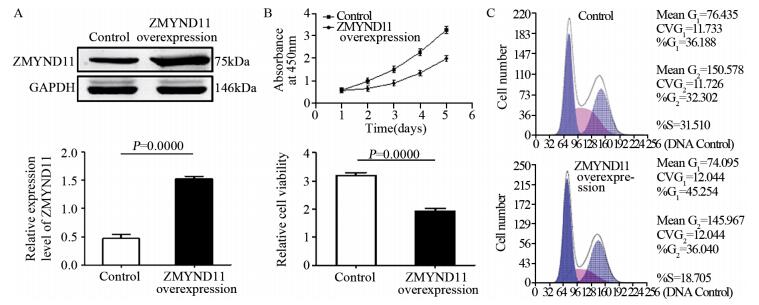
|
| A: the protein expression of ZMYND11 protein in U87 cells after lentivirus transfection of ZMYND11-overexpression; B: the effect of ZMYND11 overexpression on the proliferation of U87 cells; C: the effect of ZMYND11 overexpression on U87 cell cycle 图 3 ZMYND11过表达对U87细胞增殖、侵袭及细胞周期的作用 Figure 3 Role of ZMYND11 overexpression in proliferation, invasion and cell cycle of U87 cells |

|
ZMYND11过表达细胞系中每视野穿过膜的平均细胞数为(65.0±6.65)个,对照组每视野平均细胞数为(117.3±8.09)个,提示ZMYND11过表达细胞系的细胞侵袭力低于对照细胞系(t=10.36, P=0.0000),两组膜染色情况及穿过细胞数比较见图 4A;细胞凋亡流式细胞学结果显示:ZMYND11过表达组的凋亡细胞所占比例(11.64±2.74)%明显高于对照组的凋亡细胞所占比例(5.31±1.35)%,其差异有统计学意义(t=6.54, P=0.0000),两组细胞凋亡情况见图 4B。
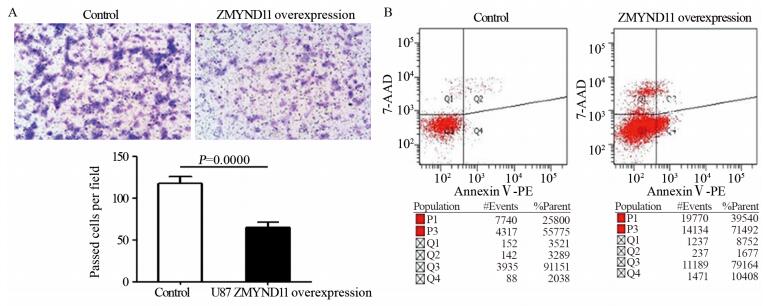
|
| A: comparison of U87 cells invasive ability between ZMYND11-overexpression group and Control group; B: comparison of U87 cells apoptosis rate between of ZMYND11-overexpression group and Control group 图 4 ZMYND11过表达与对照U87细胞系细胞侵袭力及细胞凋亡的比较 Figure 4 Compare of U87 cells invasive ability and apoptosis between ZMYND11-overexpression group and Control group |
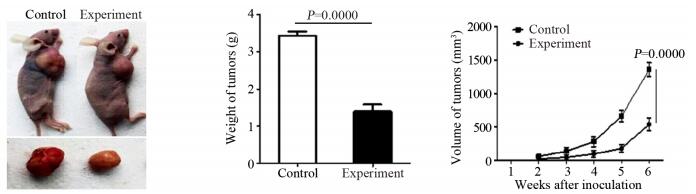
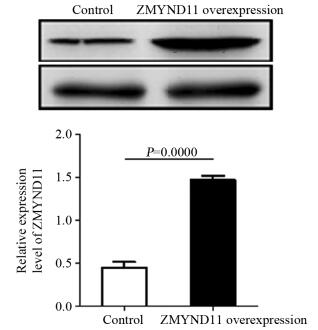
裸鼠成瘤实验结果表明:实验组所成瘤瘤体的平均重量为(1.398±0.194)g及平均体积为(537.13±96.35)mm3,对照组所成瘤瘤体的平均重量为(3.439±0.114)g及平均体积为(1356.7±102.63)mm3,实验组瘤体及体积均明显低于对照组(t=9.764, P=0.0000和t=14.26, P=0.0000),两组裸鼠成瘤情况、瘤体重量与体积比较,见图 5。实验组与对照组所成瘤瘤体中ZMYND11的相对表达水平分别为(1.462±0.048)与(0.450±0.114),两组间ZMYND11的表达差异有统计学意义(t=9.421, P=0.0000),见图 6。
|
| 图 5 实验组及对照组裸鼠成瘤体积与重量的对比 Figure 5 Volume and weight of tumors in two groups of nude mice |
|
| 图 6 两组裸鼠成瘤中ZMYND11相对表达量的对比 Figure 6 Expression levels of ZMYND11 in two groups of nude mice |
ZMYND11也称为BS69,定位于细胞核内第10号染色体,早期研究发现ZMYND11是一种可与腺病毒早期区域蛋白1A(early region 1A, E1A)特异性结合并抑制其活性的蛋白,该蛋白的生物学功能与其所包含的PHD, BROMO, PWWP及MYND等结构域密切相关[4-5]。Ansieau等[6]研究发现ZMYND11不仅可以与蛋白E1A结合,而且还能与Epstein-Barr病毒致癌蛋白EB病毒核抗原2(Epstein-Barr virus nuclear antigen 2, EBNA2)及Myc相关蛋白MAG结合从而控制细胞增殖,具有潜在的抗肿瘤性。Wen等[7]研究证实ZMYND11借助于其PWWP结构可特异性识别组蛋白H3的变异体H3.3(或称H3.3K36me3)中的H3K36me3结构并抑制其相关致癌基因转录过程进而抑制乳腺癌的进展。Lan等[8]研究发现ZMYND11中的BROWWP结构特异性识别并结合H3K36me3,通过调整染色质微环境从而促进内含体的保留及抑制RNA聚合酶Ⅱ的活性,阻碍H3.3相关致癌蛋白的转录时RNA的延伸及拼接,最终抑制细胞的异常增殖。而H3.3变异体已被证实与其他恶性肿瘤包括青年人胶质母细胞瘤的发生有密切关系[8]。故ZMYND11已被学术界广泛认为是一种潜在的抑癌蛋白。此外,Kateb等[9]发现ZMYND11中的MYND结构在调控细胞蛋白转录过程中具有重要作用。根据以上依据,本研究提出ZMYND11表达可能与GBM的发生存在联系,随后通过收集20例GBM患者肿瘤标本与无肿瘤脑组织对比研究发现肿瘤组织中ZMYND11的mRNA及蛋白水平均明显低于正常脑组织。此结果与本课题组之前设想相一致,ZMYND11作为抑癌基因在GBM中呈显著低表达,提示ZMYND11可能对GBM存在一定的抑制作用。为探明ZMYND11在胶质瘤级别的相关性,本课题组收集并检测间变性星形细胞瘤组织中的ZMYND11的表达并与GBM中ZMYND11的表达进行比较,发现两者ZMYND11表达无明显差异,故我们考虑ZMYND11的表达水平与胶质瘤的级别呈负相关。为进一步验证ZMYND11在GBM细胞中的作用,我们通过将ZMYND11过表达的慢病毒转染U87细胞使其ZMYND11高表达,再利用CCK、Transwell及流式细胞学分析从增殖、侵袭及凋亡三方面验证ZMYND11对U87细胞系的影响。以上实验结果发现:ZMYND11过表达可有效抑制U87细胞的增殖并明显降低其侵袭能力;同时ZMYND11过表达还促进U87细胞的凋亡及引起U87细胞周期的捕获。上述实验说明ZMYND11可在体外显著的抑制U87的增殖、侵袭及抗凋亡能力。之后为进一步验证ZMYND11是否能在体内发挥同样的抑癌作用,本研究还进行了裸鼠成瘤实验,结果证明ZMYND11高表达组的肿瘤体积、重量积极生长速度明显低于对照组。上述体外及体内试验均验证ZMYND11可抑制GBM的进展,但ZMYND11抑制GBM进展的具体机制尚未明确。考虑其作用机制除了上述可识别H3K36me3外,还可能通过抑制EBNA2所引起的致癌作用以抑制GBM的发生及进展。此外,Ladendorff等[10]已证实ZMYND11可特异性抑制c-Myd的转录从而抑制其致癌进程。已有研究发现NF-κB具有调节机体生长与凋亡、细胞与组织的分化及免疫系统的炎性反应能力的作用,NF-κb异常表达可引起细胞凋亡及增殖异常导致癌症的发生[11-13]。潜伏膜蛋白1(latent membrane protein 1, LMP1)可引起NF-κB的异常激活,此过程是LMP1致癌的一种重要途径[14]。Ikeda等[15]发现ZMYND11可抑制LMP1所介导的NF-κB通路的激活从而降低细胞的异常增殖的能力并促进细胞凋亡。本实验通过CCK-8及流式细胞学测凋亡实验也证实了ZMYND11在GBM中具有抑制细胞增殖及促凋亡的作用,对LMP1-NF-κB通路的抑制极可能是其作用机制。此外,Guo等[16]发现ZMYND11作为共因子与一些转录调节因子如EFTUD2(elongation factor Tu GTP binding domain containing 2)结合从而抑制相关基因转录时RNA的拼接。本研究中发现ZMYND11可抑制GBM的生长也可能与此作用密切相关。
综上所述,ZMYND11在GBM组织与细胞系U87中呈低表达;过表达ZMYND11可有效抑制GBM的发生及生长。虽然具体机制尚不完全明确,但随着对其作用机制的进一步研究及探索,ZMYND11在未来很可能为GBM基因治疗中的重要的工具基因。
| [1] | Harris G, Jayamanne D, Wheeler H, et al. Survival Outcomes of Elderly Patients With Glioblastoma Multiforme in Their 75th Year or Older Treated With Adjuvant Therapy[J]. Int J Radiat Oncol Biol Phys, 2017, 98(4): 802–10. DOI:10.1016/j.ijrobp.2017.02.028 |
| [2] | Barney C, Shukla G, Bhamidipati D, et al. Re-irradiation for recurrent glioblastoma multiforme[J]. Chin Clin Oncol, 2017, 6(4): 36. DOI:10.21037/cco |
| [3] | Ansieau S, Sergeant A. BS69 and RACK7, a potential novel class of tumor suppressor genes[J]. Pathol Biol (Paris), 2003, 51(7): 397–9. DOI:10.1016/S0369-8114(03)00019-1 |
| [4] | Hateboer G, Gennissen A, Ramos YF, et al. BS69, a novel adenovirus E1A-associated protein that inhibits E1A transactivation[J]. EMBO J, 1995, 14(13): 3159–69. |
| [5] | Wen H, Li Y, Li H, et al. ZMYND11: an H3.3-specific reader of H3K36me3[J]. Cell Cycle, 2014, 13(14): 2153–4. DOI:10.4161/cc.29732 |
| [6] | Ansieau S, Leutz A. The conserved Mynd domain of BS69 binds cellular and oncoviral proteins through a common PXLXP motif[J]. J Biol Chem, 2002, 277(7): 4906–10. DOI:10.1074/jbc.M110078200 |
| [7] | Wen H, Li Y, Xi Y, et al. ZMYND11 links histone H3.3K36me3 to transcription elongation and tumor suppression[J]. Nature, 2014, 508(7495): 263–8. DOI:10.1038/nature13045 |
| [8] | Lan F, Shi Y. Histone H3.3 and cancer: A potential reader connection[J]. Proc Natl Acad Sci U S A, 2015, 112(22): 6814–9. DOI:10.1073/pnas.1418996111 |
| [9] | Kateb F, Perrin H, Tripsianes K, et al. Structural and functional analysis of the DEAF-1 and BS69 MYND domains[J]. PLoS One, 2013, 8(1): e54715. DOI:10.1371/journal.pone.0054715 |
| [10] | Ladendorff NE, Wu S, Lipsick JS. BS69, an adenovirus E1A-associated protein, inhibits the transcriptional activity of c-Myb[J]. Oncogene, 2001, 20(1): 125–32. DOI:10.1038/sj.onc.1204048 |
| [11] | Nomura A, Majumder K, Giri B, et al. Inhibition of NF-kappa B pathway leads to deregulation of epithelial-mesenchymal transition and neural invasion in pancreatic cancer[J]. Lab Invest, 2016, 96(12): 1268–78. DOI:10.1038/labinvest.2016.109 |
| [12] | Gao P, Gao YJ, Liang HL. Effect of NF- κB inhibitor PDTC on VEGF and endostatin expression of mice with Lewis lung cancer[J]. Asian Pac J Trop Med, 2015, 8(3): 220–4. DOI:10.1016/S1995-7645(14)60319-9 |
| [13] | Ito Y, Kikuchi E, Tanaka N, et al. Down-regulation of NF kappa B activation is an effective therapeutic modality in acquired platinum-resistant bladder cancer[J]. BMC Cancer, 2015, 15: 324. DOI:10.1186/s12885-015-1315-9 |
| [14] | Wang LW, Jiang S, Gewurz BE. Epstein-Barr Virus LMP1-Mediated Oncogenicity[J]. J Virol, 2017, 91(21): e01718–16. |
| [15] | Ikeda O, Sekine Y, Mizushima A, et al. BS69 negatively regulates the canonical NF-kappaB activation induced by Epstein-Barr virus-derived LMP1[J]. FEBS Lett, 2009, 583(10): 1567–74. DOI:10.1016/j.febslet.2009.04.022 |
| [16] | Guo R, Zheng L, Park JW, et al. BS69/ZMYND11 reads and connects histone H3.3 lysine 36 trimethylation-decorated chromatin to regulated pre-mRNA processing[J]. Mol Cell, 2014, 56(2): 298–310. DOI:10.1016/j.molcel.2014.08.022 |
 2018, Vol. 45
2018, Vol. 45


