文章信息
- 恩度微量泵入与腹腔注射联合表阿霉素治疗小鼠乳腺癌的疗效对比观察
- Effect of Two Administration Methods of Endostar Combined with Epirubicin on Breast Cancer in Mice
- 肿瘤防治研究, 2018, 45(7): 463-467
- Cancer Research on Prevention and Treatment, 2018, 45(7): 463-467
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1349
- 收稿日期: 2017-10-24
- 修回日期: 2018-02-27
2. 650051 昆明,云南省昆明市延安医院骨科;
3. 650223 昆明,中国科学院昆明动物研究所动物模型与人类疾病机理重点实验室
2. Department of Osteopathic Medicine, Kunming Yan'an Hospital, Kunming 650051, China;
3. Key Laboratory of Animal Models and Human Disease Mechanism, Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China
乳腺癌是威胁女性健康的重大杀手,中国癌症统计数据显示乳腺癌发病率呈逐年上升趋势[1]。肿瘤血管生成在乳腺癌的发生、发展和转移中起着重要作用[2]。近年来研究表明抗血管生成药物可使肿瘤血管及微环境正常化,有利于化疗药物有效作用于肿瘤[3-4]。因此临床上抗血管生成药物常与化疗药物联合应用治疗多种恶性肿瘤。
恩度(Endostar),即重组人血管内皮抑素(rh-endostatin, rhES),主要是通过抑制肿瘤新生血管及淋巴管,阻断肿瘤的营养供给从而抑制肿瘤生长[5-6]。目前已有一些体内研究和临床观察表明,恩度与紫杉醇、NP、GP等化疗方案联合应用可以抑制乳腺癌的生长。然而,临床上恩度需连续14天静脉滴注,依从性差的患者不能接受,且延长了住院时间,增加了医疗费用。2011年至今已有多个临床观察[7-10]发现,对进展期卵巢癌、胃癌、非小细胞肺癌和原发性肝癌患者,恩度持续静脉泵联合化疗的疗效优于静脉滴注。因而恩度微量泵疗效或较优且为患者提供了方便,值得深入观察和临床推广应用,但目前仅局限于临床观察,且在乳腺癌中的研究尚未见报道。表阿霉素(Epirubicin, EPI)属于蒽环类抗肿瘤药物,是目前公认的乳腺癌术后辅助化疗的基石。本实验构建了4T1荷瘤的乳腺癌动物模型,采用恩度微量泵或腹腔注射联合表阿霉素治疗,比较不同给药方式对小鼠乳腺癌的治疗效果和不良反应。
1 材料与方法 1.1 材料 1.1.1 细胞小鼠乳腺癌细胞4T1购自美国ATCC公司,用添加5%胎牛血清(Hyclone, Logan, UT)的高糖DMEM培养液(Gibco, USA),置于37℃、5%CO2培养箱中常规培养。
1.1.2 实验动物SPF级BALB/c雌鼠30只,体质量20~22 g,8~10周龄,购自北京维通利华实验动物技术有限公司[实验动物许可证号:SCXK(京)2012-0001],在中国科学院昆明动物研究所SPF级实验动物中心进行动物实验。
1.1.3 实验材料重组人血管内皮抑素(恩度,10 mg/ml)由山东先声麦得津生物制药有限公司提供;注射用盐酸表柔比星(海正辉瑞制药有限公司);0.9%氯化钠溶液(四川科伦药业股份有限公司);ALZET植入式胶囊渗透压泵(Osmotic Pump,2002型号,200 μl 0.5 μl/h 2周)和小鼠腹腔导管(Mouse Intraperitoneal Cathether MIP-01 Item)购自成都北美佳瑞生物技术有限公司;Matrigel购自美国BD Biosciences公司;D-Luciferin购自北京Bridgen公司(D12505);CD31/PECAM-1一抗(ab28364)购自美国Abcam公司(1:400稀释)。
1.1.4 仪器小动物活体成像仪(Xenogen IVIS-100 imaging system);游标卡尺(艾瑞泽);倒置显微镜(Olympus)。
1.2 方法 1.2.1 乳腺癌BALB/c小鼠皮下移植瘤模型的建立取对数生长期的4T1细胞悬浮于Matrigel胶,调整细胞数按1.0×105每点接种于小鼠腹壁左侧第4对乳腺皮下,接种后隔天观察移植瘤生长情况,待移植瘤体积生长至约30 mm3时,采用随机数字表法对小鼠进行随机分组,各组间移植瘤体积、小鼠体重均衡(P > 0.05);小鼠均采用耳钉进行编号。
1.2.2 实验分组与药物治疗荷瘤小鼠被随机分为六组,(1)空白对照组:腹腔注射等量氯化钠溶液(0.9%NaCl, ip);(2)标准对照组:表阿霉素腹腔注射(EPI, ip);(3)实验组1:恩度联合表阿霉素腹腔注射(rhES(ip)+EPI(ip);(4)实验组2:恩度微量泵入联合表阿霉素腹腔注射(rhES(pump)+EPI(ip));(5)实验组3:恩度腹腔注射(rhES, ip);(6)实验组4:恩度微量泵入(rhES, pump)。以上分组每组5只小鼠,恩度均按7 mg/(kg.d),连续给药14天(腹腔注射或微量泵入),以14天为1周期,共持续2周期;表阿霉素均按每周期8 mg/kg,每周期的第1天腹腔注射给药,以7天为1周期,共持续4周期;定义14天为1疗程,1疗程结束后重新埋泵重复一疗程,共2疗程。Alzet微量泵内槽于埋入前12 h注入200 μl 10 mg/ml恩度,安装好导管,避光置于37℃氯化钠溶液中浸泡,胶囊泵外槽充分吸收氯化钠溶液,将微量泵植入小鼠右侧腹部皮下,导管插入腹腔,缝合皮肤。分组后每2天监测1次肿瘤大小与小鼠体重,采用同一把游标卡尺测量移植瘤的长径a和短径b,肿瘤体积的计算公式为V(cm3)=πab2/6。
1.2.3 移植瘤剥离第1疗程末次给药后第二天(接种4T1细胞后第23天),在氯胺酮麻醉下,完整剥离各组小鼠移植瘤,取出旧微量泵,同时再次埋入已注入新鲜恩度的新微量泵,缝合腹膜和皮肤,继续第2疗程的治疗,对移植瘤拍照并称量瘤重。
1.2.4 小动物活体成像于治疗后第10天(接种4T1细胞后第16天)和治疗结束时(接种4T1细胞后第42天),通过生物发光活体成像系统对肿瘤生长情况进行对比[11],每组随机选取2只小鼠进行检测,所有小鼠均于注射D-荧光素(D-Luciferin)后10 min进行拍照,并定量肿瘤荧光光子数。
1.2.5 免疫组织化学检测移植瘤组织中CD31蛋白表达水平移植瘤经10%福尔马林溶液固定24 h、脱水、包埋、5 μm连续切片,而后行免疫组织化学染色,应用酶标二步法对移植瘤中CD31的表达水平进行检测。
1.3 统计学方法采用SPSS17.0统计软件对实验结果进行分析,正态计量资料用(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 小动物活体成像系统检测荷瘤动物体内肿瘤的生长情况治疗第10天行小动物活体成像,与肿瘤生长曲线相符,见图 1A,当表阿霉素联合恩度微量泵入时,对小鼠乳腺癌的治疗效果优于表阿霉素单用或联合恩度腹腔注射,见图 2。

|
| A: tumor growth curves; B: tumor xenografts weight; EPI: epirubicin; rhEs: rhendostatin 图 1 不同治疗方案对移植瘤的治疗效果 Figure 1 Therapeutic effects of different therapeutic schedules on tumor xenografts |

|
| 图 2 小动物活体成像评估移植瘤生长情况(治疗后第10天) Figure 2 Tumor xenografts growth evaluated by small animal bioluminescent imaging (day10th after treatment) |
恩度持续微量泵入对4T1移植瘤的治疗效果显著优于恩度腹腔注射(7 mg/(kg·d)×14 d),差异有统计学意义,瘤重((482±100)mg vs.(732±165)mg,P=0.01),见图 1B;表阿霉素联合恩度腹腔注射疗效与单用表阿霉素疗效相当,差异无统计学意义((630±153)mg vs.(623±110)mg,P > 0.05),当改为恩度微量泵入联合表阿霉素腹腔注射时,虽其治疗效果仅略优于双药联合腹腔注射(瘤重(556±150)mg vs.(623±110)mg,P > 0.05),但微量泵方案表现出了较低的不良反应,见图 3。
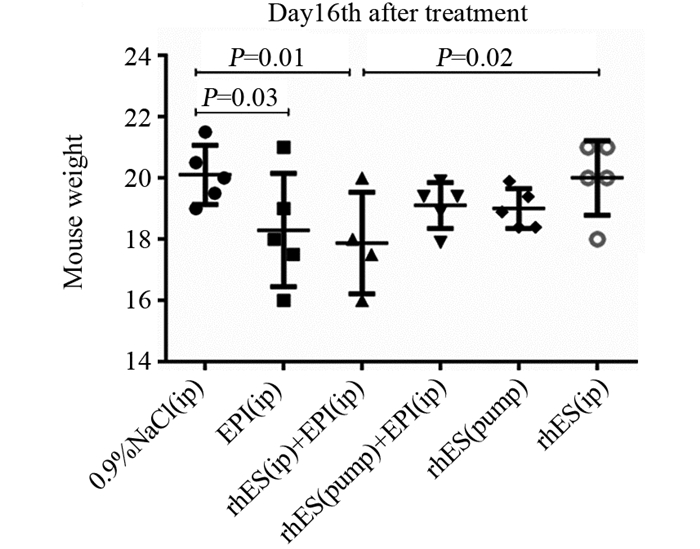
|
| 图 3 各治疗方案对小鼠体重的影响(第一个疗程治疗结束时) Figure 3 Comparison of weight loss in mice among different groups (at the end of the first course of treatment) |
统计小鼠一疗程治疗结束时的体重,与空白对照组比较,表阿霉素单用或联合恩度腹腔注射对小鼠的不良反应大,小鼠体重下降明显,差异有统计学意义(P=0.03, 0.01),而单用恩度微量泵或联合表阿霉素腹腔注射时,其不良反应降低,与空白对照组比较体重下降无统计学意义(P > 0.05),见图 3。
2.4 不同治疗方案对肿瘤新生血管的影响采用免疫组织化学检测不同治疗方案下移植瘤组织中CD31(PECAM-1)的表达。与空白对照组相比,肿瘤经表阿霉素单药治疗后血管新生明显减少,当联合恩度腹腔注射或微量泵入时,CD31表达进一步减少且血管形态变得正常化,结构相对完整,内皮细胞连续,见图 4。
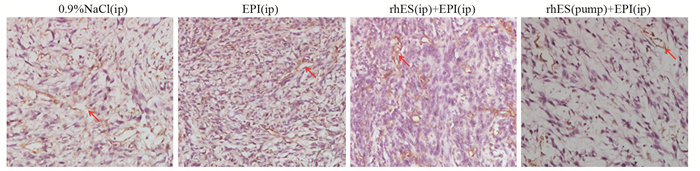
|
| ↖: CD31-positive vascular endothelial cells in xenografts 图 4 免疫组织化学检测各治疗方案下肿瘤组织内CD31的表达(×200) Figure 4 Immunohistochemical staining of CD31 expression in different groups (×200) |
2个疗程治疗结束时再次行小动物活体成像,所抽取小鼠均出现了不同程度的转移,但恩度微量泵入组转移较少,见图 5。
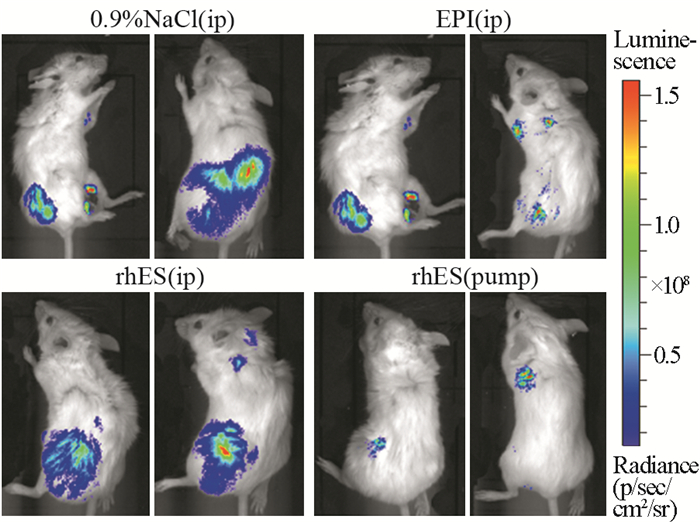
|
| 图 5 各治疗方案对肿瘤转移的影响(治疗结束时) Figure 5 Effects of different therapeutic schedules on tumor metastasis (at the end of treatment) |
早在1971年Folkman首次提出了实体瘤的生长、侵袭和转移依赖于新生血管的生成,阻断肿瘤血管生成能够有效地抑制肿瘤生长[12],肿瘤血管生成是一个复杂的过程,受多种促血管生成因子和抗血管生成因子的双重调控。恩度作为我国学者自主研发的一种新型重组人血管内皮抑素,临床上主要用于治疗非小细胞肺癌。在体内外实验中,目前已有一些研究表明恩度联合化疗对乳腺癌治疗有效,程丽等[13]研究表明重组人血管内皮抑素与NP方案联合化疗能抑制人乳腺癌细胞MCF-7移植瘤生长及新生血管生成;饶明月等[14]体外实验表明联合应用小剂量紫杉醇可明显抑制乳腺癌MCF-7细胞生长及其VEGF的表达,刘文稚等[15]表明恩度联合应用人参皂甙Rg3对抑制裸鼠乳腺癌移植瘤的血管生成具有协同作用,可有效抑制肿瘤生长,最近王晓利等[16]则发现与紫杉醇联合应用会诱导乳腺癌细胞株SK-BR-3的凋亡;另外,一些来源于临床观察的数据亦表明,恩度联合NP方案治疗晚期乳腺癌可提高NP方案疗效,未增加不良反应,安全性好,并可改善患者的生活质量[17],联合GP方案治疗转移性三阴性乳腺癌患者疗效较好,可延长患者生存时间,不良反应无明显增加[18]。此外,在一项前瞻性随机对照的Ⅱ期临床试验中[19],相较于标准的DE(多烯紫杉醇+表阿霉素)方案,乳腺癌患者采用恩度联合多烯紫杉醇和表阿霉素的新辅助化疗方案,肿瘤治疗有效率较高且不增加毒性。
本实验采用小鼠乳腺癌细胞株4T1荷瘤BALB/c小鼠,构建了乳腺癌动物模型,与MCF-7、MDA-MB-231等乳腺癌细胞荷瘤小鼠的模型相比较,本研究中,表阿霉素的治疗效果不佳,不能明显抑制肿瘤的生长,可能与4T1细胞恶性程度高,是BALB/c小鼠乳腺直接来源的鼠源乳腺癌细胞,成瘤后当肿瘤生长到一定大小,肿瘤体积成倍数增长,药物已完全不能压制肿瘤的生长。本研究表明,恩度联合表阿霉素可减缓4T1移植瘤的生长,当使用恩度微量泵联合表阿霉素腹腔注射时,虽其治疗效果仅略优于双药联合腹腔注射,但不良反应却略低,另外,恩度单用微量泵入疗效显著优于腹腔注射,且抑制了肿瘤的转移。本实验样本量少,结果有待扩大样本量重复实验后再作讨论。
重组人血管内皮抑素为内源性血管生成抑制剂,动物实验表明,内皮抑素能阻断内皮细胞体外增殖、迁移和组织新生血管的形成,并抑制原发肿瘤和继发转移瘤的血管生成和生长[20]。有研究表明恩度在37℃以下药理性能比较稳定,检测其内皮抑素蛋白含量直至第7天仍无明显降解,为恩度持续泵入提供了药理学依据[21]。其次,恩度的抗肿瘤作用具有浓度依赖性和时间依赖性,随着血药浓度的逐渐提高,其抗肿瘤效果也显著提高。Kisker等[21]研究发现,通过微型渗透泵持续给药能使血药浓度长时间保持稳定,当恩度泵入剂量达到每天6 mg/kg时就已经显著抑制了胰腺癌移植瘤的生长,优于每天20 mg/kg腹腔注射时的疗效。此外,张弛等[7]研究显示相较于恩度静脉滴注,持续静脉泵入能更明显的降低血清VEGF的水平,这可能由于恩度持续的泵入给药,使药物能够持续作用于新生血管的内皮细胞,从而取得更好的抑瘤效果。
CECs(循环内皮细胞)可以作为“血管正常化窗口期”的生物标志物,Li等[22]报道恩度可以通过调控促血管生成因子和抗血管生成因子,在治疗后第7~10天暂时使得肿瘤血管正常化。在窗口期,抗血管生成药物联合化疗可发挥显著协同效应,所以这也指导了将来的实验应进一步摸索恩度微量泵入促进血管正常化的窗口期,在此期间联合表阿霉素可能有望进一步改善肿瘤治疗效果。本研究有望用于指导临床上治疗乳腺癌患者,当需联合使用重组人血管内皮抑素时,可考虑采用微量泵给药,患者可携带泵回家治疗,不需住院,连续14天静脉滴注,缩短了住院周期,降低了医疗费用,也略减轻了药物所带来的不良反应,本实验为临床开展乳腺癌患者携泵回家治疗的可能性提供了实验依据,但仍需更多的临床试验加以证实。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | Ribatti D, Nico B, Ruggieri S, et al. Angiogenesis and Antiangiogenesis in Triple-Negative Breast cancer[J]. Transl Oncol, 2016, 9(5): 453–7. DOI:10.1016/j.tranon.2016.07.002 |
| [3] | Baronzio G, Parmar G, Baronzio M. Overview of Methods for Overcoming Hindrance to Drug Delivery to Tumors, with Special Attention to Tumor Interstitial Fluid[J]. Front Oncol, 2015, 5: 165. |
| [4] | Azzi S, Hebda JK, Gavard J. Vascular permeability and drug delivery in cancers[J]. Front Oncol, 2013, 3: 211. |
| [5] | Dong X, Zhao X, Xiao T, et al. Endostar, a recombined humanized endostatin, inhibits lymphangiogenesis and lymphatic metastasis of Lewis lung carcinoma xenograft in mice[J]. Thorac Cardiovasc Surg, 2011, 59(3): 133–6. DOI:10.1055/s-0030-1250152 |
| [6] | Li XQ, Shang BY, Wang DC, et al. Endostar, a modified recombinant human endostatin, exhibits synergistic effects with dexamethasone on angiogenesis and hepatoma growth[J]. Cancer Lett, 2011, 301(2): 212–20. DOI:10.1016/j.canlet.2010.12.004 |
| [7] | 张弛, 邓文英, 李宁, 等. 恩度不同给药途径联合TP方案治疗进展期卵巢癌的临床观察[J]. 肿瘤防治研究, 2016, 43(1): 54–7. [ Zhang C, Deng WY, Li N, et al. Different administration ways of endostar combined with TP regimen on advanced ovarian cancer patients[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(1): 54–7. ] |
| [8] | 孙翠平. 恩度不同给药方式联合化疗治疗晚期胃癌的临床研究[D]. 青海大学, 2016. [ Sun CP. Clinical observation of endostar deliveried by different ways combined with chemotherapy in treatment of advanced gastric cancer[D]. Qinghai Da Xue, 2016. ] |
| [9] | 苏进, 许新华, 史克志, 等. 持续静脉泵注恩度联合SOX方案治疗原发性肝癌[J]. 实用医学杂志, 2016, 32(17): 2908–11. [ Su J, Xu XH, Shi KZ, et al. Clinical efficacy of combination therapy with continuous intravenous pumping of Endostar and SOX regimen in advanced primary carcinoma of the liver[J]. Shi Yong Yi Xue Za Zhi, 2016, 32(17): 2908–11. DOI:10.3969/j.issn.1006-5725.2016.17.037 ] |
| [10] | 任国秀, 雍定丽. 持续静脉泵注恩度联合化疗治疗晚期非小细胞肺癌不良反应的临床观察及护理[J]. 齐齐哈尔医学院学报, 2016, 37(26): 3336–8. [ Ren GX, Yong DL. Clinical observation and nursing care of continuous intravenous infusion of Endostar combined with chemotherapyin treatment of advanced non-small cell lung cancer[J]. Qiqihar Yi Xue Yuan Xue Bao, 2016, 37(26): 3336–8. ] |
| [11] | 苏乔, 林颖, 李雯雯, 等. 乳腺癌BALB/c小鼠生物发光活体成像和小动物18F-FDG PET/CT成像的比较研究[J]. 中华普通外科学文献(电子版), 2017, 11(1): 18–22. [ Su Q, Lin Y, Li WW, et al. Comparison between bioluminescent imaging and small-animal 18F-FDG PET/CT in BALB/c mice with breast cancer[J]. Zhonghua Pu Tong Wai Ke Xue Wen Xian(Dian Zi Ban), 2017, 11(1): 18–22. ] |
| [12] | Folkman J. Tumor angiogenesis: therapeutic implications[J]. N Engl J Med, 1971, 285(21): 1182–6. DOI:10.1056/NEJM197111182852108 |
| [13] | 程丽, 张幸平, 杨鸿捷, 等. 重组人血管内皮抑素联合NP方案对人乳腺癌裸鼠移植瘤作用的实验研究[J]. 重庆医科大学学报, 2011, 36(5): 546–9. [ Cheng L, Zhang XP, Yang HJ, et al. Experimental study of recombinant human endostatin combined with NVB-Cisplatin on human breast cancer xenografts in nude mice[J]. Chongqing Yi Ke Da Xue Xue Bao, 2011, 36(5): 546–9. ] |
| [14] | 饶明月, 张幸平, 程丽, 等. 小剂量紫杉醇联合重组人血管内皮抑素对乳腺癌MCF-7细胞抑制作用的实验研究[J]. 重庆医科大学学报, 2011, 36(11): 1335–8. [ Rao MY, Zhang XP, Cheng L, et al. Inhibitory effect of low-dose paclitaxel combined with recombinant human endostatin on breast cancer MCF-7 cell line[J]. Chongqing Yi Ke Da Xue Xue Bao, 2011, 36(11): 1335–8. DOI:10.3969/j.issn.0253-3626.2011.11.016 ] |
| [15] | 刘文稚, 李孟考, 陈祥明. 重组人血管内皮抑素联合人参皂甙Rg3抑制裸鼠乳腺癌新生血管的动物实验研究[J]. 中华临床医师杂志, 2015, 9(6): 947–51. [ Liu WZ, Li MK, Chen XM. The animal research of endostar combined with Rg3 on inhibiting angiogenesis in xenograft model of breast cancer[J]. Zhonghua Lin Chuang Yi Shi Za Zhi, 2015, 9(6): 947–51. ] |
| [16] | 王晓利, 王晓成, 徐晓明, 等. 联合应用重组人血管内皮抑素与紫杉醇对乳腺癌细胞株SK-BR-3诱导凋亡作用研究[J]. 河北医学, 2017, 23(7): 1091–4. [ Wang XL, Wang XC, Xu XM, et al. Apoptosis induced by recombinant human endostatin and paclitaxel in breast cancer cell line SK-BR-3[J]. Hebei Yi Xue, 2017, 23(7): 1091–4. ] |
| [17] | 王彦荣, 李沛, 席妍, 等. 重组人血管内皮抑素联合NP方案治疗晚期乳腺癌临床观察[J]. 中外医疗, 2013, 26: 5–6, 8. [ Wang YR, Li P, Xi Y, et al. Clinical Observation of the Therapeutic Effect of Rh-endostatin (Edostar, YH-16) Combined with Vinorelbine and Cisplatin on Terminal Breast Cancer[J]. Zhong Wai Yi Liao, 2013, 26: 5–6, 8. ] |
| [18] | 张宁玲, 李秋梅. 重组人血管内皮抑素联合吉西他滨顺铂方案治疗转移性三阴性乳腺癌的疗效观察[J]. 中国肿瘤临床与康复, 2014, 21(4): 436–9. [ Zhang NL, Li QM. Observation on the effects of recombinant human endostatin combined with GP regimen in the treatment ofmetastatic three negative breast cancer[J]. Zhongguo Zhong Liu Lin Chuang Yu Kang Fu, 2014, 21(4): 436–9. ] |
| [19] | Chen J, Yao Q, Li D, et al. Neoadjuvant rh-endostatin, docetaxel and epirubicin for breast cancer: efficacy and safety in a prospective, randomized, phase Ⅱ study[J]. BMC Cancer, 2013, 13: 248. DOI:10.1186/1471-2407-13-248 |
| [20] | O' reilly MS, Boehm T, Shing Y, et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth[J]. Cell, 1997, 88(2): 277–85. DOI:10.1016/S0092-8674(00)81848-6 |
| [21] | Kisker O, Becker CM, Prox D, et al. Continuous administration of endostatin by intraperitoneally implanted osmotic pump improves the efficacy and potency of therapy in a mouse xenograft tumor model[J]. Cancer Res, 2001, 61(20): 7669–74. |
| [22] | Li N, Zheng D, Wei X, et al. Effects of recombinant human endostatin and its synergy with cisplatin on circulating endothelial cells and tumor vascular normalization in A549 xenograft murine model[J]. J Cancer Res Clin Oncol, 2012, 138(7): 1131–44. DOI:10.1007/s00432-012-1189-z |
 2018, Vol. 45
2018, Vol. 45


