文章信息
- 残肝体积/体重比率预测肝癌合并肝硬化患者术后肝功能衰竭的研究
- Clinical Investigation of Remnant Liver Volume-to-Body Weight Ratio in Predicting Post-hepatectomy Liver Failure in Patients with Hepatocellular Carcinoma in Cirrhotic Liver
- 肿瘤防治研究, 2018, 45(2): 77-81
- Cancer Research on Prevention and Treatment, 2018, 45(2): 77-81
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1316
- 收稿日期: 2017-10-19
- 修回日期: 2017-12-20
2. 530021 南宁,广西肝癌诊疗工程技术研究中心;
3. 537100 贵港,贵港市人民医院肝胆胰血管外科
2. Guangxi Liver Cancer Diagnosis and Treatment Engineering and Technology Research Center, Nanning 530021, China;
3. Department of Hepatobiliary Pancreatic and Vascular Surgery, Guigang People's Hospital, Guigang 537100, China
肝部分切除术是肝细胞性肝癌(hepatocellular carcinoma, HCC)患者首选且有效的治疗方法。随着手术适应证的不断扩大,肝功能衰竭(post-hepatectomy liver failure, PHLF)是肝切除术后严重并发症之一,术后PHLF的死亡率可高达30%[1-3]。随着术前评估体系的完善、手术技巧以及围手术期管理水平等的提升,PHLF死亡率目前控制在0~6.2%之间[4-5]。然而,PHLF仍然是发生率在1.2%~32%不等[3, 6-7]的常见并发症。
螺旋CT测定残肝体积(remnant liver volume, RLV)是最为实用且有效的术前评估和术后预测PHLF的方法。残肝分数(remnant liver volume-to-total liver volume, RLV%)是研究较多、公认的判断术后残肝体积大小的指标。Shoup等[8]通过CT测定体积研究发现术前RLV% < 25%的患者90%术后会发生PHLF,而术前RLV% > 25%的患者术后未发生PHLF,RLV%是预测PHLF的敏感指标。正常肝脏要求RLV%在20%~25%,而对于合并肝纤维化、脂肪肝、肝硬化等背景的患者RLV%应不低于30%~40%,甚至有RLV%不小于50%的报道[9-10]。
然而,国内外学者研究发现残肝体积/体重比率(remnant liver volume-to-body weight ratio, RLV-BWR)较RLV%预测术后PHLF具有更高的敏感度及特异性,对肝大部分切除术的安全切除范围具有重要参考价值[11-12]。但这些研究对象的肝脏背景不一致,RLV-BWR安全切除范围尚无统一认识标准。本研究结合我国是乙肝病毒相关性HCC高发地区的特点,旨在为乙肝肝硬化背景下肝切除术后RLV-BWR安全临界值及其对PHLF效能方面的评估提供参考。
1 资料与方法 1.1 临床资料选取2013年9月—2016年8月在广西肝癌诊疗工程技术研究中心行半肝切除以及扩大半肝切除术的181例乙肝病毒相关性HCC患者,其中男158例,女23例,年龄20~72岁,中位年龄47岁。
纳入标准:(1)HBsAg阳性;(2)行半肝切除术者; (3)术后病理证实为HCC。排除标准:(1)术前合并胆道梗阻或肝门部胆管癌患者;(2)术前行化疗、介入治疗或放化疗者; (3)二次手术者;(4)糖尿病、HIV感染、酒精性肝硬化或合并其他肝炎病毒感染者;(5)同期患有其他恶性肿瘤或严重疾病者。术前Child-Pugh肝功能分级均为A级。行左半肝切除67例,扩大左半肝切除14例;右半肝切除98例,扩大右半肝切除2例。
术后肝功能衰竭定义:参照“50-50”标准[13]:术后第5天凝血酶原活动度(PT%) < 50%(或国际标准化比率(internation normalized ratio, INR) > 1.7)及总胆红素(TBIL) > 50 μmol/L(> 2.9 mg/dl)。肝硬化定义:参照中国2000年慢性病毒性肝炎组织学分级和分期标准[14],术后病理肝纤维化S4定义为肝硬化,S1-3为肝纤维化,分成肝硬化组及无肝硬化组。RLV-BWR计算公式: RLV-BWR=RLV/BW=模拟测量RLV/BW。肝硬化背景评估参照涂氏等[15]提出的肝硬化常规CT形态学分级方法。
1.2 方法 1.2.1 术前检查指标术前常规行肝、肾功能、凝血功能、乙肝五项、甲胎蛋白(AFP)、乙肝DNA测定(HBV-DNA),肝纤维化四项等实验室辅助检查。采用128排螺旋CT行上腹部CT薄层增强扫描,术前两名医师采用法国Myrian-Liver手术规划系统进行手术模拟切除,测算出肝脏总体积(total liver volume, TLV)、肿瘤体积(tumor volume, TV)、预切除正常肝体积及RLV,最终值采用二者平均值,差异较大时由第3名医师进行测算,最终商量决定。
1.2.2 术中测量指标术中按照标准半肝切除术的标准(沿着下腔静脉至胆囊底方向为肝切除线),显露肝中静脉全程,详细手术流程及围手术期管理参照本中心前期研究[16]。术中标本离体后采用排水法测量体积(结果精确到1 ml),标本体积包括肿瘤和切除的正常肝组织。
1.2.3 术后检查指标测定术后1、3、5、7天血常规、肝、肾功能、凝血功能。回顾性分析肝硬化组患者CT资料并进行形态学分级,评估患者肝硬化程度。记录90天PHLF相关死亡病例数。根据“50-50”标准分为肝衰竭组及无肝衰竭组;根据术后病理分为肝硬化组及无肝硬化组。
1.3 统计学方法采用SPSS17.0进行统计分析,计量资料以(x±s)表示,两组间均数比较采用t检验; 计数资料比较采用χ2检验; 等级资料、计数资料不呈正态分布或方差不齐时采用秩和检验; 多因素分析采用Logistic回归分析;相关性分析采用Pearson检验。采用MedCalc.9.2统计软件进行ROC曲线分析。P < 0.05为差异有统计学意义。
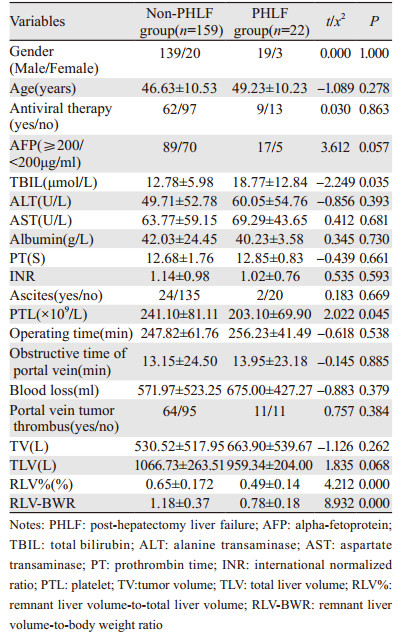
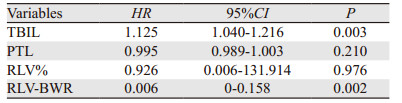
2 结果 2.1 两组基线资料比较肝衰竭组与无肝衰竭组在性别、年龄、AFP、HBV-DNA、手术时间、肿瘤大小、肝门阻断时间、术中出血量等方面比较,差异均无统计学意义(P > 0.05),术前总胆红素、术前血小板、RLV%及RLV-BWR差异有统计学意义(P < 0.05),见表 1。多因素分析显示,术前总胆红素及RLV-BWR是半肝切除术后发生肝功能衰竭的风险因素(P < 0.05),见表 2。
|
|
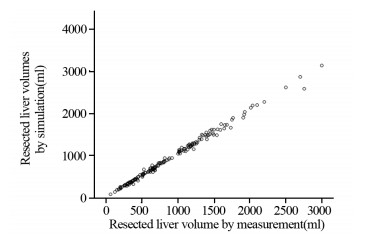
模拟切除的肝脏体积与排水法测量切除标本体积(均含肿瘤和切除的正常肝组织体积)分别为(941.74±582.71)ml和(890.43±42.41)ml,两者比较差异无统计学意义(t=-0.845, P=0.399)。相关性分析显示两者呈正相关性(r=0.992, P < 0.001),见图 1。
|
| 图 1 模拟切除肝脏体积与排水法测量切除标本体积相关分析 Figure 1 Correlation analysis of resected liver volumes between simulation and real measurement |
根据术后有无发生PHLF分为肝衰竭组22例及无肝衰竭组159例,肝衰竭发生率为12.2%(22/181),其中90天内因肝衰竭死亡1例,肝衰相关死亡率4.5%(1/22)。
按照肝硬化病理分级分成肝硬化组102例及无肝硬化组79例,肝硬化组中18例发生PHLF(17.6%),无肝硬化组中4例发生PHLF(5.0%),肝硬化患者更易发生PHLF(χ2=5.477, P=0.019)。
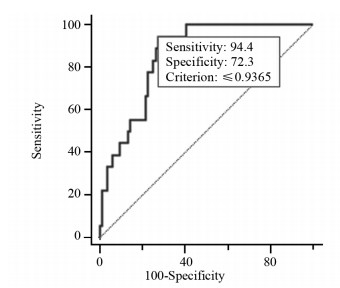
肝硬化组90天内肝衰相关死亡率5.6%(1/18)。ROC曲线分析,肝硬化肝切除RLV-BWR的安全临界值为0.94%(曲线下面积0.853, P < 0.01,敏感度94.4%,特异性72.3%),见图 2。无肝硬化组中发生PHLF为4例,发生例数少,需进一步纳入更多半肝切除患者进行分析。
|
| 图 2 肝硬化组RLV-BWR与PHLF相关性ROC曲线(area under curve (AUC): 0.853, P < 0.01) Figure 2 ROC curve analysis of RLV-BWR on PHLF in cirrhotic liver (AUC: 0.853, P < 0.01) |
按照涂氏等[15]提出的CT肝硬化分级方法评估患者的肝硬化程度,见表 3。肝硬化患者CT评级Ⅰ~Ⅱ级84例,Ⅲ级18例,Ⅳ级0例。
PHLF是肝切除术后严重并发症之一,其诊断标准一直是肝部分切除术后争议的焦点问题,不同的研究中心采用不同的PHLF标准,目前应用比较广泛的是Balzan等[13]提出的“50-50标准”以及国际肝脏外科研究小组提出的ISGLS肝衰标准[3]。PHLF的高危因素包括了患者的自身因素、肝硬化程度、术中因素、围手术期管理等,因此术后PHLF的发生率及死亡率亦各有不同[17]。目前预测残肝功能主要从残肝体积及其功能方面评估,螺旋CT或MRI能更客观、更精准评价剩余功能性肝体积(functional liver volume, FLV)[18]。目前普遍认为对于正常肝、脂肪肝、肝硬化患者的FLV分别不能小于20%、30%、40%,否则发生PHLF的风险明显增高[19]。相关研究主要集中在RLV%的研究方面,对于RLV与体重关系的研究较少。
本研究纳入181例半肝切除患者,软件模拟切除肝脏体积平均比排水法测量切除标本体积大51.31 ml(P < 0.05),体积差异考虑与以下因素有关:(1)模拟切除线不一定能完全与术中实际切除线一致(为减少这一误差,本研究选择半肝切除这类误差更小的规则性肝切除术作为研究对象);(2)切除下来的肝组织内血液流失致其体积缩小;(3)模拟切除结果包含手术切面的体积,而实际切肝手术中的切面肝组织已在术中被吸引器吸走,从而共同导致排水法测定的标本体积偏小。
本研究术后PHLF发生率为12.2%(22/181),较其他研究结果偏低[20]。PHLF相关死亡率为4.5%(1/22),与其他研究的结果相似[3, 6-7]。术前胆红素含量及RLV-BWR是半肝切除术后发生PHLF的风险因素(P < 0.05)。对术后肝硬化的病理诊断进行亚组分析,结果显示肝硬化患者更易发生术后PHLF,肝硬化组肝衰竭发生率为17.6%(18/102),肝衰死亡率为5.6%(1/18)。ROC曲线结果显示肝硬化患者肝切除RLV-BWR的安全临界值为0.94%(曲线下面积=0.853,P < 0.01,敏感度94.4%,特异性72.3%),研究发现肝切除术后RLV-BWR≤0.94%的肝硬化患者术后发生PHLF的风险明显增高。
Truant等[11]分析31例无肝硬化的右半肝切除患者,研究结果显示RLV-BWR≤0.5%者术后发生PHLF的风险明显高于 > 0.5%者。Chun等[21]纳入68例无肝硬化患者,结果显示RLV/BWR < 0.4%为术后PHLF的安全临界值(ROC曲线面积=0.84,95%CI: 0.71~0.97)。而关于肝硬化的国内外研究甚少,国内Lin等[12]研究纳入31例肝硬化患者结果显示RLV-BWR≤1.4%可预测术后PHLF的发生(AUC=0.864,敏感度70%,特异性95%)。然而,以上研究纳入的病例缺少术后病理证实,样本量相对较小,且术前无法测定RLV,给临床应用带来一定的限制,该研究与本研究结果相差较大,可能与肝硬化程度、纳入标准以及样本量差异等有密切关系。
本研究对术后病理诊断肝硬化患者进行CT回顾性分析发现,接受半肝切除手术的患者肝硬化程度CT分级主要为Ⅰ~Ⅱ级,少数为Ⅲ级。更好的为临床提供了参考价值。然而,本研究肝硬化患者无Ⅳ级肝硬化,这主要与纳入的标准以及重度肝硬化患者无法耐受手术切除有关。因此,本研究得出肝硬化组的安全临界值,不适用于重度肝硬化的肝切术安全性评价。
本研究尚存在以下局限性:(1)术后发生PHLF例数不够多;(2)CT评估肝硬化程度缺乏国际公认标准;(3)术后病理诊断肝硬化只提供了某个区域的硬化程度,而无法充分评估整体肝脏的硬化程度;(4)本研究只考虑了与体重的关系,未考虑到不同性别的体表面积差异可能所带来的影响以及不同年龄阶段的肝细胞再生能力所带来的影响[22]。
总之,术前对残肝体积进行精准全面的评估是降低术后PHLF发生的前提。RLV-BWR能有效预测轻中度肝硬化患者术后PHLF的发生,RLV-BWR≤0.94%,术后发生PHLF的风险增高,本研究结果可为临床提供参考。
| [1] | Smith JJ, D'Angelica MI. Surgical Management of Hepatic Metastases of Colorectal Cancer[J]. Hematol Oncol Clin North Am, 2015, 29(1): 61–84. DOI:10.1016/j.hoc.2014.09.003 |
| [2] | Zhong JH, Rodríguez AC, Ke Y, et al. Hepatic Resection as a Safe and Effective Treatment for Hepatocellular Carcinoma Involving a Single Large Tumor, Multiple Tumors, or Macrovascular Invasion[J]. Medicine (Baltimore), 2015, 94(3): e396. DOI:10.1097/MD.0000000000000396 |
| [3] | Rahbari NN, Garden OJ, Padbury R, et al. Posthepatectomy liver failure: A definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. Surgery, 2011, 149(5): 713–24. DOI:10.1016/j.surg.2010.10.001 |
| [4] | Lafaro K, Buettner S, Maqsood H, et al. Defining Post Hepatectomy Liver Insufficiency: Where do We stand?[J]. J Gastrointest Surg, 2015, 19(11): 2079–92. DOI:10.1007/s11605-015-2872-6 |
| [5] | Hyder O, Pulitano C, Firoozmand A, et al. A Risk Model to Predict 90-Day Mortality among Patients Undergoing Hepatic Resection[J]. J Am Coll Surg, 2013, 216(6): 1049–56. DOI:10.1016/j.jamcollsurg.2013.01.004 |
| [6] | Jaeck D, Bachellier P, Oussoultzoglou E, et al. Surgical resection of hepatocellular carcinoma. Post-operative outcome and long-term results in Europe: An overview[J]. Liver Transpl, 2004, 10(2Suppl 1): S58–63. |
| [7] | Paugam-Burtz C, Janny S, Delefosse D, et al. Prospective Validation of the "Fifty-Fifty" Criteria as an Early and Accurate Predictor of Death After Liver Resection in Intensive Care Unit Patients[J]. Ann Surg, 2009, 249(1): 124–8. DOI:10.1097/SLA.0b013e31819279cd |
| [8] | Shoup M, Gonen M, D'Angelica M, et al. Volumetric Analysis Predicts Hepatic Dysfunction in Patients Undergoing Major Liver Resection[J]. J Gastrointest Surg, 2003, 7(3): 325–30. DOI:10.1016/S1091-255X(02)00370-0 |
| [9] | Abdalla EK, Barnett CC, Doherty D, et al. Extended hepatectomy in patients with hepatobiliary malignancies with and without preoperative portal vein embolization[J]. Arch Surg, 2002, 137(6): 675–80. DOI:10.1001/archsurg.137.6.675 |
| [10] | 朱化刚. 术前肝脏储备功能的判断与安全肝切除量[J]. 肝胆外科杂志, 2005, 13(6): 406–9. [ Zhu HG. Preoperative evaluation of liver reserve function and the safety volume or hepatectomy[J]. Gan Dan Wai Ke Za Zhi, 2005, 13(6): 406–9. ] |
| [11] | Truant S, Oberlin O, Sergent G, et al. Remnant Liver Volume to Body Weight Ratio≥0.5%: A New Cut-Off to Estimate Postoperative Risks after Extended Resection in Noncirrhotic Liver[J]. J Am Coll Surg, 2007, 204(1): 22–23. DOI:10.1016/j.jamcollsurg.2006.09.007 |
| [12] | Lin X, Yang J, Chen XB, et al. The critical value of remnant liver volume-to-body weight ratio to estimate posthepatectomy liver failure in cirrhotic patients[J]. J Surg Res, 2014, 188(2): 489–95. DOI:10.1016/j.jss.2014.01.023 |
| [13] | Balzan S, Belghiti J, Farges O, et al. The "50-50 Criteria" on Postoperative Day 5: An Accurate Predictor of Liver Failure and Death After Hepatectomy[J]. Ann Surg, 2005, 242(6): 828–9. |
| [14] | 中华医学会传染病与肝病学分会. 病毒性肝炎防治方案[J]. 中华肝脏病杂志, 2000, 8(6): 324–9. [ Branch of the Chinese Medical Association for infectious diseases and liver diseases. prevention and treatment of viral hepatitis[J]. Zhonghua Gan Zang Bing Za Zhi, 2000, 8(6): 324–9. ] |
| [15] | 涂蓉, 张阳德, 伍保忠, 等. 肝硬化CT分级方法研究[J]. 放射学实践, 2003, 18(9): 621–3. [ Tu R, ZHANG YD, WU BZ, et al. Study of CT grading of liver cirrhosis[J]. Fang She Xue Shi Jian, 2003, 18(9): 621–3. ] |
| [16] | Steger U, Kellersmann A, Germer CT. Hemihepatectomy[J]. Zentralbl Chir, 2016, 141(3): 253–5. DOI:10.1055/s-00000104 |
| [17] | van den Broek MA, Olde Damink SW, Dejong CH, et al. Liver failure after partial hepatic resection: definition, pathophysiology, risk factors and treatment[J]. Liver Int, 2008, 28(6): 767–80. DOI:10.1111/j.1478-3231.2008.01777.x |
| [18] | D'Onofrio M, De Robertis R, Demozzi E, et al. Liver volumetry: Is imaging reliable? Personal experience and review of the literature[J]. World J Radiol, 2014, 6(4): 62–71. DOI:10.4329/wjr.v6.i4.62 |
| [19] | Asencio JM, García Sabrido JL, Olmedilla L. How to expand the safe limits in hepatic resections?[J]. J Hepatobiliary Pancreat Sci, 2014, 21(6): 399–404. DOI:10.1002/jhbp.2014.21.issue-6 |
| [20] | Shah SA, Bromberg R, Coates A, et al. Survival after Liver Resection for Metastatic Colorectal Carcinoma in a Large Population[J]. J Am Coll Surg, 2007, 205(5): 676–83. DOI:10.1016/j.jamcollsurg.2007.06.283 |
| [21] | Chun YS, Ribero D, Abdalla EK, et al. Comparison of two methods of future liver remnant volume measurement[J]. J Gastrointest Surg, 2008, 12(1): 123–8. DOI:10.1007/s11605-007-0323-8 |
| [22] | Urata K, Kawasaki S, Matsunami H, et al. Calculation of child and adult standard liver volume for liver transplantation[J]. Hepatology, 1995, 21(5): 1317–21. DOI:10.1002/(ISSN)1527-3350 |
 2018, Vol. 45
2018, Vol. 45



