文章信息
- 预防性放疗降低恶性胸膜间皮瘤有创操作通道转移发生率的Meta分析
- Prophylactic Radiotherapy for Procedure Tract Metastases in Malignant Pleural Mesothelioma: A Meta-analysis
- 肿瘤防治研究, 2018, 45(5): 289-294
- Cancer Research on Prevention and Treatment, 2018, 45(5): 289-294
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1267
- 收稿日期: 2017-10-09
- 修回日期: 2018-01-31
恶性胸膜间皮瘤(malignant pleural mesothelioma, MPM)是一种原发于胸膜间皮组织的弥漫浸润性肿瘤,平均生存期8~14月[1]。石棉暴露被认为是发病的危险因素。MPM确诊主要依靠胸膜病理活检,典型病例表现为胸痛、呼吸困难以及恶性胸腔积液,因此许多患者要经历穿刺诊断以及胸腔积液管理,这些有创操作可能造成肿瘤细胞沿皮下通道医源性播散,即操作通道转移(procedure track metastases, PTMs),形成疼痛性皮下结节或肿瘤性皮肤溃疡,为MPM患者造成心理及生理的负面影响。1995年Boutin等[2]报道纳入40例MPM患者的小规模随机对照实验(randomized control trial, RCT),证明对穿刺部位进行预防性照射能明显降低PTMs发生率,此后MPM患者胸膜有创操作后进行预防性放疗得到广泛认可。然而,近年来不少临床研究未能证明预防性照射对降低PTMs发生率的有效性,常规进行穿刺部位预防性放疗存在争议。本研究采用Meta分析方法对现有RCT、队列研究进行全面评价,进一步明确预防性放疗对MPM患者PTMs发生率的影响。
1 资料与方法 1.1 检索策略以“malignant pleural mesothelioma、prophylactic radiotherapy、prophylactic radiation、prophylactic irradiation”为检索词在数据库PubMed、Cochrane Library、Web of Science、Embase中检索。检索截止时间为2017年8月。
1.2 纳入和排除标准纳入标准:(1)经病理学或细胞学检查确诊为MPM并接受过有创诊断、治疗操作的患者,年龄、性别、种族不限;(2)试验组为对患者穿刺部位进行局部预防性放疗,放疗方案不限;对照组未进行穿刺部位的预防性放疗;(3)报道了PTMs发生率、发生时间、疼痛、预防性放疗的不良反应、生存时间、生活质量等结局指标;(4)研究类型为RCT、队列研究,语言限定为英文。排除标准:(1)结局指标不明确的研究;(2)重复发表的研究。
1.3 数据提取依据纳入、排除标准,由两位研究者独立进行筛选文献及提取数据,提取的数据包括:(1)一般资料,包括题目、作者、发表时间及发表刊物等;(2)试验设计特征,包括研究对象的基本情况、各试验组基线可比性、干预措施、盲法、分配隐藏等;(3)PTMs发生率、不良反应(放射性皮炎、恶心、疼痛等)。如果遇到意见不一致的情况,则通过协商或者由第三位研究者来协助解决。
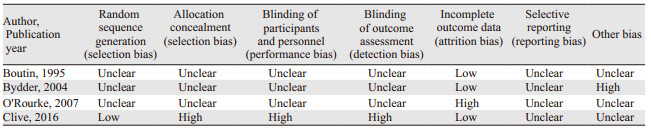
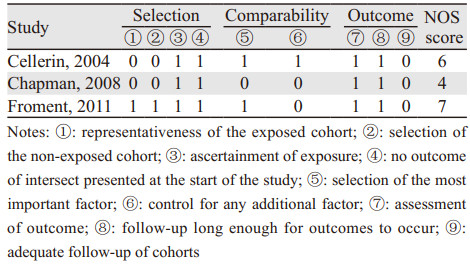
1.4 文献质量评价两位研究者独立按照Cochrane协作网推荐的风险偏倚评估工具对纳入的RCT进行质量评价[3],分为“低偏倚风险”、“高偏倚风险”、“偏倚风险不确定”三个等级。采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale, NOS)评价纳入队列研究的偏倚风险[4],满分为9分,1~4分为低质量,5~9分为高质量。如果遇到意见不一致的情况,则通过协商或者由第三位研究者来协助解决。
1.5 统计学方法采用Review Manager 5.3软件进行统计分析,二分类变量采用比值比(OR)为效应指标,连续变量采用均数差(MD)为效应指标,各效应量均给出其点估计值和95%置信区间(CI)。各纳入研究结果的异质性采用χ2检验,结合I2定量分析异质性大小:若有统计学同质性(P > 0.1或I2 < 50%),则采用固定效应模型,若异质性较大(P < 0.1或I2 > 50%),则分析异质性来源;若无临床异质性,采用随机效应模型。若有临床异质性,则进行亚组分析或敏感度分析。如两组间异质性过大或无法找寻数据来源时,采用描述性分析。用漏斗图分析潜在的发表偏倚。
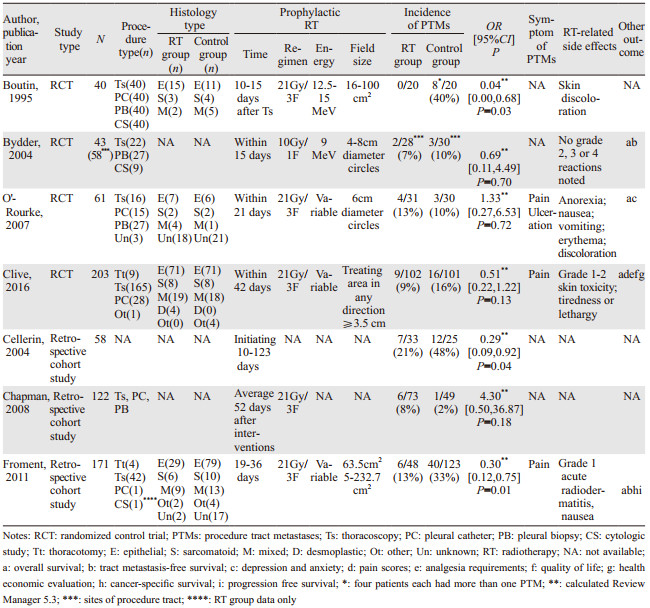
2 结果 2.1 纳入研究的基本特征及文献质量评价检索获得相关文献753篇,通过文献管理软件剔除重复文献后获得553篇,阅读题目及摘要排除非对照研究及干预措施等不符合纳入标准的文献542篇,初步获得11篇文献,阅读全文后排除不符合纳入标准5篇文献,由参考文献补充1篇文献,最终获得7篇文献(其中1篇仅获得英文摘要[5]),共4个RCT[2, 6-8]、3个队列研究[5, 9-10],共698例患者。文献筛选流程及结果见图 1。纳入的RCT整体质量不高:4个RCT均在文中提及了“随机”;仅有1个RCT[8]详细交代了随机及分配隐藏方式;有1个RCT[6]以操作部位作为样本进行随机分配及计算发生率;有1个RCT[7]失访率较高,仅41%的患者完成随访;其中有3个RCT[6-8]遵照意向性治疗原则。纳入队列研究的整体质量较高,其中2个队列研究[5, 10]大于5分,1个队列研究[9]为4分。纳入研究的基本特征见表 1。纳入研究偏倚风险评估见表 2~3。
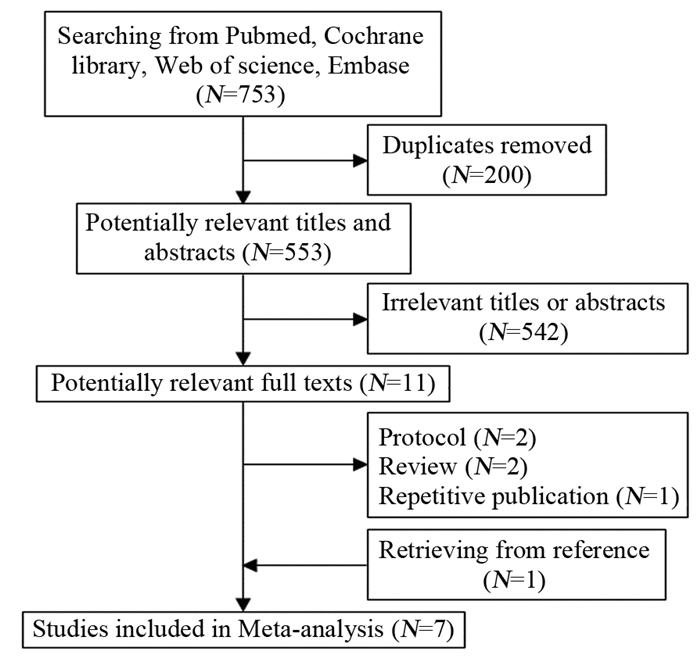
|
| 图 1 文献筛选流程及结果 Figure 1 Processes and results of literature screened |
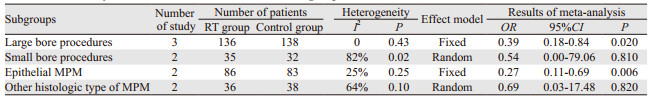
7个研究比较了放疗组与对照组的PTMs发生率,但由于Bydder等[6]的研究以操作部位作为样本进行随机分配及计算发生率,样本之间可能缺乏独立性,因此未将其结果进行合并分析,其余6个研究共655例患者。纳入研究结果间有统计学异质性(I2=51%, P=0.07),采用随机效应模型进行Meta分析,结果显示两组在PTMs发生率方面差异无统计学意义(OR=0.48, 95%CI: 0.22~1.07, P=0.07),提示预防性放疗对降低PTMs发生率无明显作用,见图 2。分析异质性原因,考虑为MPM患者胸膜有创操作类型以及肿瘤病理类型差异较大引起,进一步行亚组分析,见表 4。
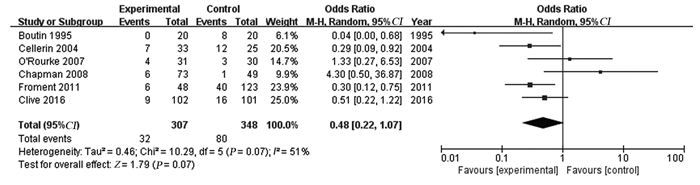
|
| 图 2 放疗组与对照组有创操作通道转移发生率 Figure 2 Incidence of PTMs in radiotherapy group and control group |
根据文献报道[8]对大、小口径有创操作进行了界定:大口径有创操作包括胸廓手术、胸腔镜操作、留置引流管等;小口径有创操作包括细针活检(fine needle aspiration)、胸膜活检(Abrams needle)、细胞学检查等。3个研究[2, 7-8]报道了274例进行大口径有创操作MPM患者PTMs的发生率。纳入研究结果间无统计学异质性(I2=0, P=0.43),固定效应模型分析显示两组在PTMs发生率方面差异有统计学意义(P=0.02),提示预防性放疗能有效降低进行大口径有创操作后PTMs发生率。
2.2.3 小口径有创操作的PTMs发生率2个研究[2, 7]报道了67例进行小口径有创操作的MPM患者PTMs的发生率,纳入研究结果间有高度异质性(I2=82%, P=0.02)。Boutin等[2]报道的40例MPM患者均进行细胞学检查以及胸膜活检,随访期间放疗组没有发生操作通道转移,对照组有7例转移。O' Rourke等[7]报道27例进行了胸膜活检,放疗组有3例患者发展为PTMs,均表现为无痛性皮下结节,其中1例患者在原穿刺部位出现皮肤溃疡,另外2例患者皮下结节较穿刺点有轻度移位,然而在对照组没有观察到PTMs。
2.2.4 上皮型MPM患者的PTMs发生率MPM常见病理类型有上皮型、肉瘤型以及混合型。2个研究[2, 8]报道了169例上皮型MPM患者PTMs的发生率。纳入研究结果间无统计学异质性(I2=25%, P=0.25),固定效应模型分析显示两组在PTMs发生率方面差异有统计学意义(OR=0.21, 95%CI: 0.11~0.69, P=0.006),提示上皮型MPM患者在胸膜有创操作后进行预防性放疗能有效降低PTMs发生率。
2.2.5 其他病理类型MPM患者的PTMs发生率2个研究[2, 8]报道了其他病理类型(包括肉瘤型、混合型、结缔组织增生型、其他或不详)MPM患者PTMs发生率(共74例患者),由于单一病理类型病例数量过少,因此作为整体进行合并,研究结果间有统计学异质性(I2=64%, P=0.10)。Boutin等[2]报道14例患者,放疗组(2例混合型、3例肉瘤型)没有PTMs。对照组中5例混合型患者发生3例转移,其中2例同时发生大、小口径操作通道转移,1例小口径操作通道转移;4例肉瘤型患者中发生1例小口径操作通道转移。Clive等[8]试验放疗组3例,对照组仅1例转移,并未详细报道转移患者的病理亚型。
2.3 发表偏倚对纳入研究进行漏斗图分析,结果显示漏斗图基本对称,提示无明显发表偏倚,见图 3。
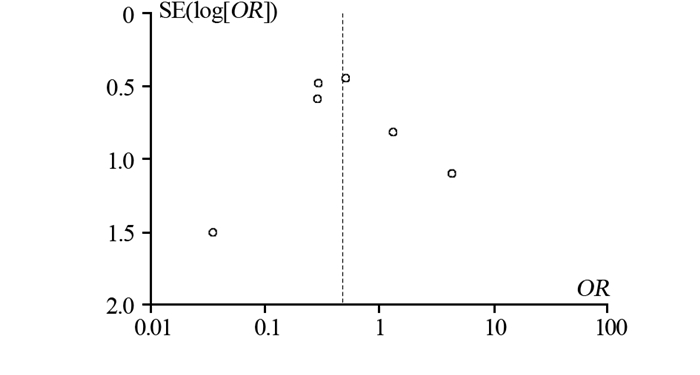
|
| 图 3 有创操作通道转移发生率的漏斗图 Figure 3 Funnel plot of PTMs |
MPM在CT下可表现为胸壁广泛增厚、结节状隆起,难以与结核性胸膜炎等病变区分,尽管正电子成像技术大大提高了MPM诊断的敏感度,确诊仍主要依靠胸膜病理诊断[11-12]。MPM晚期患者治疗以减少胸腔积液、缓解呼吸困难为主。绝大多数患者需要经历胸膜有创操作,由于肿瘤细胞在浆膜面呈平铺覆盖的形式生长,当医源性操作破坏肿瘤原来的覆盖模式,肿瘤沿有创操作通道由胸膜蔓延至皮下,或少许遗落在操作通道中的肿瘤细胞团以同样的生长方式重新铺满操作通道,形成PTMs[13]。不同操作导致PTMs发生率不同[14-16],小口径穿刺为4%,胸壁引流管为13.6%,胸腔镜检查为16%,开胸手术为24%。体外实验发现间皮瘤细胞对射线具有高敏感度,但受到肺脏放射毒性等限制,根治性半胸放疗多在胸膜外肺切除术后进行[17-18]。预防性照射范围局限、剂量较小,临床上相对安全可行。预防性放疗可在少量种植细胞形成克隆细胞团前将其杀灭;同时放疗后的组织纤维化、血管生成减少、供氧减少,使肿瘤细胞在恶劣的环境中难以定植[2]。然而,各试验关于预防性放疗能否降低PTMs发生率的结论不尽一致。目前有1篇综述[13]将3篇RCT的结果进行粗略合并,未能发现预防性放疗的有效性(χ2=2.61, P=0.11),但其未纳入队列研究及2016年新发表的文献,无法进行亚组分析,因此我们设计并实施了本Meta分析。
Meta分析显示预防性放疗不能降低所有MPM患者PTMs的发生率(OR=0.48, 95%CI: 0.22~1.07, P=0.07),但亚组分析发现预防性放疗能减少进行开胸手术、胸腔镜、留置胸壁引流管等大口径操作的MPM患者(OR=0.39, 95%CI: 0.18~0.84, P=0.02)或上皮型MPM患者(OR=0.21, 95%CI: 0.11~0.69, P=0.006)医源性PTMs的发生。原因分析:(1)由于操作口径越大,肿瘤细胞播散种植在皮肤到胸膜之间的通道的概率越大,数量越多,真实的转移发生率就越高,通过预防性照射可以减少局部转移的发生,结论与Clive等[8]研究中严格按照其草案标准排出少数患者后行治疗完成分析所得相符(OR=0.33, 95%CI: 0.09~1.00, P=0.037)。(2)不同病理类型间皮瘤细胞之间放疗敏感度可能存在差异,目前广泛应用的放疗方案(21 Gy/3F)未能对肉瘤型及混合型的种植肿瘤细胞形成致死性伤害。(3)由于MPM发病率较低,纳入RCT多为小样本量试验,试验之间异质性较大,有意义证据不足以掩盖没有意义的部分,出现总体合并没有统计学意义,但部分亚组有意义的结果。
有3个研究[7-8, 10]报道了PTMs的临床表现,主要为在操作部位原点或轻度移位的疼痛或无痛性皮下结节。O' Rourke等[7]研究中2例患者表现出疼痛性皮下结节,另有1例在原穿刺部位出现皮肤溃疡。Clive等[8]报道的疼痛性转移病例占所有PTMs的32%,疼痛视觉模拟评分3~6分,为中度疼痛[19]。Froment等[10]报道的疼痛性转移比例最高,占所有PTMs的74%,但未描述疼痛程度。
有5个研究[2, 6-8, 10]报道了预防性放疗的相关不良反应,近期主要表现为轻度放射性皮炎、疼痛、胸部不适、呕吐恶心纳差等胃肠道反应,未观察到远期不良反应。预防性照射相对安全,并发症可耐受。
对于纳入的研究,需特别指出:(1)Boutin等[2]试验中对照组转移率高达40%,相较于其他RCT转移率高出两倍多。此后顺铂加培美曲塞延长MPM患者生存时间[20];图像引导活检技术减少不必要的胸膜损伤。全身化疗以及图像引导活检技术可能减少转移[21],在此后的试验中转移率较低。(2)患者死亡是潜在的竞争风险因素,部分患者在随访期间病情迅速恶化甚至死亡,在RCT中可能造成较高失访率,在回顾性队列研究中可能存在未被记录的PTMs,尤其是没有症状的PTMs。
研究的局限性:(1)纳入研究数量较少、样本量小、质量偏低,亚组合并的文献数量较少,可能影响结论真实性;(2)本研究将RCT与队列研究结果同时合并,可能产生一定的偏倚;(3)所有纳入文献主要结局指标为PTMs,但极少进行病理证实,存在瘢痕形成被误认为肿瘤转移形成的皮下结节的可能性;(4)纳入研究的放疗方案存在差异,未区分不同放疗方案的有效性;(5)部分患者同时进行全身抗肿瘤治疗,可能对PTMs发生率造成影响。
综上,预防性放疗安全性较好,能有效预防开胸手术、胸腔镜、留置胸壁引流管等大口径操作或病理类型为上皮型MPM患者医源性PTMs的发生。受纳入研究数量和质量的限制,上述结论尚待更多高质量研究予以验证。建议今后研究明确操作通道转移的真实发生率,以及设置不同预防性照射方案之间的对照,便于为临床提供更为宝贵的证据。
| [1] | Bibby AC, Tsim S, Kanellakis N, et al. Malignant pleural mesothelioma: an update on investigation, diagnosis and treatment[J]. Eur Respir Rev, 2016, 25(142): 472–86. DOI:10.1183/16000617.0063-2016 |
| [2] | Boutin C, Rey F, Viallat JR. Prevention of malignant seeding after invasive diagnostic procedures in patients with pleural mesothelioma. A randomized trial of local radiotherapy[J]. Chest, 1995, 108(3): 754–8. DOI:10.1378/chest.108.3.754 |
| [3] | Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5. 1. 0[EB/OL]. http://handbook.cochrane.org. |
| [4] | GA Wells, B Shea, D O'Connell, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses[EB/OL]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. |
| [5] | Cellerin L, Garry P, Mahe MA, et al. Malignant pleural mesothelioma: radiotherapy for the prevention of seeding nodules[J]. Rev Mal Respir, 2004, 21(1): 53–8. DOI:10.1016/S0761-8425(04)71235-8 |
| [6] | Bydder S, Phillips M, Joseph DJ, et al. A randomised trial of single-dose radiotherapy to prevent procedure tract metastasis by malignant mesothelioma[J]. Br J Cancer, 2004, 91(1): 9–10. DOI:10.1038/sj.bjc.6601957 |
| [7] | O'Rourke N, Garcia JC, Paul J, et al. A randomised controlled trial of intervention site radiotherapy in malignant pleural mesothelioma[J]. Radiother Oncol, 2007, 84(1): 18–22. DOI:10.1016/j.radonc.2007.05.022 |
| [8] | Clive AO, Taylor H, Dobson L, et al. Prophylactic radiotherapy for the prevention of procedure-tract metastases after surgical and large-bore pleural procedures in malignant pleural mesothelioma (SMART): a multicentre, open-label, phase 3, randomised controlled trial[J]. Lancet Oncol, 2016, 17(8): 1094–104. DOI:10.1016/S1470-2045(16)30095-X |
| [9] | Chapman A, Mulrennan S, Ladd B, et al. Population based epidemiology and prognosis of mesothelioma in Leeds, UK[J]. Thorax, 2008, 63(5): 435–9. DOI:10.1136/thx.2007.081430 |
| [10] | Froment MA, Fréchette E, Dagnault A. Prophylactic irradiation of intervention sites in malignant pleural mesothelioma[J]. Radiother Oncol, 2011, 101(2): 307–10. DOI:10.1016/j.radonc.2011.08.038 |
| [11] | Sun Y, Yu H, Ma J, et al. The Role of 18F-FDG PET/CT Integrated Imaging in Distinguishing Malignant from Benign Pleural Effusion[J]. PLoS One, 2016, 11(8): e161764. |
| [12] | Husain AN, Colby TV, Ordóñez NG, et al. Guidelines for Pathologic Diagnosis of Malignant Mesothelioma: 2017 Update of the Consensus Statement From the International Mesothelioma Interest Group[J]. Arch Pathol Lab Med, 2018, 142(1): 89–108. DOI:10.5858/arpa.2017-0124-RA |
| [13] | Davies HE, Musk AW, Lee YC. Prophylactic radiotherapy for pleural puncture sites in mesothelioma: the controversy continues[J]. Curr Opin Pulm Med, 2008, 14(4): 326–30. DOI:10.1097/MCP.0b013e3282fcea50 |
| [14] | Agarwal PP, Seely JM, Matzinger FR, et al. Pleural mesothelioma: sensitivity and incidence of needle track seeding after image-guided biopsy versus surgical biopsy[J]. Radiology, 2006, 241(2): 589–94. DOI:10.1148/radiol.2412051020 |
| [15] | Metintas M, Ak G, Parspour S, et al. Local recurrence of tumor at sites of intervention in malignant pleural mesothelioma[J]. Lung Cancer, 2008, 61(2): 255–61. DOI:10.1016/j.lungcan.2007.12.022 |
| [16] | Thomas R, Budgeon CA, Kuok YJ, et al. Catheter tract metastasis associated with indwelling pleural catheters[J]. Chest, 2014, 146(3): 557–62. DOI:10.1378/chest.13-3057 |
| [17] | Matsuo Y, Shibuya K, Okubo K, et al. Long-term outcomes of intensity-modulated radiotherapy following extra-pleural pneumonectomy for malignant pleural mesothelioma[J]. Acta Oncol, 2017, 56(7): 957–62. DOI:10.1080/0284186X.2017.1279749 |
| [18] | Perrot M, Wu L, Wu M, et al. Radiotherapy for the treatment of malignant pleural mesothelioma[J]. Lancet Oncol, 2017, 18(9): e532–42. DOI:10.1016/S1470-2045(17)30459-X |
| [19] | Boonstra AM, Schiphorst Preuper HR, Balk GA, et al. Cut-off points for mild, moderate, and severe pain on the visual analogue scale for pain in patients with chronic musculoskeletal pain[J]. Pain, 2014, 155(12): 2545–50. DOI:10.1016/j.pain.2014.09.014 |
| [20] | Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase Ⅲ study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma[J]. J Clin Oncol, 2003, 21(14): 2636–44. DOI:10.1200/JCO.2003.11.136 |
| [21] | Bibby AC, Maskell NA. Pleural biopsies in undiagnosed pleural effusions; Abrams vs image-guided vs thoracoscopic biopsies[J]. Curr Opin Pulm Med, 2016, 22(4): 392–8. DOI:10.1097/MCP.0000000000000258 |
 2018, Vol. 45
2018, Vol. 45