文章信息
- 脊柱转移瘤治疗进展
- Progress of Treatment on Metastatic Spinal Tumors
- 肿瘤防治研究, 2018, 45(5): 337-342
- Cancer Research on Prevention and Treatment, 2018, 45(5): 337-342
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1262
- 收稿日期: 2017-10-09
- 修回日期: 2017-12-21
脊柱转移瘤的发病率为3%~30%,原发肿瘤以乳腺癌、肺癌、前列腺癌和肾癌为主[1]。脊柱转移瘤引起的疼痛、脊柱不稳定和神经症状,严重影响恶性肿瘤患者的生活质量。既往脊柱转移瘤的治疗主要分为手术治疗和保守治疗(放疗),治疗方式的选择建立在一系列预后评分系统的基础上,如Tomita评分、Tokuhashi评分、SINS评分等。立体定向体部放射治疗技术的出现,使得放射治疗对脊柱转移瘤的治疗效果得到很大的提升。但对于脊柱不稳定、已经出现脊髓压迫症的患者,外科手术仍是主要的有效治疗手段。目前,随着对恶性肿瘤基础、临床研究的不断深入,以及恶性肿瘤个体化治疗、外科新技术的不断涌现,临床医生能够更好的判断脊柱转移瘤患者的预后,并选择最佳的治疗方案[2-3]。本文对脊柱转移瘤治疗近5年研究进展进行综述。
1 放疗传统治疗中,放疗常常作为一种辅助治疗手段在手术治疗后实施。随着调强放射治疗(intensity-modulated radiation therapy, IMRT)、立体定向体部放射治疗(stereotactic body radiation therapy, SBRT)等新技术的出现,放疗在脊柱转移瘤治疗中的地位越发重要[4-5]。尤其对于脊柱没有明显不稳定或未出现脊髓压迫症的患者,放疗甚至可以取代外科手术,作为首选治疗方法。既往对放疗不敏感的肿瘤类型,如肾癌、肉瘤和黑色素瘤,SBRT也能够有效的抑制脊柱转移瘤局部进展,降低脊髓压迫症,脊柱不稳定的出现。此外,SBRT还能够有效的缓解晚期肿瘤患者的骨痛[6]。
Chang等[7]开展一项多中心研究,研究共入组60例(72处转移)脊柱转移瘤患者,采用SBRT治疗,平均剂量为24 Gy。平均随访2年,无局部进展生存率为76%。结果显示SBRT能够有效的控制脊柱转移瘤局部进展。但SBRT治疗脊柱转移瘤存在其局限性。van Velden等[8]对155例脊柱转移瘤患者进行研究,观察放疗对局部疼痛的缓解情况。结果显示,SINS评分是影响疼痛缓解的主要因素,SINS评分越高,疼痛缓解越差。因此,单纯SBRT推荐SINS评分小于6分的患者实施,SINS评分大于等于7分的患者应首选外科手术治疗。
2 开放手术技术传统开放手术治疗包括后路椎板切除减压、椎体部分切除、椎体分块或整块切除并实施椎弓根钉固定,维持脊柱稳定性。目前,开放手术仍是快速进展的脊柱转移瘤脊髓压迫症患者以及病理骨折风险高的溶骨性脊柱转移瘤患者的首选治疗方式。手术作为一种姑息治疗手段,术中尽可能的去除肿瘤组织并矫正脊柱畸形,从而缓解临床症状[9]。随着现代放疗技术的发展,SBRT对控制脊柱转移瘤局部进展取得了不错的疗效,即使既往对放疗不敏感的肿瘤也可以通过SBRT得到满意的局部控制。因此,外科医生在术式选择上有更多的空间,如分离手术的实施。与传统开放手术不同,分离手术的目的并不是将脊柱肿瘤全部切除,而是通过手术,在脊髓等重要结构周围创造出安全边界、解除压迫,从而更好、更安全的实施后续放疗[10]。
分离手术的适应证包括:放疗不敏感的脊柱转移瘤出现严重脊髓压迫症;既往接受过放射治疗的脊柱转移瘤再次出现严重脊髓压迫症[11]。Laufer等[12]回顾性分析186例接受分离手术序贯SBRT治疗的脊柱转移瘤脊髓压迫症患者:其中40例接受单次超高剂量放疗(24 Gy),37例患者接受多次高剂量放疗(24~30 Gy/3次),109例患者接受多次低剂量放疗(18~36 Gy/5~6次)。随访1年显示,总体局部进展率为16.4%。高剂量放疗组局部进展率为4.1%,显著低于低剂量放疗组的22.6%。多因素分析显示肿瘤局部进展仅与放疗剂量相关,与肿瘤组织放疗敏感度、脊髓压迫程度以及手术减压范围无关。研究结果进一步证实无论肿瘤类型.单次超高剂量SBRT或多次高剂量SBRT均可以达到满意的局部控制。
3 微创技术随着脊柱外科手术领域新技术的进展,脊柱转移瘤患者手术风险、术后疼痛和术后恢复时间较前有很大的改善。特别是微创技术,使患者更愿意接受手术治疗。但微创技术的掌握需要经历一段学习曲线,在初期开展过程中,手术并发症的发生率较高,如出血、脑脊液漏等,需予以重视。手术方式的选择主要根据患者的病情以及手术目的:缓解疼痛,改善局部稳定性,解除脊髓压迫等。术前MRI、CT等影像学评估对手术方式的选择也有一定的指导意义。
3.1 椎体成形技术经皮椎体成形技术是在影像系统的辅助下,利用穿刺针经椎弓根穿刺至椎体内,经通道注入骨水泥。通过以下机制发挥治疗作用:骨水泥固化过程中产热,可使肿瘤组织坏死;骨水泥稳定椎体微骨折,同时毁损神经末梢来缓解疼痛;通过恢复椎体部分高度,以稳定和加固椎体、恢复椎体强度、防止椎体进一步塌陷。其应用在脊柱转移瘤的治疗优点包括:创伤小,术后恢复快以及手术并发症的概率较低,尤其适用于预后较差患者的姑息治疗。
Xie等[13]对47例脊柱转移瘤接受经皮椎体成形术的患者研究显示,患者VAS评分从术前的8.4降到术后的3.4,提示经皮椎体成形能够有效的缓解脊柱转移瘤患者疼痛。Bao等[14]对颈椎转移瘤局部疼痛患者实施经皮椎体成形术,止痛效果显著。对于病理骨折导致椎体明显楔形变的患者,还可以采用经皮椎体后凸成形技术,该技术采用球囊临时将楔形变椎体撑开,尽可能恢复椎体高度后局部填充骨水泥支撑,也取得了较好的疗效。类似的技术还包括可扩张金属支架或可扩张钛网球囊[15]。经皮椎体成形技术的出现为不能耐受常规手术的脊柱转移瘤患者提供了新的治疗选择,特别是未出现脊髓压迫症、以局部疼痛为主要表现的晚期肿瘤患者。
椎体成形技术还可以与常规手术相结合。Dong等[16]回顾性分析26例脊柱转移瘤患者,其中18例患者出现脊髓压迫症,9例患者表现为神经根症状,共32节段受累及。治疗方式采取后路姑息减压联合术中椎体成形术,平均手术时间173 min,术中出血平均659 ml,每节椎体骨水泥平均注入4.1 ml。随访显示(6月~56月)患者VAS评分较术前显著改善,15例脊髓压迫症患者脊髓功能Frankel分级较术前均有改善,其中3例患者出现骨水泥渗漏,但均无临床相关症状。研究结果显示开放手术联合术中椎体成形术能够有效的减少术中出血,并不增加术中并发症的发生风险。
3.2 射频消融联合椎体成形技术射频消融技术主要应用于难以切除或对放疗不敏感的脊柱转移瘤患者,是指将射频针放置在肿瘤部位,通过射频电极发出中高频射频波,激发周围组织细胞进行等离子震荡产生较高的热量,从而有效杀死局部肿瘤细胞,降低肿瘤负荷,同时可使肿瘤周围的血管组织凝固形成反应带,破坏肿瘤组织血供。但单独应用射频消融会导致脊柱不稳定,并增加椎体骨折风险。Pezeshki等[17]研究结果显示单独应用射频消融会导致脊柱机械稳定性下降,发生粉碎骨折的风险增加,而射频消融联合椎体成形能够有效的降低上述风险的发生。
Gu等[18]研究比较射频消融联合椎体成形与单纯应用椎体成形的治疗效果,研究共纳入124例脊柱转移瘤患者,其中71例患者接受射频消融联合椎体成形治疗,53例患者接受椎体成形治疗。随访1、3、6、12月结果显示,联合治疗组VAS评分以及局部进展情况显著优于椎体成形组。结果提示对于脊柱转移瘤患者,射频消融联合椎体成形较单独应用椎体成形能够获得更好的疗效,患者术后疼痛缓解、脊柱稳定性更佳,并能够更好的控制肿瘤局部复发。
Wallace等[19]回顾性分析72例脊柱转移瘤接受射频消融联合椎体成形治疗的患者,72例患者共110节段椎体接受治疗。其中89节椎体病变累及椎体后方,49节椎体病变累及椎弓根,105节椎体病变在射频消融后联合椎体成形。结果显示术后1周、4周VAS评分较术前均有显著改善,且无严重并发症出现,提示射频消融联合椎体成形能够安全有限的缓解脊柱转移瘤引起的疼痛,特别是对于病变累及椎体后方或椎弓根的患者,并发症的发生并未增加。Yang和Bludau的研究也得到相同结论[20-21]。
3.3 经皮椎弓根螺钉联合微创减压技术对于脊柱稳定性较差或已出现脊髓压迫症的脊柱转移瘤患者,单纯放疗或上述微创技术并不能很好的恢复脊柱稳定、缓解压迫,常常需要行开放手术固定。但对于一般情况较差,脊柱不稳定、已出现脊髓压迫症而又无法耐受开放手术的患者,可以选择经皮椎弓根螺钉联合微创减压技术[22-23]。
Hamad等[24]应用经皮椎弓根螺钉技术治疗49例脊柱转移瘤患者,根据患者术前影像学检查以及临床表现,决定术中是否进行微创减压。结果显示49例患者中26例需进行微创减压,单纯固定组平均失血量为92 ml,微创减压组平均失血量222 ml。随访1年显示患者卡氏评分以及神经功能获得明显改善,仅2例患者因无菌性松动行翻修手术。
Gu应用经皮椎弓根螺钉联合微创减压治疗18例胸椎脊柱转移瘤脊髓压迫症患者,1例患者术后8月死亡,余下17例患者平均随访14.2月(12~16月)。结果显示患者VAS评分、脊髓功能均得到显著改善,指出经皮椎弓根钉联合微创减压能够有效的治疗胸椎转移瘤脊髓压迫症患者[25]。
Bernard等[26]回顾性分析17例脊柱转移瘤脊柱不稳定患者,治疗方式采用长节段经皮椎弓根螺钉联合术后放疗。17例患者均未出现并发症,在术后早期即表现出疼痛、功能的显著改善。患者均在术后10天内接受放射治疗,随访结果显示术后3天、3周、6周、3月、6月、12月Oswestry功能障碍指数(Oswestry disability index)分别为35.4、46.1、37.6、34.0、39.1和30,EORTC QLQ-C30评分也呈现类似改变,局部未见肿瘤进展。结果提示长节段经皮椎弓根螺钉固定能够提供较好的脊柱稳定性,且创伤小,恢复快,术后联合放疗能够有效的控制局部肿瘤进展。
脊柱转移瘤患者以中老年居多,在骨质疏松和骨破坏双重因素作用下,椎弓根钉在受累椎体的把持力度较弱,很容易出现螺钉脱出、固定失败等并发症。骨水泥螺钉[27]、膨胀螺钉[28]的出现,很好的解决了上述问题。Moussazadeh将经皮骨水泥成形技术和经皮椎弓根螺钉技术结合,44例SINS评分大于10分的脊柱转移瘤不稳定患者接受治疗。在拧入螺钉后进行经皮骨水泥加固螺钉,增加螺钉的把持力度,术后序贯放疗。29例患者术后症状完全缓解,13例残留轻度疼痛,随访1年仅1例患者出现相邻节段在骨折,1例患者出现螺钉拔出但未引起临床症状,2例患者因局部肿瘤进展需再次开放减压手术治疗。研究结果提示骨水泥增强螺钉技术能够安全有效的缓解脊柱转移瘤患者机械不稳定症状,提供更强的稳定性[29]。
近期,在椎弓根螺钉的材质上也有很大的进展,如PEEK螺钉或碳纤维加固PEEK螺钉。碳纤维加固PEEK螺钉在强度上与传统钛螺钉相仿,优点在于MRI、CT伪影较小,能更好的观察病变局部复发情况[30]。其次,碳纤维加固PEEK材质对术后放疗影响较小,能够使放疗更加精准[31]。
4 靶向治疗靶向治疗的出现,使恶性肿瘤的治疗进入了一个新的时代,脊柱转移瘤也不例外,特别是乳腺癌、恶性黑色素瘤和特殊类型的肺腺癌[32]。
Dohzono等[33]研究不同肺癌病理类型对患者预后的影响。文章回顾性分析135例肺癌脊柱转移瘤患者,其中88例肺腺癌(43例患者EGFR-TKIs突变阳性,45例患者EGFR-TKIs突变阴性)。研究结果显示肺腺癌平均生存时间为11.3月,肺鳞癌为5.3月,小细胞癌为3.9月。仅肺腺癌而言,EGFR-TKIs突变阳性组患者平均生存时间为21.4月,显著高于EGFR-TKIs突变阴性组患者6.1月。此外,显著影响EGFR-TKIs突变阴性组患者预后的因素并不影响EGFR-TKIs突变阳性组患者预后。研究显示基因突变以及靶向治疗的出现,能够显著提高患者生存期和预后。Mok和Olaussen对EGFR突变阳性的非小细胞肺癌患者研究得出相同结果,EGFR突变阳性对特罗凯以及培美曲塞/顺铂反应良好的非小细胞肺癌患者平均生存期较EGFR突变阴性患者延长2年[34-35]。
对于肾癌和恶性黑色素瘤,靶向治疗也有较好的临床疗效。Schmidinger等[36]研究显示肾癌对索坦、帕唑替尼反应良好,肿瘤控制率可高达50%。Margolin等[37]研究显示BRAF突变阳性的恶性黑色素瘤患者,即使在疾病晚期,对靶向药物也反应良好。
5 脊柱转移瘤患者预后评估及治疗方案选择对患者治疗方案的选择主要依赖于对患者预后的评估,适当的治疗方案能够显著改善患者生活质量以及生存期,而不适当的治疗方案不但对患者生活质量改善无显著意义,还可能加速患者病情进展。
目前,常用的预后评分系统包括Tomita评分和Tokuhashi评分,随着恶性肿瘤靶向治疗时代的来临,一些临床医生开始质疑上述传统评分系统的准确性[38],并提出肿瘤个性化基因检测结果对患者预后起到重要影响。Dohzono[33]、Mok[34]和Olaussen[35]研究显示,虽同属同一病理类型,但是否伴有基因突变显著影响患者预后。
随着研究的不断深入,尽管通过各种预后评估手段能够准确判断出脊柱转移瘤患者的生存期,但对不同患者患者应采取何种治疗手段,仍无明确规定。Paton等[39]学者曾提出“LMNOP”系统,通过五个维度对脊柱转移瘤患者进行评估,指导临床医生对患者治疗方案的选择。LMNOP分别代表“L-脊椎累计数量以及转移节段”,“M-脊柱机械稳定性”,“N-神经功能”,“O-肿瘤学特征”,“P-患者一般情况、预后以及对前期治疗的反应”。Laufer等[11]学者在其后又提出“NOMS”系统,从“N-神经功能”,“O-肿瘤学特征”,“M-脊柱机械稳定性”,“S-一般情况”四个维度判断患者的治疗方案。但上述两种临床决策系统最大的不足在于忽略了全身系统治疗对脊柱转移瘤患者的重要性,而全身治疗的疗效往往对患者至关重要。Spratt等[40]多位学者总结归纳1980年至2016年与脊柱转移瘤相关文献,提出了新的临床决策方案,新方案突出全身治疗的重要性。对患者决策方案的制定分为两部分,首先评估患者的功能状态进行(KPS评分)和预期生存期,患者肿瘤负荷,肿瘤控制情况以及全身治疗是否有效。对于KPS评分小于40或预期生存期小于2月以及肿瘤负荷重、持续进展且临床无全身治疗方案的患者选择对症支持或外照射放疗,其他患者进入“MNOP”流程。“MNOP”分别代表“M-脊柱机械稳定性”,“N-神经功能”,“O-肿瘤学特征”以及“P-建议治疗方案”,见图 1。从保守治疗、放疗到外科手术治疗,不同临床治疗方案均存在其局限性,对于急性神经功能受损的脊柱转移瘤脊髓压迫症患者,除放疗敏感度和反应性均好的肿瘤类型如脊索瘤、淋巴瘤外,放疗效果不佳,应在排除禁忌证后行急诊减压手术。而外科常规手术由于术后患者恢复周期长,且存在伤口并发症问题,影响后续放射治疗的序贯实施。脊柱外科医生应根据患者具体情况选择适宜的外科治疗手段,经皮固定、微创减压等技术能够缩短患者术后恢复时间,患者能够在短时间内序贯放疗,提高临床疗效。
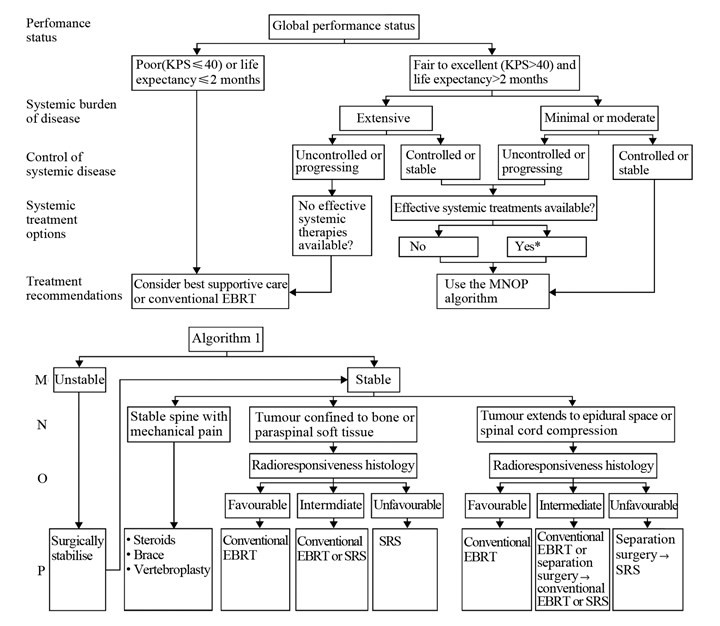
|
| EBRT: external beam radiotherapy; SRS: stereotactic radiosurgery; *: for select patient with effcetive systemic therapy treatment options, systemic therapy without the use of radiotherapy might be most appropriate 图 1 脊柱转移瘤患者临床决策流程[40] Figure 1 Assessment algorithm for patients with spinal metastasis tumor[40] |
包括骨肿瘤科、肿瘤科、放疗科、影像科、病理科等多学科协作的治疗方式在脊柱转移瘤患者治疗中的地位显得越来越重要[41]。肿瘤科、骨肿瘤科医生共同评估患者的预后,从而决定手术治疗或非手术治疗。骨肿瘤科医生根据患者临床特征以及一般情况制定具体的手术方案。若患者不能耐受手术治疗,则由肿瘤科、放疗的医生制定放疗或药物治疗方案。病理科、影像科医生负责解析患者肿瘤组织学以及影像表现,为手术、放疗提供依据。在多学科团队共同协作下,使患者能够得到最佳治疗方案[12, 26, 29, 33]。
7 总结与展望本文总结了近5年放疗、靶向治疗和不同手术方式在脊柱转移瘤治疗领域的进展。尽管多学科协作治疗模式的出现使脊柱转移瘤患者能够获得更加全面的评估,但如何选择最佳的治疗方式仍是困扰临床医师的难题。因此,临床急需一种准确的预后评估以及治疗决策方案,将患者以及肿瘤组织个性化信息包含在内,更准确的判断患者的预后,从而选择最佳治疗方案。
| [1] | Lee BH, Kim TH, Chong HS, et al. Prognostic factor analysis in patients with metastatic spine disease depending on surgery and conservative treatment: review of 577 cases[J]. Ann Surg Oncol, 2013, 20(1): 40–6. DOI:10.1245/s10434-012-2644-4 |
| [2] | Choi D, Fox Z, Albert T, et al. Prediction of quality of life and survival after surgery for symptomatic spinal metastases: a multicenter cohort study to determine suitability for surgical treatment[J]. Neurosurgery, 2015, 77(5): 698–708. DOI:10.1227/NEU.0000000000000907 |
| [3] | Nater A, Tetreault LL, Davis AM, et al. Keypreoperative clinical factors predicting outcome in surgically treated patients withmetastatic epidural spinal cord compression: results from a survey of 438 AOSpineInternational Members[J]. World Neurosurg, 2016, 93: 436–448.e15. DOI:10.1016/j.wneu.2016.07.018 |
| [4] | Jabbari S, Gerszten PC, Ruschin M, et al. Stereotacticbody radiotherapy for spinal metastases: practice guidelines, outcomes, and risks[J]. Cancer J, 2016, 22(4): 280–9. DOI:10.1097/PPO.0000000000000205 |
| [5] | Redmond KJ, Lo SS, Fisher C, et al. Postoperative stereotactic body radiationtherapy (sbrt) for spine metastases: a critical review to guide practice[J]. Int J Radiat Oncol Biol Phys, 2016, 95(5): 1414–28. DOI:10.1016/j.ijrobp.2016.03.027 |
| [6] | Knisely J, Sahgal A, Lo S, et al. Stereotactic radiosurgery/stereotacticbody radiation therapy-reflection on the last decade's achievements and futuredirections[J]. Ann Palliat Med, 2016, 5(2): 139–44. DOI:10.21037/apm |
| [7] | Chang JH, Gandhidasan S, Finnigan R, et al. Stereotactic Ablative Body Radiotherapy for the Treatment of Spinal Oligometastases[J]. Clin Oncol(R Coll Radiol), 2017, 29(7): e119–e125. DOI:10.1016/j.clon.2017.02.004 |
| [8] | van Velden JM, Versteeg AL, Verkooijen HM, et al. Prospective Evaluation of the Relationship Between Mechanical Stability and Response to Palliative Radiotherapy for Symptomatic Spinal Metastases[J]. Oncologist, 2017, 22(8): 972–8. DOI:10.1634/theoncologist.2016-0356 |
| [9] | Metcalfe S, Gbejuade H, Patel NR. The posterior transpedicular approach forcircumferential decompression and instrumented stabilization with titanium cagevertebrectomy reconstruction for spinal tumors: consecutive case series of50 patients[J]. Spine(Phila Pa 1976), 2012, 37(16): 1375–83. DOI:10.1097/BRS.0b013e318250a172 |
| [10] | Fisher C, Batke J. Editorial: separation surgery[J]. J Neumsurg Spine, 2013, 18(3): 205–6. DOI:10.3171/2012.10.SPINE12743 |
| [11] | Laufer I, Rubin DG, Lis E, et al. The NOMS framework: approach to the treatment of spinal metastatic tumors[J]. Oncologist, 2013, 18(6): 744–51. DOI:10.1634/theoncologist.2012-0293 |
| [12] | Laufer I, Iorgulescu JB, Chapman T, et al. Local disease control for spinalmetastases following "separation surgery" and adjuvant hypofractionated or highdosesingle-fraction stereotactic radiosurgery: outcome analysis in 186 patients[J]. J Neurosurg Spine, 2013, 18(3): 207–14. DOI:10.3171/2012.11.SPINE12111 |
| [13] | Xie P, Zhao Y, Li G. Efficacy of percutaneous vertebroplasty in patientswith painful vertebral metastases: a retrospective study in 47 cases[J]. Clin Neurol Neurosurg, 2015, 138: 157–61. DOI:10.1016/j.clineuro.2015.08.026 |
| [14] | Bao L, Jia P, Li J, et al. Percutaneous Vertebroplasty Relieves Pain in Cervical Spine Metastases[J]. Pain Res Manag, 2017, 2017: 3926318. |
| [15] | Werner CM, Osterhoff G, Schlickeiser J, et al. Vertebral body stenting versuskyphoplasty for the treatment of osteoporotic vertebral compression fractures: arandomized trial[J]. J Bone Joint Surg Am, 2013, 95(7): 577–84. DOI:10.2106/JBJS.L.00024 |
| [16] | Dong L, Tan M, Wu D, et al. Palliative Surgery for Spinal Metastases Using Posterior Decompression and Fixation combined with Intra-operative Vertebroplasty[J]. Clin Spinal Surg, 2017, 30(8): 343–9. DOI:10.1097/BSD.0000000000000253 |
| [17] | Pezeshki D, Davidson S, Murphy K, et al. Comparison of the effect of two different bone-targeted radiofrequency ablation (RFA) systems alone and in combination with percutaneous vertebroplasty (PVP) on the biomechanical stability of the metastatic spine[J]. Eur Spine J, 2016, 25(12): 3990–6. DOI:10.1007/s00586-015-4057-0 |
| [18] | Gu YF, Tian Q H, Li YD, et al. Percutaneous vertebroplasty and interventional tumor removal for malignant vertebral compression fractures and/or spinal metastatic tumor with epidural involvement: a prospective pilot study[J]. J Pain Res, 2017, 10: 211–8. DOI:10.2147/JPR |
| [19] | Wallace AN, Greenwood TJ, Jennings JW. Radiofrequency ablation and vertebral augmentation forpalliation of painful spinalmetastases[J]. J Neurooncol, 2015, 124(1): 111–8. DOI:10.1007/s11060-015-1813-2 |
| [20] | Yang PL, He XJ, Li HP, et al. Image-guided minimally invasive percutaneous treatment of spinal metastasis[J]. Exp Ther Med, 2017, 13(2): 705–9. DOI:10.3892/etm.2017.4029 |
| [21] | Bludau F, Welzel G, Reis T, et al. Phase Ⅰ/Ⅱ trial of combined kyphoplasty and intraoperative radiotherapy inspinal metastases[J]. Spine J, 2017, pii: S1529-9430(17): 31004–5. |
| [22] | Molina CA, Gokaslan ZL, Sciubba DM. A systematic review of the current role of minimally invasive spine surgery in the management of metastatic spine disease[J]. Int J SurgOncol, 2011, 2011: 598148. |
| [23] | Ozkan N, Sandalcioglu IE, Petr O, et al. Minimally invasive transpedicular dorsalstabilization of the thoracolumbar and lumbar spine using the minimal access nontraumaticinsertion system (MANTIS): preliminary clinical results in 52 patients[J]. J Neurol Surg Part A Cent Eur Neurosurg, 2012, 73(6): 369–76. DOI:10.1055/s-00000180 |
| [24] | Hamad A, Vachtsevanos L, Cattell A, et al. Minimally invasive spinal surgery for the management of symptomatic spinal metastasis[J]. Br J Neurosurg, 2017, 31(5): 526–30. DOI:10.1080/02688697.2017.1297374 |
| [25] | Gu Y, Dong J, Jiang X, et al. Minimally invasive pedicle screws fixation and percutaneousvertebroplasty for the surgical treatment of thoracic metastatic tumors with neurologiccompression[J]. Spine (Phila Pa 1976), 2016, 41(Suppl 19): B14–B22. |
| [26] | Bernard F, Lemée J M, Lucas O, et al. Postoperative quality-of-life assessment in patients with spine metastases treated with long-segment pedicle-screw fixation[J]. J Neurosurg Spine, 2017, 26(6): 725–35. DOI:10.3171/2016.9.SPINE16597 |
| [27] | Elder BD, Lo SF, Holmes C, et al. The biomechanics of pedicle screw augmentationwith cement[J]. Spine J, 2015, 15(6): 1432–45. DOI:10.1016/j.spinee.2015.03.016 |
| [28] | Gazzeri R, Roperto R, Fiore C. Surgical treatment of degenerative and traumaticspinal diseases with expandable screws in patients with osteoporosis: 2-year followupclinical study[J]. J Neurosurg Spine, 2016, 25(5): 610–9. DOI:10.3171/2016.3.SPINE151294 |
| [29] | Moussazadeh N, Rubin DG, McLaughlin L, et al. Short-segment percutaneous pedicle screwfixation with cement augmentation for tumor-induced spinal instability[J]. Spine J, 2015, 15(7): 1609–17. DOI:10.1016/j.spinee.2015.03.037 |
| [30] | Choi D, Bilsky M, Fehlings M, et al. Spine Oncology-Metastatic Spine Tumors[J]. Neurosurgery, 2017, 80(3S): S131–7. DOI:10.1093/neuros/nyw084 |
| [31] | Ringel F, Ryang YM, Kirschke JS, et al. Radiolucent carbon-fiber reinforced pedicle screws for the treatment of spinal tumors: Advantages for radiation planning and follow-up imaging[J]. World Neurosurg, 2017, 105: 294–301. DOI:10.1016/j.wneu.2017.04.091 |
| [32] | Tobin NP, Foukakis T, De Petris L, et al. The importance of molecular markers for diagnosis and selection of targeted treatments in patients with cancer[J]. J Intern Med, 2015, 278(6): 545–70. DOI:10.1111/joim.12429 |
| [33] | Dohzono S, Sasaoka R, Takamatsu K, et al. Overall survival and prognostic factors in patients with spinal metastases from lung cancer treated with and without epidermal growth factor receptor tyrosine kinase inhibitors[J]. Int J Clin Oncol, 2017, 22(4): 698–705. DOI:10.1007/s10147-017-1116-z |
| [34] | Mok T, Ladrera G, Srimuninnimit V, et al. Tumor marker analyses from the phase Ⅲ, placebo-controlled, FASTACT-2 study of intercalated erlotinib with gemcitabine/platinum in the first-line treatment of advanced non-small-cell lung cancer[J]. Lung Cancer, 2016, 98: 1–8. DOI:10.1016/j.lungcan.2016.04.023 |
| [35] | Olaussen KA, Postel-Vinay S. Predictors of chemotherapy efficacy in non-smallcell lung cancer : a challenging landscape[J]. Ann Oncol, 2016, 27(11): 2004–16. DOI:10.1093/annonc/mdw321 |
| [36] | Schmidinger M, Wittes J. First-line treatment of metastatic renal cell carcinomaafter COMPARZ and PISCES[J]. Curr Opin Urol, 2015, 25(5): 395–401. DOI:10.1097/MOU.0000000000000207 |
| [37] | Margolin K. The promise of molecularly targeted and immunotherapy foradvanced melanoma[J]. Curr Treat Options Oncol, 2016, 17(9): 48. DOI:10.1007/s11864-016-0421-5 |
| [38] | Lee CH, Chung CK, Jahng TA, et al. Which one is a valuable surrogate forpredicting survival between Tomita and Tokuhashi scores in patients with spinalmetastases? A meta-analysis for diagnostic test accuracy and individual participantdata analysis[J]. J Neurooncol, 2015, 123(2): 267–75. DOI:10.1007/s11060-015-1794-1 |
| [39] | Paton GR, Frangou E, Fourney DR. Contemporary treatment strategy for spinal metastasis: the "LMNOP" system[J]. Can J Neurol Sci, 2011, 38(3): 396–403. DOI:10.1017/S031716710001177X |
| [40] | Spratt DE, Beeler WH, de Moraes FY, et al. An integrated multidisciplinary algorithm for the management of spinal metastases: an International Spine Oncology Consortium report[R]. Lancet Oncol, 2017, 18(12): e720-30. |
| [41] | Curtin M, Piggott RP, Murphy EP, et al. Spinal Metastatic Disease: A Review of the Role of the Multidisciplinary Team[J]. Orthop Surg, 2017, 9(2): 145–51. DOI:10.1111/os.2017.9.issue-2 |
 2018, Vol. 45
2018, Vol. 45


