文章信息
- 全脑放疗同步瘤床推量治疗肺癌脑转移瘤临床疗效及预后分析
- Whole Brain Radiotherapy Combined with Simultaneous Integrated Boost for Brain Metastases of Lung Cancer: Its Clinical Effectiveness and Prognosis
- 肿瘤防治研究, 2018, 45(8): 587-592
- Cancer Research on Prevention and Treatment, 2018, 45(8): 587-592
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1223
- 收稿日期: 2017-09-05
- 修回日期: 2017-12-14
2. 621000 绵阳,绵阳市第三人民医院(四川省精神卫生中心)消化科
2. Department of Gastroenterology, The Third Hospital of Mianyang(Sichuan Mental Health Center), Mianyang 621000, China
原发性肺癌(简称肺癌)是我国发病率及死亡率最高的恶性肿瘤,肺癌患者脑转移的发生率为30%~50%[1-2],确诊脑转移的肺癌患者自然平均生存期1~2月。图像引导适形调强放射治疗(image-guided intensity-modulated radiotherapy, IG-IMRT)通过治疗前锥形束CT(cone beam CT, CBCT)扫描校对摆位误差等手段,可最大限度地提高治疗准确度。目前,各大临床肿瘤治疗指南显示,针对肺癌脑转移患者放疗仍是基石,但缺乏公认、合理的放疗总剂量、分割方式及转移灶加量方式。因此,本研究旨在探讨采用IG-IMRT技术行全脑放疗(whole brain radiotherapy, WBRT)(总量30 Gy/10 F)+瘤床同步推量(总量45 Gy/10 F,生物等效剂量65.25 Gy)治疗合并1~4个脑转移灶肺癌患者的近期临床疗效及治疗相关不良反应,明确该方案的有效性及安全性。
1 资料和方法 1.1 病例资料收集2014年5月—2017年5月在绵阳市第三人民医院肿瘤科及呼吸内科经病理确诊为肺癌脑转移(转移病灶数1~4个)患者共98例,其中腺癌40例,鳞癌32例,小细胞肺癌26例。全组患者中位年龄55岁(33~78岁)。所有患者放疗前已行2~6疗程全身化疗,放疗前未行靶向治疗,放疗过程中均未行同步化疗、靶向治疗及其他抗肿瘤治疗。放疗前所有患者的脑部病灶均经头部平扫和增强磁共振成像(magnetic resonance imaging, MRI)证实。55例(56.1%)患者同时合并其他器官转移(肺内转移12例,多发骨转移15例,肝转移11例,肾上腺转移5例,淋巴结转移12例)。将98例患者以采取不同全脑放疗方式分组,分为同步推量组(观察组)49例,序贯推量组(对照组)49例,两组患者临床资料构成相比差异无统计学意义,见表 1。
|
所有患者均行头颈肩热塑面罩+头枕固定,采用SOMATOM definition AS+大孔径128层螺旋CT以3 mm层厚进行增强扫描,扫描范围:上界头顶上缘露空,下界至下颌骨下缘,完成后将CT图像传输至治疗计划系统(treatment plan system, TPS),将增强CT图像及增强MRI T2加权像按骨性标志融合。靶区勾画标准:肿瘤靶区(gross tumor volume, GTV)增强MRI所示颅内转移病灶,不包括周围水肿区;GTV上下、左右、前后均外扩5 mm形成相应计划肿瘤靶区(plan gross tumor volume, PGTV);临床靶区(clinical tumor volume, CTV)即全脑(包括硬脑膜);CTV上下、左右、前后均外扩5 mm形成相应计划靶区(planning tumor volume, PTV)。放疗方式及处方剂量:观察组:PCTV 30 Gy/10 F,3 Gy/F,5 F/W;PGTV 45 Gy/10 F,4.5 Gy/F,5 F/W,共2 W;对照组:WBRT PCTV 30 Gy/10 F,3 Gy/F,5 F/W;全脑放疗完成后行颅内病灶加量15 Gy/5 F,3 Gy/F,5 F/W,即PGTV 45 Gy/15 F,共3 W。瘤床的生物等效剂量均达到65.25 Gy。治疗过程中每天行锥形束CT(cone beam CT, CBCT)扫描校对摆位误差。所有IGRT计划均为5野,治疗计划要求:95%处方剂量包括靶区,靶区内的剂量分布均匀,在处方剂量的±5%以内。通过剂量-体积直方图(dose-volume histogram, DVH)确定最佳治疗计划。各危及器官最大平均点剂量:晶体为700 cGy,视神经、眼球、视交叉和脑干为4500 cGy。直线加速器为Varian Clinac iX(购自美国Varian公司),治疗计划系统为Eclipse 10.0治疗计划系统(购自美国Varian公司)。治疗过程中,常规给予地塞米松、甘露醇脱水降颅压治疗。
1.3 观察指标首要观察指标:肿瘤局部控制率(CR+PR+SD),对比放疗前后及随访复查头颅增强MRI检查行疗效评定,疗效评价参照RECIST 1.1评价标准[3]分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病进展(progressive disease, PD)和疾病稳定(stable disease, SD)。次要观察指标:包括:(1)放疗总有效率(CR+PR)、1年生存率、中位生存期;(2)放疗第1天起至放疗后3月内各种急性不良反应(如头晕、癫痫、胃肠道反应及骨髓抑制等)和放疗后3月起各种晚期不良反应(如患者认知功能障碍、记忆力减退、脑坏死等)评价。各急性及晚期不良反应参照放射肿瘤治疗协作组(RTOG)和欧洲癌症研究治疗中心(EORTC)制定的放射损伤分级标准进行评估。治疗病灶局部失败定义为接受放疗的病灶出现进展。颅内远处失败定义为出现新病灶,颅内进展定义为治疗病灶局部失败和(或)出现新病灶。
1.4 随访放疗期间每周评价患者各种急性不良反应。采用蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)评分比较神经认知功能差异。首次复查于放疗结束后4周进行,之后如病情稳定3月/次全面复查,2年后6月/次全面复查,直至患者死亡或失访。每次复查均需行头颅MRI平扫+增强扫描,行原发灶及其他转移灶影像学检查,并记录患者症状、体征、KPS评分,评估不良反应及神经功能。总生存期(overall survival, OS)定义为自第一次接受脑转移灶放疗至因各种原因所致的死亡或末次随访时间。
1.5 统计学方法用SPSS 21.0统计学软件进行数据处理,计量资料用均数±标准差(x±s)表示,两个独立样本组间均数比较用t检验。计数资料组间比较采用卡方检验。生存曲线的绘制采用Kaplan-Meier法,生存率的比较采用Log rank检验。以P < 0.05为差异有统计学意义。
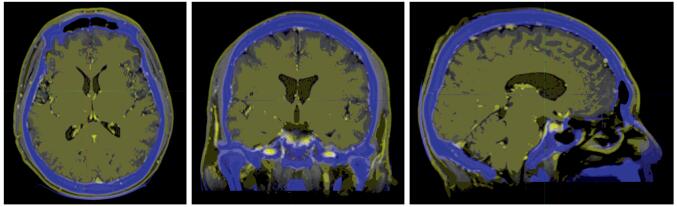
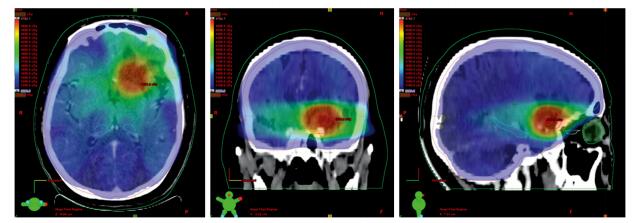
2 结果 2.1 靶区剂量分布及DVH评价所有患者均行CT-MRI融合,效果满意,见图 1。采用5野IG-IMRT治疗计划,各靶区覆盖均符合预期要求。左、右晶体最大平均点剂量分别为455 cGy(280~660 cGy)与495 cGy(305~640 cGy)。脑干的平均点剂量分别为3557 cGy(908~4500 cGy),各PTV平均剂量为3070 cGy(2850~3213 cGy),各PGTV1~4平均剂量为4610 cGy(4580~4750 cGy)。各靶区剂量分布均满意,见图 2~3。所有患者均按计划完成放疗,放疗期间均常规给予地塞米松、甘露醇等对症降颅内压治疗。
|
| 图 1 肺癌脑转移患者CT-MRI融合图 Figure 1 CT and MRI fusion graphs of lung cancer patients with brain metastases |
|
| 图 2 肺癌脑转移患者全脑放疗3000 cGy剂量分布 Figure 2 Dose distribution of 3000cGy for wholebrain radiotherapy (WBRT) on lung cancer patients with brain metastases |
|
| 图 3 肺癌脑转移患者各靶区及正常组织的DVH图 Figure 3 DVH for different targets and organs at risk in lung cancer patients with brain metastases |
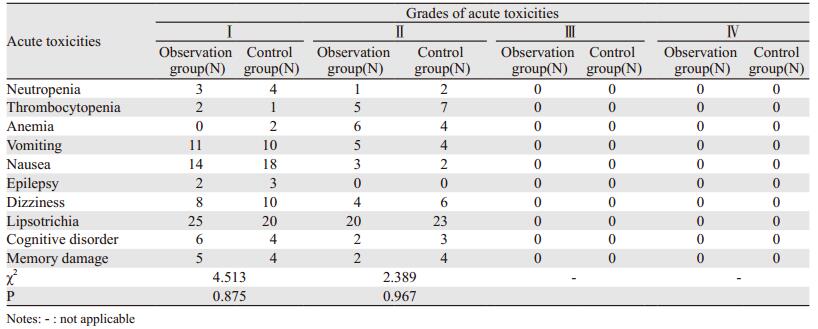
全组放疗患者无1例出现与放射治疗相关的颅内出血、脑梗死或死亡。放疗期间常见的急性不良反应见表 2,晚期不良反应见表 3。
|

|
观察组的放疗总有效率、肿瘤局部控制率和1年生存率分别为87.80%(43/49)、95.92%(47/49)和65.31%(32/49)均高于对照组的61.20%(30/49)、81.60%(40/49)和44.90%(22/49),差异有统计学意义(P=0.003、0.025和0.042),中位生存期观察组(15月)高于对照组(12月)。在随访时间内,达CR患者中无1例出现放疗野内复发。
2.4 生存分析所有患者均顺利完成放疗计划。观察组放疗后至末次随访期间,中位OS为15月(6.0~18.0月)。15例死于肿瘤,1年生存率为65.31%。对照组放疗后至末次随访期间,中位OS为12月(3.0~15.0月)。18例死于肿瘤,1年生存率为44.90%。生存曲线见图 4。

|
| 图 4 两组肺癌脑转移患者的总生存曲线 Figure 4 Overall survival curves of lung cancer patients with brain metastases |
肺癌脑转移是最常见的颅内肿瘤,对已确诊合并脑转移的肺癌患者治疗目的为延长生存期及提高生活质量,全脑放疗是肺癌脑转移患者放射治疗中的基石,对颅内亚临床病灶有控制作用,能降低颅内远转风险。但近年来分子靶向治疗及立体定向放射治疗(stereotactic radiotherapy, SRT)在肺癌脑转移患者治疗中的相关研究进展使经典的WBRT的地位受到挑战。因此,近年来国内外研究提出了颅内远转风险进行分层分析并决定治疗策略,具体分层因素如下:大于4个转移灶、颅外疾病未控、转移灶体积 > 6 cm3以及原发灶诊断和脑转移诊断时间 < 60月等[4-6],对高危颅内远转风险患者中国肺癌脑转移诊治专家共识推荐行立体定向放射治疗SRT联合WBRT[7]。多项研究显示,对于WBRT后再针对瘤床推量相对于单纯行全脑放疗可显著提高中位无复发生存时间[8-9]。
关于肺癌脑转移患者WBRT照射剂量及分割方式,目前临床上总体共识为30 Gy/10 F、40 Gy/20 F、37.5 Gy/15 F可作为大部分患者的方案,而对颅内转移病灶的局部加量方式尚无明确推荐。目前临床上多采用先行全脑放疗,再对脑转移病灶进行加量放疗的放疗方式。而近年来,因该序贯加量放疗的方式所致的不同程度的不良反应[10-11],多项研究开始探索同期推量放疗的疗效及安全性,刘刚等[12]比较了同期推量放射和全脑照射+三维适形放射序贯治疗非小细胞肺癌脑转移瘤的疗效,结果显示:同期推量放射组患者的完全缓解率为72.4%(55/76),1、2和3年生存率分别为64.5%、31.6%、11.8%,均高于序贯治疗组患者。程学斌等[13]分析了32例肺癌脑转移患者,行全脑5野IMRT(40 Gy/20 F)+瘤床SIB(50 Gy/20 F),结果显示:放疗总有效率为71.9%,肿瘤局部控制率为96.9%,1年生存率为44%,治疗不良反应发生率低,得出采用此项治疗技术及放疗方式治疗1~4个肺癌脑转移灶是可行的。
与既往研究不同的是,本研究采用30 Gy/10 F的全脑大分割方案,对颅内占位病灶也采用大分割放疗,对不同颅内转移病灶放疗加量分割方式及时机作了对比分析,且采用了更先进和精准的IG-IMRT放疗技术,最大限度地降低了误差。本研究结果显示两组患者均获得了较好的肿瘤局部控制率,序贯放疗组及同步放疗组患者的肿瘤局部控制率分别为95.92%、81.60%,差异有统计学意义。同步推量组局部控制率更高,原因可能与转移病灶单次放疗分割剂量(4.5 Gy/F)较高及同期推量放疗可逆向调整放疗强度使肿瘤靶区剂量高于临近组织,且最大程度地保护正常组织细胞[14]有关。相比较序贯推量放疗,同步推量放疗还能缩短治疗周期、降低治疗费用、减少搬动次数,能快速缓解患者因颅内病灶压迫所致肢体活动障碍、语言功能障碍、颅内高压等症状,从而提高了患者治疗依从性。两组患者均行脑转移病灶加量放疗,总剂量至45 Gy/10 F,治疗后1年生存率及中位生存期分别为65.31%、44.90%及15月、12月,可看出两组患者治疗后1年生存率相当,中位生存期与既往仅行WBRT患者3~6月的中位生存期相比有所延长[8]。既往研究在分级预后系统(graded prognostic assessment, GPA)基础上,根据不同原发肿瘤脑转移的差异进一步提出了诊断特异性GPA(diagnosis-specific, DS-GPA)。DS-GPA中,肺癌脑转移的预后因素包括年龄、卡氏评分(Karnofsky, KPS)、颅外转移和脑转移数目,本研究排除了上述预后因素的影响,两组患者差异无统计学意义,进一步提示不同WBRT结合不同的肿瘤病灶加量放疗方式及放疗时机对患者治疗预后有一定影响。
本研究两组患者均顺利完成放疗,无Ⅲ~Ⅳ级严重不良反应。治疗相关的主要急性不良反应为Ⅰ~Ⅱ度骨髓抑制、脱发、恶心、呕吐、认知功能障碍、记忆力损伤等,但发生率低,经积极对症治疗可缓解或完全恢复。晚期不良反应主要为Ⅰ~Ⅱ度的认知功能障碍及记忆力损伤,仅对照组有2例患者发生Ⅰ度放射性脑坏死,对于晚期不良反应继续随访评定,在以后临床工作中注意放疗靶区勾画及放疗计划拟定过程应考虑海马勾画及内耳保护,以期进一步降低晚期不良反应发生率。
综上所述,采用IG-IMRT技术行WBRT(总量30 Gy/10 F)+瘤床同步推量(总量45 Gy/10 F,生物等效剂量65.25 Gy)治疗合并1~4个脑转移灶肺癌患者的放疗分割方式能较好的保护危及器官,靶区分布均匀,剂量曲线陡峭,临床实施安全性高,放疗的总有效率高,1年生存率较仅行WBRT延长。相对于序贯推量放疗近期疗效相当,相关不良反应少,治疗时间缩短,治疗费用降低,患者能获得较快的临床症状缓解,是临床肺癌脑转移患者行全脑放疗的优选治疗方案之一。
| [1] | Sørensen JB, Hansen HH, Hansen M, et al. Brain metastases in adenocarcinoma of the lung: frequency, risk groups, and prognosis[J]. J Clin Oncol, 1988, 6(9): 1474–80. DOI:10.1200/JCO.1988.6.9.1474 |
| [2] | Lagerwaard FJ, Levendag PC, Nowak PJ, et al. Identification of prognostic factors in patients with brain metastases: a review of 1292 patients[J]. Int J Radiat Oncol Biol Phys, 1999, 43(4): 795–803. DOI:10.1016/S0360-3016(98)00442-8 |
| [3] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228–47. DOI:10.1016/j.ejca.2008.10.026 |
| [4] | Sawrie SM, Guthrie BL, Spencer SA, et al. Predictors of distant brain recurrence for patients with newly diagnosed brain metastases treated with stereotactic radiosurgery alone[J]. Int J Radiat Oncol Biol Phys, 2008, 70(1): 181–6. DOI:10.1016/j.ijrobp.2007.05.084 |
| [5] | Chen XJ, Xiao JP, Li XP, et al. Risk factors of distant brain failure for patients with newly diagnosed brain metastases treated with stereotactic radiotherapy alone[J]. Radiat Oncol, 2011, 6: 175. DOI:10.1186/1748-717X-6-175 |
| [6] | Kress MA, Oermann E, Ewend MG, et al. Stereotactic radiosurgery for single brain metastases form non-small cell lung cancer: progression of extracranial disease correlates with distant intracranial failure[J]. Radiat Oncol, 2013, 8(1): 64. DOI:10.1186/1748-717X-8-64 |
| [7] | 石远凯, 孙艳, 于金明, 等. 中国肺癌脑转移诊治专家共识(2017年版)[J]. 中国肺癌杂志, 2017, 20(1): 1–13. [ Shi YK, Sun Y, Yu JM, et al. China experts consensus on the diagnosis and treatment of brain metastases of lung cancer (2017 version)[J]. Zhongguo Fei Ai Za Zhi, 2017, 20(1): 1–13. ] |
| [8] | Kondziolka D, Patel A, Lunsford LD, et al. Stereotactic radiosurgery plus whole brain radiotherapy versus radiotherapy alone for patients with multiple brain metastases[J]. Int J Radiat Oncol Biol Phys, 1999, 45(2): 427–34. DOI:10.1016/S0360-3016(99)00198-4 |
| [9] | Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase Ⅲ results of the RTOG 9508 randomised trial[J]. Lancet, 2004, 363(9422): 1665–72. DOI:10.1016/S0140-6736(04)16250-8 |
| [10] | 赵儒钢, 孟祥颖, 申戈, 等. 贝伐珠单抗治疗脑转移瘤难治性瘤周水肿的疗效分析[J]. 临床肿瘤学杂志, 2016, 21(3): 233–7. [ Zhao RG, Meng XY, Shen G, et al. Efficacy analysis of bevacizumab in brain metastases patients with serious cerebral edema[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2016, 21(3): 233–7. ] |
| [11] | 马玉超, 肖建平, 毕楠, 等. 大分割放疗联合替莫唑胺治疗大体积脑转移瘤的前瞻性临床研究[J]. 中华放射肿瘤学杂志, 2016, 25(4): 320–6. [ Ma YC, Xiao JP, Bi N, et al. Efficacy of hypofractionated stereotactic radiotherapy combined with temozolomide for large brain metastases:a prospective clinical study[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2016, 25(4): 320–6. DOI:10.3760/cma.j.issn.1004-4221.2016.04.005 ] |
| [12] | 刘刚, 张秀亮, 张亚男, 等. 同期推量放射和全脑照射+三维适形放射序贯治疗非小细胞肺癌脑转移瘤的疗效及影响预后因素分析[J]. 海南医学, 2017, 28(4): 554–6. [ Liu G, Zhang XL, Zhang YN, et al. Efficacy and prognostic factors of simultaneous radiotherapy and total brain irradiation plus three-dimensional conformal radiation therapy in treatment of non-small cell lung cancer with brain metastases[J]. Hainan Yi Xue, 2017, 28(4): 554–6. DOI:10.3969/j.issn.1003-6350.2017.04.011 ] |
| [13] | 程学斌, 肖林. 适形调强放疗同期整合瘤床推量治疗肺癌脑转移瘤的可行性研究[J]. 中国癌症杂志, 2016, 26(8): 687–92. [ Cheng XB, Xiao L. Feasibility study on the treatment for brain metastases of lung cancer via intensity-modulated radiotherapy combined with simultaneous integrated boost[J]. Zhongguo Fei Ai Za Zhi, 2016, 26(8): 687–92. ] |
| [14] | 张波, 苏胜发, 欧阳伟炜, 等. 放化疗联合脑转移瘤放疗治疗非小细胞肺癌脑转移的临床疗效分析[J]. 中国癌症防治杂志, 2016, 8(1): 22–6. [ Zhang Bo, Su shengfa, Ouyang Weiwei, et al. Survival in patients with non-small cell lung cancer and brain metastasis treated with concurrent thoracic chemoradiotherapy and brain radiation[J]. Zhongguo Ai Zheng Fang Zhi Za Zhi, 2016, 8(1): 22–6. ] |
 2018, Vol. 45
2018, Vol. 45
