文章信息
- 肾原发性原始神经外胚层肿瘤—2例临床分析并文献复习
- Primary Renal Primitive Neuroectodermal Tumor: Two Cases Report and Literature Review
- 肿瘤防治研究, 2018, 45(5): 333-336
- Cancer Research on Prevention and Treatment, 2018, 45(5): 333-336
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1221
- 收稿日期: 2017-09-25
- 修回日期: 2018-02-06
2. 321017 金华,浙江省金华市中医医院外二科;
3. 200032 上海,复旦大学附属中山医院生殖医学中心
2. The Second Surgery Department, Jinhua Hospital of Traditional Chinese Medicine, Jinhua 321017, China;
3. Reproductive Medicine Center, Zhongshan Hospital, Fudan University, Shanghai 200032, China
原始神经外胚层肿瘤(primitive neuroectodermal tumor, PNET)是一类生物学特征类似的未分化肿瘤,好发于软组织或骨骼,是在儿童和青年中发病率居第二位的肉瘤[1-3]。PNET起源于神经嵴胚胎残留组织,主要由呈小圆细胞的原始神经上皮细胞构成,具有多向分化潜能[4]。原发于肾的PENT非常罕见。本文回顾性分析了复旦大学附属中山医院近3年来诊治的2例肾原发性PNET病例,结合文献探讨该类型肿瘤的临床表现、病理特征、生物学行为,并讨论其诊断、鉴别诊断、治疗和预后,现报告如下。
1 资料与方法 1.1 资料收集收集复旦大学附属中山医院泌尿外科2014年7月—2017年6月间收治的2例肾原发性PNET,患者入院后均完善腹部超声检查和胸腹部增强CT检查,进行术前评估和肿瘤分期,并进行手术和后续治疗,手术后随访期超过半年以上。
1.2 病理切片处理2例手术切除的肾标本经4%多聚甲醛固定,石蜡包埋,分别经HE染色、免疫组织化学染色剂双色荧光原位杂交检测。一抗包括:AE1/AE3、Bcl2、Calponin、CD10、CD34、CD56、CD99、CD138、CgA、CHG、CK7、CK8、CK20、Desmin、EMA、ERG、Fli-1、HMB45、LCA、P40、P63、Ki-67、MITF、MPO、NSE、S100、SMA、Syn、TDT、TFE-3、Vim、WT1。EWSR1分离探针检测结果提示 > 50%细胞可见红绿分离信号,提示存在EWSR1基因易位。
2 结果 2.1 临床资料例1,女性,17岁;例2,男性,40岁。患者均因腰腹部疼痛入院,无肉眼血尿。女性患者查体右肋下可扪及右肾包块;男性患者查体未见异常。
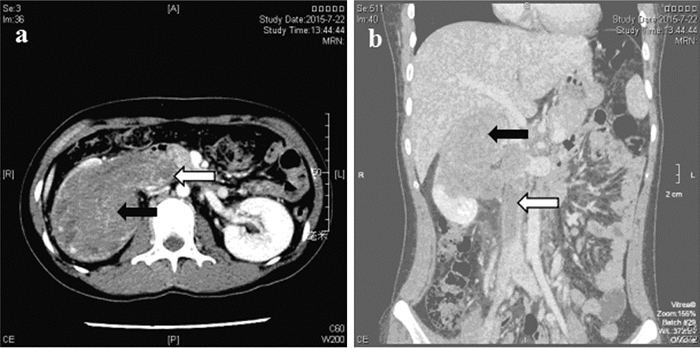
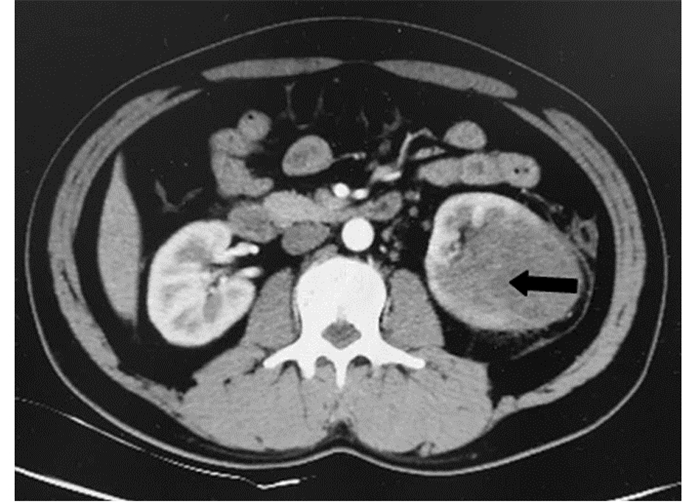
2.2 影像学表现例1患者B型超声提示右肾中上部见99 mm×68 mm不均质团块,内见小片无回声区;右肾静脉内充满实质回声,下腔静脉内见大小约73 mm×28 mm的实质回声。CT提示右肾见较大低密度影,内见不均匀强化,右肾静脉及下腔静脉见长约11 cm的低密度充盈缺损伴强化,见图 1,考虑右肾恶性肿瘤。初次就诊经胸部CT和核素骨显像排除肺转移及骨转移。术前cTNM分期T3bN0M0。例2患者B型超声提示左肾下极62 mm×47 mm等回声区,形态规则,内部回声欠均匀。CT提示左肾见一56 mm×43 mm团块,密度不均匀,CT值为30 HU,增强后明显强化,初步诊断为左肾恶性肿瘤,见图 2。胸部CT未见异常。术前cTNM分期T1bN0M0。
|
| CT scan demonstrated a large substantive tumor in the upper pole of the right kidney with slight contrast enhancement (black arrow). Tumor thrombus in the right renal vein and inferior vena cava were also showed(white arrow) 图 1 例1患者CT图 Figure 1 CT images of case one |
|
| CT scan demonstrated a substantive tumor in the lower pole of the left kidney with slight contrast enhancement and poorly defined boundary(black arrow) 图 2 例2患者CT图像 Figure 2 CT images of case two |
例1患者因癌栓累及右肾静脉和下腔静脉,施行右肾根治性切除,手术顺利,术中出血少,未输血,术中未行取癌栓手术。术后第六周起予以IE/VAC(异环磷酰胺、表柔比星/长春新碱、阿霉素、环磷酰胺)方案化疗。例2施行左肾根治性切除术,手术顺利,术中出血少,未输血。术后3月进行PET/CT检查,结果显示全身多处肿瘤转移,遂开始1、3、5周期VACA方案(长春地辛4 mg d1+EPI(75 mg/m2)60 mg d1~2+CTX(1.2 g/m2)1.0 g d1~2+新福菌素(6 μg/kg)0.4 mg d1~5,1次/3周)化疗,第2、4周期VAC/IE(IE方案具体为IFO(1.8 g/m2)3.0 g d1~5+VP-16(100 mg/m2)150 mg d1~5,1次/3周)交替方案化疗。
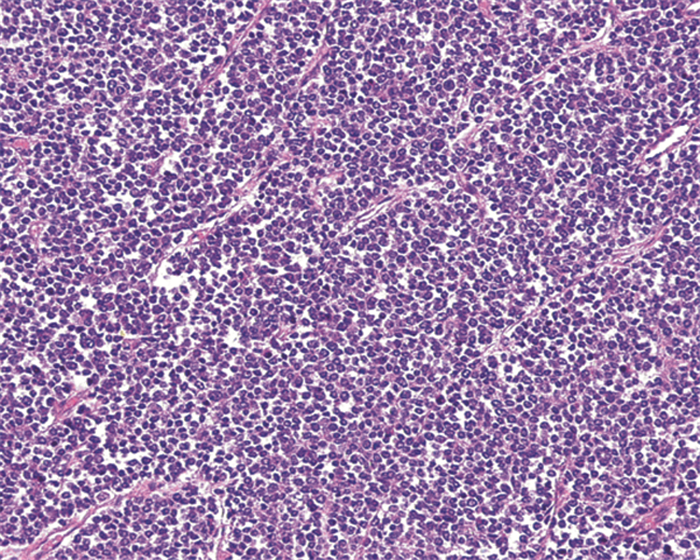
2.4 病理结果例1患者术后巨检提示肾上极肾实质处见大小为11 cm×10 cm×5 cm的结节状肿块,切面呈灰白、灰黄色、质地中等、边界不清、紧贴肾被膜,肾门区血管见瘤栓。光学显微镜下见均一性小圆细胞,细胞核圆、浓染,可见小核仁,多见核分裂相,细胞质少,胞膜边界不清,异型性明显。肿瘤细胞呈片状分布,当中可见纤维分隔,见图 3。免疫组织化学结果提示:Bcl2(-),Calponin(-),CD10(-),CD56(-),CD99(-),CHG(-),CK7(-),CK8(-),CK20(-),EMA(-),Fli-1(+),LCA(-),P40(-),P63(-),Ki-67(40%阳性),MITF(-),MPO(-),NSE(+),Syn(散在弱+),TDT(-),TFE-3(-),Vim(+),WT1(-)。双色荧光原位杂交(FISH2015-1229):EWSR1分离探针检测结果显示,可见约50%肿瘤细胞EWSR1基因分离,提示FISH检测结果为阳性。SS18分离探针检测结果未见到SS18基因分离,提示FISH检测结果为阴性。
|
| PNET in kidney presented as small round cell tumors with round, hyperchromatic nuclei and poorly-defined cytoplasmic borders 图 3 肾原始神经外胚层肿瘤病理组织学形态(HE ×100) Figure 3 Pathologic histologic structure of renal primitive neuroectodermal tumor(PNET) (HE ×100) |
例2患者术后巨检结果提示左肾一极见大小为6.5cm×6.0cm×4.0cm的肿物,切面灰白色、质硬、边界不清,肿物侵犯肾盂,周围肾实质厚约2.0 cm。光学显微镜下见小圆细胞片状分布,伴大块坏死灶,脉管见瘤栓。肾盂及周围脂肪见肿瘤累及。免疫组织化学结果提示:AE1/AE3(-),CD10(-),CD34(+),CD56(+),CD99(+),CD138(-),CgA(-),CK7(-),Desmin(-),EMA(-),ERG(-),Fli-1(-),HMB45(-),LCA(-),Ki-67(70%阳性),S100(-),SMA(-),Syn(+),Vim(+),WT-1(-)。双色荧光原位杂交:EWSR1分离探针检测结果示可见 > 50%肿瘤细胞EWSR1基因分离,提示FISH检测结果为阳性。
2.5 随访情况例1患者术后第5周行胸部CT提示双肺散在粟粒样微小结节;术后第六周起予以IE/VAC方案化疗,后因化疗不耐受遂停止。2016年3月出现骨痛,数月后因肿瘤全身转移无法控制死亡。例2患者术后3月进行PET/CT检查,结果显示,左侧腹盆腔、腹膜后及后腹壁多处转移,全身多处骨转移,双肺多发转移可能,遂采用VACA及VACA/IE交替化疗方案。近期复查胸腹部CT,对比既往PET/CT,肺内病灶较前缩小,总体评估为PR,目前患者仍存活。
3 讨论PNET是以神经外胚层分化的小圆细胞为主要成分的恶性肿瘤,分为中枢型和外周型。中枢型PNET常见于颅内,如发生于小脑的髓母细胞瘤;外周型PNET可见于骨骼、四肢,极少数病例发生于内脏,如肾。1994年由Mor等首次报道原发于肾的PNET,至今国内外病例仍较罕见[5]。肾PNET发病年龄为2月~73岁,中位年龄为20岁[6]。男:女比约为3:1[7]。多为单发且生长迅速,发现时肿瘤最大径常可超过10 cm[8-9]。患者往往因为肿瘤压迫周围脏器引发相应症状而就诊;如肿瘤累及集合系统可出现血尿[10]。本文两例患者均因腰腹部疼痛就诊,病程中并未出现肉眼血尿。
影像学上的表现与其他类型的肾细胞癌相类似[11],缺乏其特征性表现。B型超声和CT表现为密度不均的软组织肿块,内部可以出现坏死或囊性变,增强后实质成分为轻到中度的增强。尽管很难单从B型超声、CT或者MRI上明确其肾肿瘤类型,但有助于了解病变定位、形态、内部结构及血流信息,进而确定疾病性质及分期。本文两例均为肾内体积较大的实质性占位,边界较清、密度不均,血供丰富;例1患者就诊时肿瘤已侵犯下腔静脉,而例2患者就诊时肿瘤局限在肾包膜内。
PNET的诊断主要根据组织病理学、免疫组织化学及分子病理检测结果来判断[12]。肾PNET的巨检结果表现为肾实质性或囊实性肿物,质地多较脆或偏软,往往伴有坏死或出血。光学显微镜下可见肿瘤细胞为形态较一致的原始小圆细胞,核深染,核分裂相多见,可成片状或条索状排列,典型病例可见Homer-Wright菊型团状排列结构,肿瘤血管丰富。免疫组织化学检测可以发现肿瘤细胞中的神经标志物如S100、NSE以及间质标志物Vim等表达多为阳性,CD99在约90%的PNET中均有表达,也被认为是重要的诊断依据之一[8]。然而,这些指标对PNET的诊断特异性都不够高,并非诊断的最终标准。本文两例经免疫组织化学检测发现例1患者NSE阳性,CD99阴性;例2患者CD99阳性,S100阴性;两例Syn和Vim均有表达。由于肾PNET同样存在染色体易位t(11;22)(q24;q12)而产生融合基因EWS-FIL1[3],本文2例标本经免疫荧光原位杂交证实超过50%的肿瘤细胞存在EWSR1基因分离,所以确诊为PNET。肾PNET需要和光学显微镜下同样表现为小圆细胞的其他恶性肿瘤相鉴别,比如横纹肌肉瘤、滑膜肉瘤、间叶性软骨肉瘤、小细胞骨肉瘤、外周神经鞘类肿瘤等。除此以外,肾PNET还需和肾母细胞瘤、肾原发性恶性淋巴瘤等相鉴别。肾母细胞瘤多见于5岁以内的儿童,较少发生在20岁以后。恶性淋巴瘤可以表现为肾内多发结节状病灶,有时累及双侧肾脏及腹膜后淋巴结,但较少出现静脉内癌栓。
肾PNET是恶性程度很高的肿瘤,极容易发生转移[9]。20%~50%的患者在初诊时就已经存在远处转移,尤其多见于区域淋巴结、骨骼、骨髓、肺和肝脏[7]。出现转移的患者治疗后无进展生存中位时间约在22月左右,局限性肾PNET患者的预后要好于发生区域淋巴结或远处转移的患者[10, 13]。由于肾PNET预后较差,对于这类肿瘤的治疗方案以手术联合放化疗的综合治疗为主。目前认为术后化疗能够延长患者生存期,常用的化疗药物包括异环磷酰胺、依托泊苷、长春新碱、阿霉素、环磷酰胺等[12]。本研究例1患者术前即存在右肾静脉及下腔静脉癌栓,因此在术后第六周即开始化疗,由于患者无法耐受化疗的不良反应,导致化疗中止,最终患者很快死亡。而例2患者虽然术前检查提示病灶局限于左肾,但行左肾根治性切除术治疗后3月即出现全身多发转移,经及时予挽救性化疗,目前疾病控制良好。这2例患者转归,与文献报道相似[12-13]。
因此,肾PNET恶性程度高,进展快,预后较差。临床上应行肾根治性切除术,术后及时给予化疗或者放疗等,能延长患者生存期。由于此肿瘤较为罕见,还应多积累病例,加强随访,提高认识,以期获得更好的治疗效果。
| [1] | Sharifi Doloui D, Fakharian T, Yahyavi V, et al. Primitive neuroectodermal tumor with kidney involvement: a case report[J]. Iran J Radiol, 2014, 11(2): e4661. |
| [2] | Zhong J, Chen N, Chen X, et al. Peripheral primitive neuroectodermal tumor of the kidney in a 51-year-old female following breast cancer: A case report and review of the literature[J]. Oncol Lett, 2015, 9(1): 108–12. DOI:10.3892/ol.2014.2695 |
| [3] | Celli R, Cai G. Ewing Sarcoma/Primitive Neuroectodermal Tumor of the Kidney: A Rare and Lethal Entity[J]. Arch Pathol Lab Med, 2016, 140(3): 281–5. DOI:10.5858/arpa.2014-0367-RS |
| [4] | 李世兰, 李海, 王震, 等. 肾脏外周原始神经外胚层肿瘤三例临床病理分析[J]. 中华病理学杂志, 2015, 44(11): 788–9. [ Li SL, Li H, Wang Z, et al. Clinicopathological analysis on renal primitive neuroectodermal tumor[J]. Zhonghua Bing Li Xue Za Zhi, 2015, 44(11): 788–9. DOI:10.3760/cma.j.issn.0529-5807.2015.11.006 ] |
| [5] | Mor Y, Nass D, Raviv G, et al. Malignant peripheral primitive neuroectodermal tumor (PNET) of the kidney[J]. Med Pediatr Oncol, 1994, 23(5): 437–40. DOI:10.1002/(ISSN)1096-911X |
| [6] | Ellison DA, Parham DM, Bridge J, et al. Immunohistochemistry of primary malignant neuroepithelial tumors of the kidney: a potential source of confusion? A study of 30 cases from the National Wilms Tumor Study Pathology Center[J]. Hum Pathol, 2007, 38(2): 205–11. DOI:10.1016/j.humpath.2006.08.026 |
| [7] | Bartholow T, Parwani A. Renal Primitive Neuroectodermal Tumors[J]. Arch Pathol Lab Med, 2012, 136(6): 686–90. DOI:10.5858/arpa.2011-0104-RS |
| [8] | Wu YJ, Zhu YC, Chen H, et al. Primitive neuroectodermal tumor of the kidney with inferior vena cava tumor thrombus during pregnancy response to sorafenib[J]. Chin Med J(Engl), 2010, 123(15): 2155–8. |
| [9] | Ohgaki K, Horiuchi K, Mizutani S, et al. Primary Ewing's sarcoma/primitive neuroectodermal tumor of the kidney that responded to low-dose chemotherapy with ifosfamide, etoposide, and doxorubicin[J]. Int J Clin Oncol, 2010, 15(2): 210–4. DOI:10.1007/s10147-010-0031-3 |
| [10] | Risi E, Iacovelli R, Altavilla A, et al. Clinical and pathological features of primary neuroectodermal tumor/Ewing sarcoma of the kidney[J]. Urology, 2013, 82(2): 382–6. DOI:10.1016/j.urology.2013.04.015 |
| [11] | 刘欣, 周小兵, 刘波, 等. 肾脏外周型原始神经外胚层肿瘤影像诊断[J]. 医学影像学杂志, 2016, 26(9): 1672–5. [ Liu X, Zhou XB, Liu B, et al. Imaging diagnosis of peripheral primitive neuroectodermal tumor in kidney[J]. Yi Xue Ying Xiang Xue Za Zhi, 2016, 26(9): 1672–5. ] |
| [12] | Sun C, Du Z, Tong S, et al. Primitive neuroectodermal tumor of the kidney: case report and review of literature[J]. World J Surg Oncol, 2012, 10: 279. DOI:10.1186/1477-7819-10-279 |
| [13] | Thyavihally YB, Tongaonkar HB, Gupta S, et al. Primitive neuroectodermal tumor of the kidney: a single institute series of 16 patients[J]. Urology, 2008, 71(2): 292–6. DOI:10.1016/j.urology.2007.09.051 |
 2018, Vol. 45
2018, Vol. 45


