文章信息
- ⅡB~Ⅲ期食管癌根治术后预防性放疗疗效分析
- Prognosis of Stage ⅡB-Ⅲ Thoracic Esophageal Carcinoma Patients Treated with Prophylactic After Radical Esophagectomy
- 肿瘤防治研究, 2018, 45(6): 404-409
- Cancer Research on Prevention and Treatment, 2018, 45(6): 404-409
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1207
- 收稿日期: 2017-09-22
- 修回日期: 2018-03-26
食管癌是我国常见的消化道恶性肿瘤。手术切除是食管癌的主要治疗方式之一,术后治疗失败的主要模式为区域性复发和(或)远处转移,其中以区域性复发最为常见,可达40%~60%[1-2]。食管癌术后预防性放疗的价值仍存在争议,几项随机对照试验表明根治性食管癌术后患者接受预防性放疗未见生存获益,也有文献报道Ⅲ期或N1期患者可从术后放疗中获益[3-9],本研究旨在通过回顾分析,探讨术后预防性放疗对ⅡB、Ⅲ期食管癌根治术患者生存的影响,为临床治疗方案的选择提供依据。
1 资料与方法 1.1 入组标准(1)根治性手术切除(R0切除);(2)病理明确为胸部食管鳞癌;(3)术后病理分期为ⅡB或Ⅲ期(2002 UICC第六版分期);(4)KPS评分 > 70;(5)术前未进行新辅助治疗;(6)接受术后放疗为S+R组,术后未接受放疗组为S组。
1.2 一般临床资料2007年1月至2010年12月共336例患者符合入组标准。其中男251例、女85例,年龄37~78岁(中位年龄59岁)。胸上段18例、胸中段181例、胸下段137例,按国际抗癌联盟2002年分期标准T1、T2、T3、T4期分别为16、47、234、39例,N0、N1期分别为28、308例,ⅡB、Ⅲ期分别为65、271例。全组病例接受术后放疗(S+R)共116例,未行术后放疗(S)共220例(两组患者一般资料具有可比性,见表 1);接受术后化疗共152例,术后未接受化疗共184例。术后放疗组接受化疗共45例,术后未行放疗组接受化疗共107例。手术入路:左侧开胸310例、右侧开胸10例、颈+腹正中3例、颈+右胸+上腹13例。吻合口位置:颈部吻合29例、弓上吻合263例、弓下吻合44例。全组淋巴结共切除3 567枚(1~29枚,中位淋巴结10枚),阳性淋巴结710枚,淋巴结转移率19.9%。
术后4周行放射治疗,共入组116例。3DCRT的98例、IMRT的18例,患者于德国西门子公司CT模拟机下扫描定位,所得图像传输进入治疗计划系统(ADAC Pinnacle3 8.0m, Philips Medical Systems, USA)。CTV包括原瘤床区、吻合口及相应淋巴引流区(依据美国胸科协会对胸部淋巴结的分组进行淋巴结引流区的勾画),其中胸上段淋巴结引流区包括双侧锁上、2区、4区、5区、6区、7区及8区,下界为气管隆突下2~3 cm;胸中段淋巴结引流区包括2区、4区、5区、6区、7区及8区,下界为贲门淋巴结区;胸下段引流区包括4区、5区、6区、7区、8区、贲门旁、胃小弯和胃左淋巴结区。勾画靶区定义为CTV,在CTV基础上前后左右方向各外放0.3~0.5 cm,上下方向各外放0.5~1.0 cm为PTV,要求95%PTV接受剂量为45~54 Gy分25~28次5周完成,1.8~2.0 Gy/次,中位数50 Gy。双肺V5≤55%、V20≤28%、V30≤18%,脊髓 < 45Gy,心脏Dmean < 30Gy、V30 < 40%、V40 < 30%,胸腔胃V40 < 35%。
1.4 随访和不良反应观察术后放疗后前2年每3~6月常规复查,2年后每年至少复查1次。不良反应采用RTOG(Radiation Therapy Oncology Group)急性放射损伤分级标准进行评价。
1.5 统计学方法采用SPSS13.0软件进行统计学分析,行Kaplan-Meier法计算生存率及局控率;Log rank法检验行单因素预后分析,Cox回归模型多因素预后分析,计数资料比较行卡方检验。P < 0.05为差异有统计学意义。
2 结果 2.1 生存及预后分析全组病例随访至2015年12月1日,失访6例,随访率98.2%。1、3、5年生存率分别为70.5%、37.4%、29.3%,中位生存时间26.7月。1、3、5年无进展生存率分别为62.2%、31.8%、25.6%,中位无进展生存时间17.4月。336例患者中,截至随访日期:失访6例,死亡246例(S组169例、S+R组77例)。死亡患者中,死于局部复发者36例(S组29例、S+R组7例),死于远处转移者142例(S组85例;S+R组57例),复发同时远处转移者42例(S组36例、S+R组6例),死于食管癌以外疾病者21例(S组15例、S+R组6例),死因不明者5例(S组4例、S+R组1例)。
ⅡB期及Ⅲ期患者的五年生存率分别为36.3%和27.6%,中位生存时间分别为38.7和25.3月,差异有统计学意义(χ2=3.998, P=0.046),五年无进展生存率分别为30.7%和22.5%,中位无进展生存时间分别为27.5和19.4月,差异有统计学意义(χ2=4.013, P=0.045)。
术后接受化疗和未接受化疗患者的五年生存率分别为36.0%和23.8%,中位生存时间分别为30.9月和25.0月,差异有统计学意义(χ2=6.225, P=0.013),五年无进展生存率分别为28.9%和20.1%,中位无进展生存时间分别为23.2月和20.2月,差异有统计学意义(χ2=3.948, P=0.047)。
单因素预后分析结果显示术中病变长度、术中粘连程度、TNM分期、术后化疗及术后放疗为预后影响因素(χ2=13.449、12.519、3.998、6.225、7.663, P=0.004、0.002、0.046、0.013、0.006)。多因素预后分析结果显示术中病变长度、术中粘连程度、术后化疗及术后放疗为影响预后独立因素(χ2=5.980、5.521、7.173、12.392, P=0.014、0.019、0.007、0.000)。
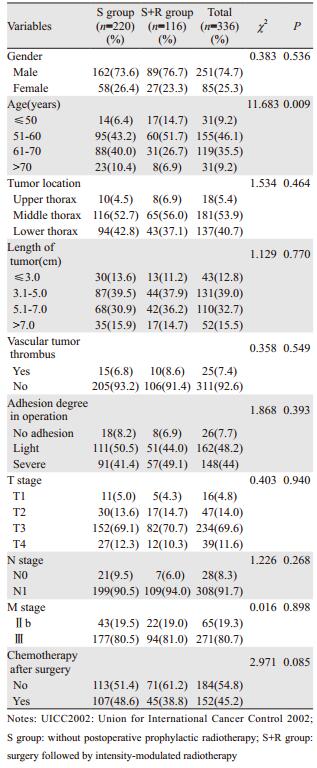
2.2 不同治疗方式的生存分析S组与S+R组1、3、5年生存率分别依次为61.4%、33.6%、25.9%与87.9%、44.6%、35.8%;中位生存时间分别为23.4和32.9月,差异有统计学意义(χ2=7.663, P=0.006)。1、3、5年无进展生存率分别依次为55.5%、29.1%、20.4%与75.0%、37.1%、31.0%;中位无进展生存时间分别为17.4和25.5月,差异有统计学意义(χ2=8.461, P=0.004),见图 1。
|
| 图 1 336例患者术后未行放疗组与术后放疗组OS与DFS曲线 Figure 1 OS and DFS curves of 336 patients in S and S+R groups |
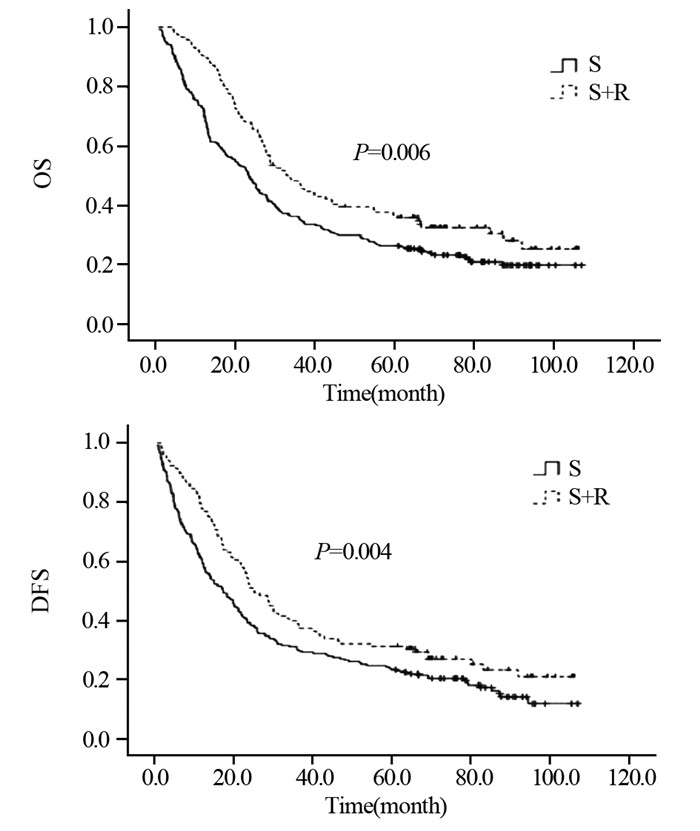
S组与S+R组1、3、5年生存率分别依次为60.3%、32.2%、23.6%与87.2%、42.9%、35.4%;中位生存时间分别为23.3和32.6月,差异有统计学意义(χ2=7.663, P=0.003)。1、3、5年无进展生存率分别为53.8%、27.1%、20.1%与75.2%、35.8%、31.2%;中位无进展生存时间分别为16.4和24.8月,差异有统计学意义(χ2=8.348, P=0.004),见图 2。
|
| 图 2 术后病理淋巴结阳性患者术后未行放疗组与术后放疗组OS与DFS曲线 Figure 2 OS and DFS curves of lymph node-positive patients in S and S+R groups |
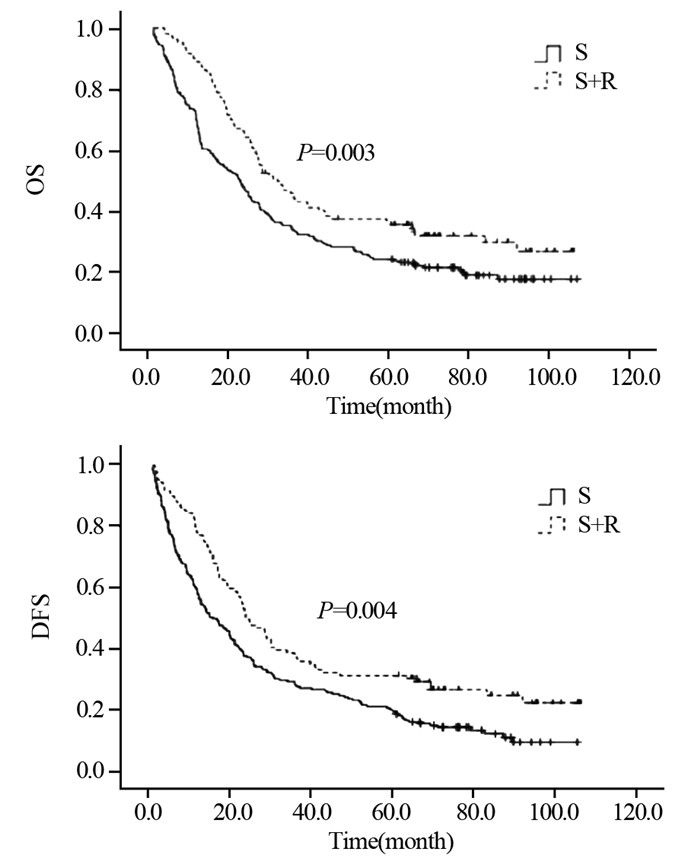
S组与S+R组5年生存率分别依次为30.1%与48.6%;中位生存时间分别为31.5和45.4月,差异无统计学意义(χ2=2.279, P=0.131)。两组患者5年无进展生存率分别依次为23.1%与45.5%;中位无进展生存时间分别为22.5和36.0月,差异无统计学意义(χ2=3.469, P=0.063),见图 3。
|
| 图 3 ⅡB期患者术后未行放疗组与术后放疗组OS与DFS曲线 Figure 3 OS and DFS curves of stage ⅡB patients in S and S+R groups |
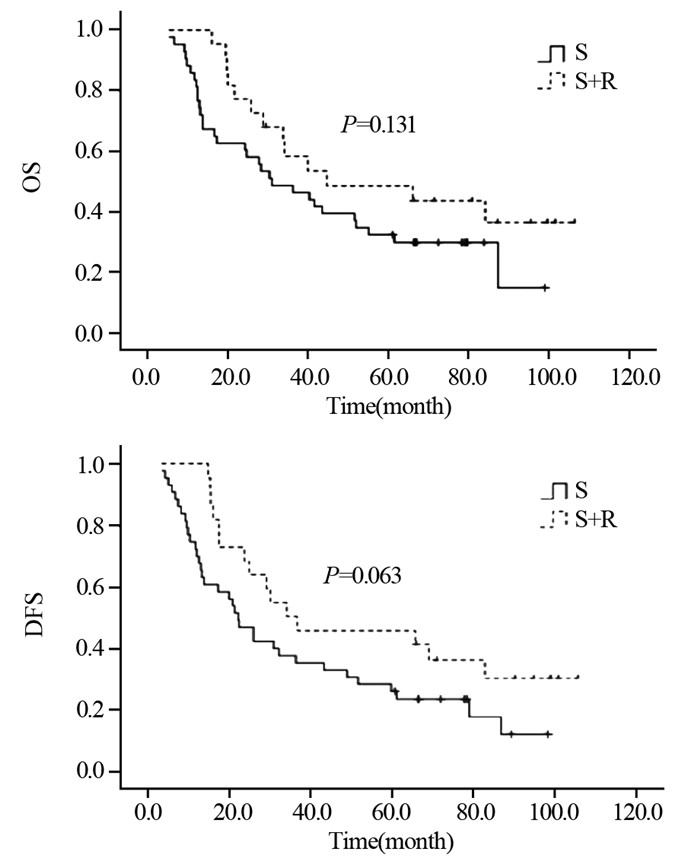
S组与S+R组5年生存率分别为24.9%与32.8%;中位生存时间分别为22.3和30.0月,差异有统计学意义(χ2=5.865, P=0.015)。两组患者5年无进展生存率分别为19.8%与27.7%;中位无进展生存时间分别为16.2和23.7月,差异有统计学意义(χ2=5.578, P=0.018),见图 4。
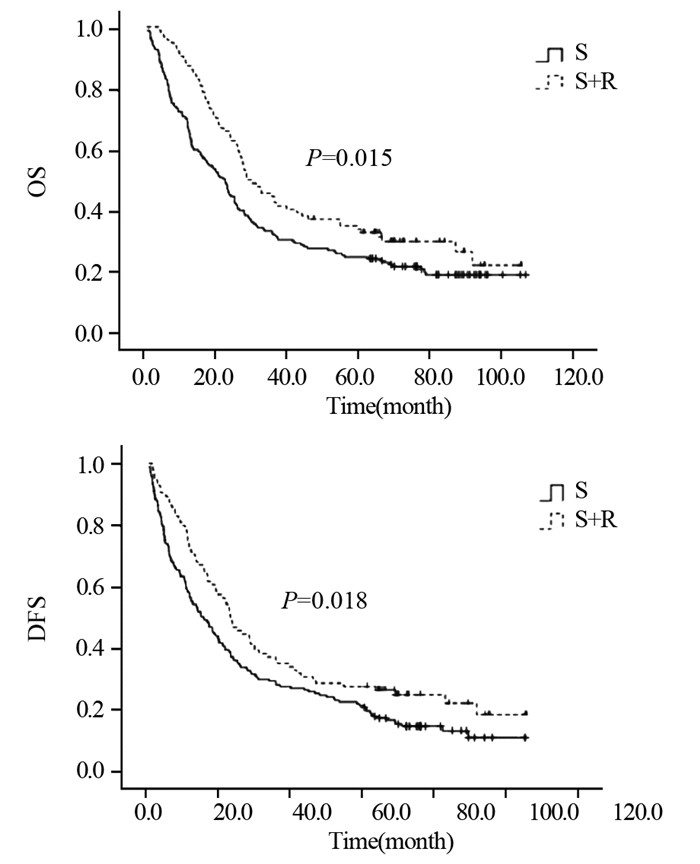
|
| 图 4 Ⅲ期患者术后未行放疗组(S)与术后放疗组(S+R)OS与DFS曲线 Figure 4 OS and DFS curves of stage Ⅲ patients in S and S+R groups |
术后局部失败主要包括淋巴引流区域淋巴结转移及吻合口复发(淋巴结短径≥10 mm或同一区域内出现3个及以上淋巴结定义为淋巴结转移,吻合口复发需病理证实),本组患者中锁上淋巴结转移共29例(S组24例,S+R组5例,χ2=4.194, P=0.041),纵隔淋巴结转移共71例(S组55例,S+R组16例,χ2=5.724, P=0.017),腹腔淋巴结转移共22例(S组14例,S+R组8例,χ2=0.035, P=0.851),吻合口复发共13例(S组12例,S+R组1例,χ2=4.307, P=0.038)。S组与S+R组的中位局控时间分别为10.6和16.3月,差异有统计学意义(χ2=6.043, P=0.014)。
2.5 治疗不良反应根据RTOG急性放射损伤分级标准,急性放射性食管(胃)炎发生率为55.17%(64/116),其中1、2、3级分别为34例、26例、4例;急性放射性肺炎发生率为15.52%(18/116),其中1、2级分别为15例、3例。全组发生吻合口狭窄者共6例(1.78%, 6/336),其中术后未行放疗组3例,术后放疗组3例。全组发生吻合口瘘者共10例(2.98%, 10/336),其中术后未行放疗组9例,术后放疗组1例。
3 讨论放射治疗在食管癌治疗中占据着重要地位。大量研究已经证实接受食管癌根治术的患者以区域性复发为主要失败模式。Li等[1]报道了134例胸段食管癌根治术后患者的复发模式,其中94.0%(126/134)的患者出现区域淋巴结转移,9.7%(13/134)出现吻合口复发,3.7%(5/134)出现原瘤床区复发。在区域淋巴结转移的患者中,纵隔、锁上及腹腔的淋巴结转移发生率依次为80.2%、43.7%和13.5%。在纵隔淋巴结转移的患者中,上、中、下纵隔淋巴结转移发生率依次为73.8%、39.7%、1.6%。由此推荐术后放疗区域应包括锁上及上纵隔淋巴引流区以降低局部区域复发。Smit等[2]统计发现胸段食管癌根治术后1、3、5年区域复发率分别为17%、27%、43%,阳性淋巴结数目大于4个提示区域复发可能性增大。由此可见,挑选食管癌术后的合适人群行术后放疗以降低局部复发进而达到生存获益就显得尤为重要。已有研究[8-11]证实食管癌根治术后行放射治疗可以明显降低局部区域复发,本研究同样得到相似的结果。但该治疗方式对患者生存方面的影响仍有较大争议。
本研究通过对术后分期为ⅡB、Ⅲ期胸段食管癌根治术患者接受预防性放疗后的生存数据进行统计分析,结果显示术后放疗对生存改善的优越性。在术后分期为Ⅲ期患者中,手术组与术后放疗组5年生存率分别依次为24.9%与32.8%;中位生存时间分别为22.3和30.0月,差异有统计学意义(χ2=5.865, P=0.015)。两组患者5年无进展生存率分别为19.8%与27.7%;中位无进展生存时间分别为16.2和23.7月,差异有统计学意义(χ2=5.578, P=0.018)。在术后病理淋巴结阳性的患者中得到同样的结果,手术组与术后放疗组5年生存率及5年无进展生存率差异均有统计学意义。而Tachibana等[4]的一项随机对照研究将45例食管癌根治术后患者随机分为术后化疗组(23例)和术后放化疗组(22例),两组患者1、3、5年生存率分别为100%、63%、38%和80%、58%、50%,差异无统计学意义(P=0.97)。国内的一项前瞻性随机对照研究[11]将495例接受食管癌根治术的患者随机分为单纯手术组(275例)和术后放疗组(220例),两组患者的5年生存率分别为31.7%和41.3%(P=0.4474),进一步分层分析发现淋巴结阳性组患者5年生存率分别为14.7%和29.2%(P=0.0698),术后分期为Ⅲ期患者5年生存率分别为13.1%和35.1%(P=0.0027)。近期的一项回顾性研究[12]将接受食管癌根治术的术后病理淋巴结阳性和Ⅲ期的538例患者分为单纯手术组348例和术后放疗组190例,淋巴结阳性组患者的5年生存率分别为28.4%和38.8%(P < 0.001),术后分期为Ⅲ期患者的5年生存率分别为24.0%和38.0%(P=0.001),两组患者的5年疾病无进展生存率差异均有统计学意义,术后放疗组患者明显优于术后未行放疗组。本组研究结果与Zhang等研究[12]结果相似,但与既往研究结论[4, 11]不符,究其原因可能为该两项研究分析中入组患者所接受的放疗技术均为二维放疗技术。和三维放疗技术相比,二维放疗存在剂量分布不均匀及因保护危及器官而致靶区照射不全的局限性,其位置精度及剂量精度均较低,且放疗不良反应较大,导致放疗疗效不佳,进而影响患者的生存预后[13]。另外Tachibana等[4]研究未进行分层分析也可能是其得到阴性结果的原因。本研究中术后分期为ⅡB期的患者,手术组与术后放疗组的5年生存率及5年无进展生存率差异均无统计学意义,但可以看到术后放疗对其生存的改善趋势,考虑可能由于本研究入组病例中分期为ⅡB期的患者样本量较小所致。因此,食管癌根治术后放射治疗对分期为ⅡB期的患者的生存影响仍需扩大样本量进一步研究。
在治疗不良反应方面,因本研究中术后放疗范围为原瘤床区、吻合口及纵隔相应淋巴引流区,虽残留食管及胸腔胃作为危及器官在放疗计划制定中已加以保护,但因其位置接近甚至部分食管(胃体)处于放疗区域内,故其受放射线影响仍较大,导致放射性食管(胃)炎发生率较高[14]。因术后预防性放疗总剂量不高(45~54 Gy),且三维适形放疗技术的应用,故放射性肺炎发生率较低。本组研究入组患者中吻合口瘘大部分发生于单纯手术组,考虑可能由于本组患者吻合口瘘大部分发生于术后早期,患者一般状况差,故未能接受术后放疗。
综上所述,食管癌根治术后预防性放疗可明显降低局部复发并使Ⅲ期及术后病理淋巴结阳性的患者生存获益,其对ⅡB期患者的生存影响仍需相关的回顾性和前瞻性研究进一步证实。
| [1] | Li CL, Zhang YD, Wang YD, et al. Characteristics of recurrence after radical esophagectomy with two-field lymph node dissection for thoracic esophageal cancer[J]. Oncol Lett, 2013, 5(1): 355–9. DOI:10.3892/ol.2012.946 |
| [2] | Smit JK, Pultrum BB, van Dullemen HM, et al. Prognostic factors and patterns of recurrence in esophageal cancer assert arguments for extended two-field transthoracic esophagectomy[J]. Am J Surg, 2010, 200(4): 446–53. DOI:10.1016/j.amjsurg.2009.12.006 |
| [3] | Fok M, Sham JS, Choy D, et al. Postoperative radiotherapy for carcinoma of the esophagus: a prospective, randomized controlled study[J]. Surgery, 1993, 113(2): 138–47. |
| [4] | Tachibana M, Yoshimura H, Kinugasa S, et al. Postoperative chemotherapy vs. chemoradiotherapy for thoracic esophageal cancer: a prospective randomized clinical trial[J]. Eur J Surg Oncol, 2003, 29(7): 580–7. DOI:10.1016/S0748-7983(03)00111-2 |
| [5] | 陈俊强, 潘建基, 陈明强, 等. 胸段食管鳞癌淋巴结转移数和区域与术后放疗价值的临床研究[J]. 中华放射肿瘤学杂志, 2010, 19(2): 105–9. [ Chen JQ, Pan JJ, Chen MQ, et al. Value of the number and distribution of metastatic lymph nodes in postoperative radiotherapy for thoracic esophageal squamous cell carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2010, 19(2): 105–9. ] |
| [6] | Chen J, Zhu J, Pan J, et al. Postoperative radiotherapy improved survival of poor prognostic squamous cell carcinoma esophagus[J]. Ann Thorac Surg, 2010, 90(2): 435–42. DOI:10.1016/j.athoracsur.2010.04.002 |
| [7] | Xu Y, Liu J, Du X, et al. Prognostic impact of postoperative radiation in patients undergoing radical esophagectomy for pathologic lymph node positive esophageal cancer[J]. Radiat Oncol, 2013, 8(1): 116. DOI:10.1186/1748-717X-8-116 |
| [8] | 章文成, 王奇峰, 肖泽芬, 等. Ⅱ和Ⅲ期胸段食管癌术后预防性三维放疗疗效分析[J]. 中华放射肿瘤学杂志, 2012, 21(2): 136–9. [ Zhang WC, Wang QF, Xiao ZF, et al. A efficacy analysis of intensity-modulated radiotherapy for resected thoracic esophageal squamous cell carcimoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2012, 21(2): 136–9. ] |
| [9] | 沈文斌, 高红梅, 祝淑钗, 等. Ⅱ和Ⅲ期胸段食管鳞癌术后不同辅助治疗方式治疗后的失败模式分析[J]. 肿瘤防治研究, 2017, 44(5): 340–6. [ Shen WB, Gao HM, Zhu SC, et al. Pateerns of failure after radical surgery on patients with stage Ⅱ/Ⅲ thoracic esophageal squamous cell carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(5): 340–6. ] |
| [10] | Schreiber D, Rineer J, Vongtama D, et al. Impact of postoperative radiation after esophagectomy for esophageal cancer[J]. J Thorac Oncol, 2010, 5(2): 244–50. DOI:10.1097/JTO.0b013e3181c5e34f |
| [11] | Xiao ZF, Yang ZY, Liang J, et al. Value of radiotherapy after radical surgery for esophageal carcinoma: a report of 495 patients[J]. Ann Thorac Surg, 2003, 75(2): 331–6. DOI:10.1016/S0003-4975(02)04401-6 |
| [12] | Zhang WC, Liu X, Xiao ZF, et al. Postoperative Intensity-Modulated Radiotherapy Improved Survival in Lymph Node-Positive or Stage Ⅲ Thoracic Esophageal Squamous Cell Carcinoma[J]. Oncology Research and Treatment, 2015, 38(3): 97–102. DOI:10.1159/000375391 |
| [13] | Lin SH, Wang L, Myles B, et al. Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs. intensity-modulated radiotherapy for esophageal cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): 1078–85. DOI:10.1016/j.ijrobp.2012.02.015 |
| [14] | Liu Q, Cai XW, Fu XL, et al. Tolerance and dose-volume relationship of intrathoracic stomach irradiation after esophagectomy for patients with thoracic esophageal squamous cell carcinoma[J]. Oncotarget, 2015, 6(31): 32220–37. |
 2018, Vol. 45
2018, Vol. 45