文章信息
- 79例肺肉瘤样癌的临床特征及预后分析
- Clinical Features and Prognosis of 79 Cases of Pulmonary Sarcomatoid Carcinoma
- 肿瘤防治研究, 2018, 45(5): 295-299
- Cancer Research on Prevention and Treatment, 2018, 45(5): 295-299
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1144
- 收稿日期: 2017-09-12
- 修回日期: 2018-01-25
2. 450000 郑州,郑州大学第一附属医院放疗科
2. Department of Radiotherapy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China
肺肉瘤样癌(pulmonary sarcomatoid carcinoma, PSC)是一组进展迅速、分化差的少见的肺部肿瘤,以组织中包含肉瘤或肉瘤样成分(梭形细胞和(或)巨细胞)为特征,约占非小细胞肺癌(non-small cell lung cancer, NSCLC)的0.1%~0.4%。根据2015年WHO分类,将PSC分为5个亚型:多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤[1]。本研究回顾性分析了79例PSC患者的临床资料,旨在了解PSC的临床特征及预后因素。
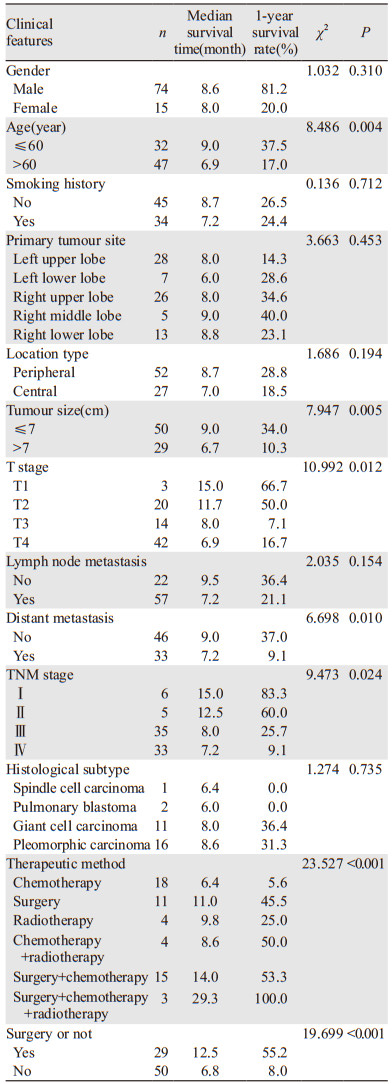
1 资料与方法 1.1 临床资料本研究经郑州大学第一附属医院伦理委员会批准,所有患者均知情同意。收集2012年6月至2016年10月在郑州大学第一附属医院诊治的PSC患者,共计79例。所有患者的病理资料均经两名有经验的病理学专家按照2015年WHO对PSC的分类进行诊断。其中多形性癌16例、梭形细胞癌1例、巨细胞癌11例、肺母细胞瘤2例,其余49例未明确具体亚型。其中男64例、女15例,男女比例为4.3:1。发病年龄为37~87岁,中位年龄62岁。其中无吸烟史者34例、有吸烟史者45例。患者多以咳嗽、胸闷、发热、咳痰、痰中带血、咯血、胸痛等为初诊症状。肿瘤原发部位位于左肺上叶28例、下叶7例、右肺上叶26例、中叶5例、下叶13例。外周型52例、中央型27例。按照IASLC第八版肺癌TNM分期,其中Ⅰ期6例、Ⅱ期5例、Ⅲ期35例、Ⅳ期33例。肿瘤最大直径≤7 cm者50例、> 7 cm者29例,见表 1。其中13例患者进行ALK融合基因的检测、11例进行EGFR基因突变状态检测、9例进行Kras基因突变状态检测、4例进行Braf基因突变状态检测、6例进行MET基因突变状态检测。
|
79例患者中11例单纯接受手术治疗、18例单纯接受化疗、15例术后进行辅助化疗、4例接受化疗联合放疗、3例接受术后辅助化疗及放疗、4例接受局部病灶放射治疗、其余24例患者因各种原因在确诊后放弃进一步治疗。
1.3 随访采用门诊或电话方式对患者进行随访,随访时间截至2017年6月。随访2~40.4月,中位随访时间8月,随访资料完整,生存期即自确诊之日至末次随访日或死亡时间。随访结束时有4名患者仍存活,余75名患者已死亡。
1.4 统计学方法采用SPSS19.0软件进行统计分析。计数资料比较采用χ2检验,采用Kaplan-Meier法绘制生存曲线,Long rank法进行生存率显著性检验,多因素分析采用Cox回归分析,P < 0.05为差异有统计学意义。
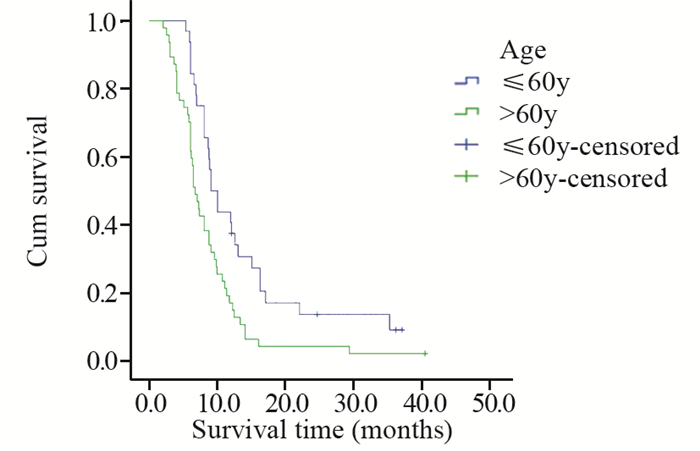
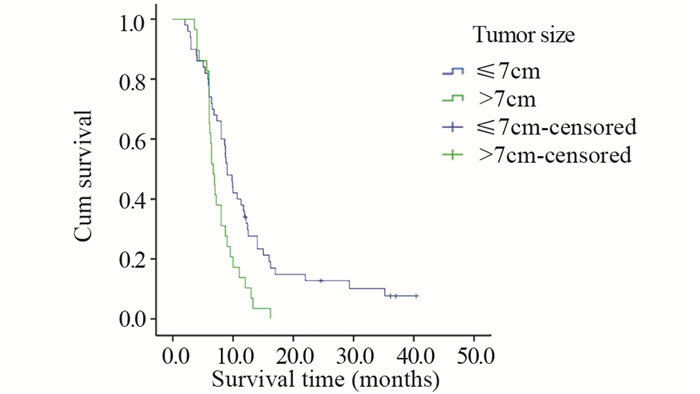
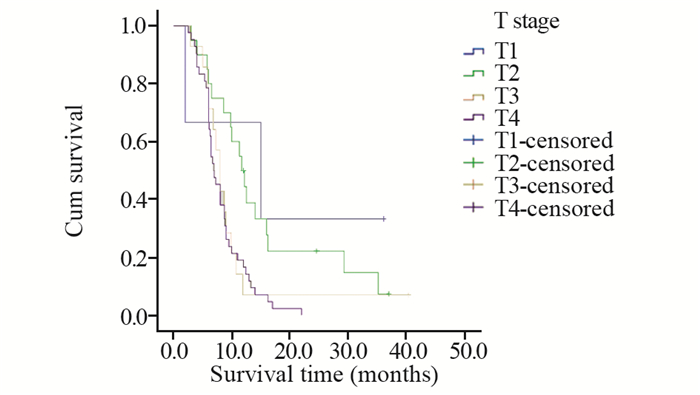
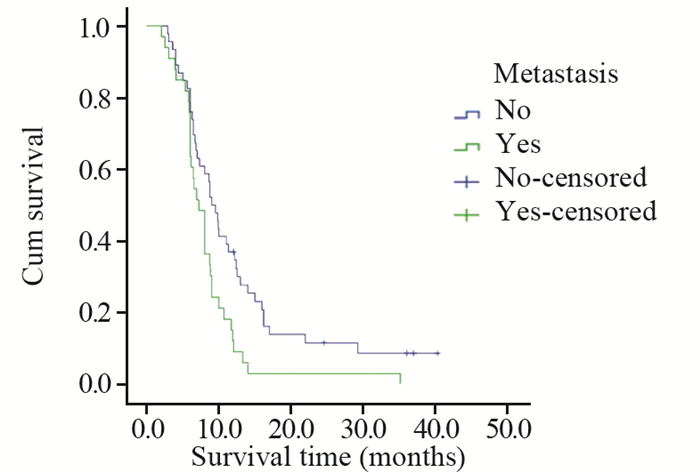
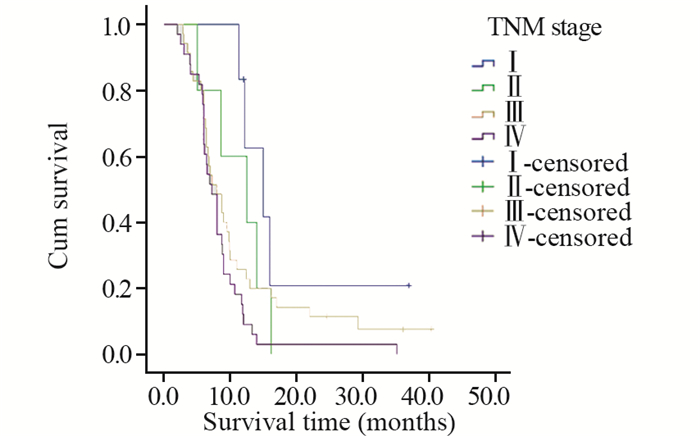
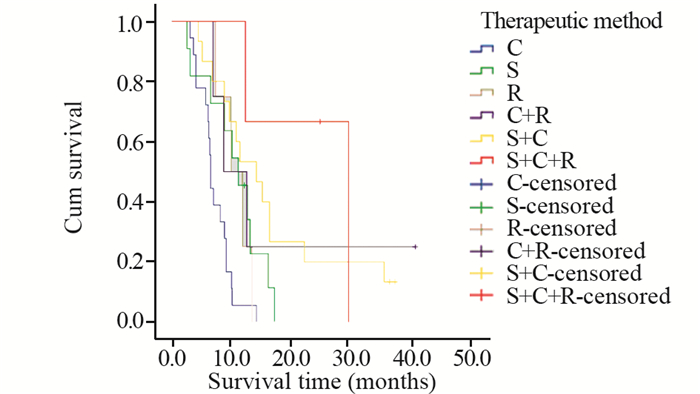
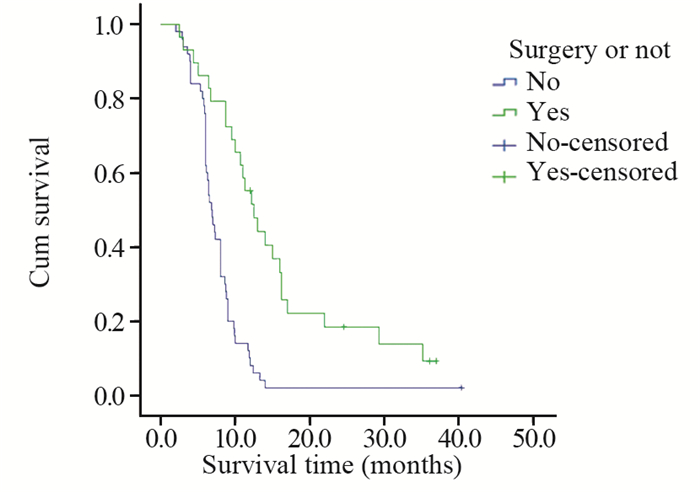
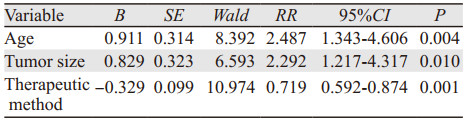
2 结果 2.1 生存分析本研究中患者平均生存时间为10.8月,中位生存时间为8.0月。对患者的临床特征包括性别、年龄、是否有吸烟史、肿瘤的原发部位、位置类型、肿瘤的大小、T分期、有无淋巴结转移、有无远处转移、TNM分期、组织学亚型、治疗方法及是否手术进行统计学分析。预后单因素分析结果显示,患者的性别(χ2=1.032, P=0.310)、是否有吸烟史(χ2=0.136, P=0.712)、肿瘤的原发部位(χ2=3.663, P=0.453)、位置类型(χ2=1.686, P=0.194)、有无淋巴结转移(χ2=2.035, P=0.154)及组织学亚型(χ2=1.274, P=0.735)与患者的生存率差异均无统计学意义;而年龄(χ2=8.486, P=0.004)、肿瘤大小(χ2=7.947, P=0.005)、T分期(χ2=10.992, P=0.012)、有无远处转移(χ2=6.698, P=0.010)、TNM分期(χ2=9.473, P=0.024)、治疗方法(χ2=23.572, P < 0.001)及是否手术(χ2=19.699, P < 0.001)与患者的生存率差异均有统计学意义,见表 1,图 1~7。预后多因素分析结果显示,患者年龄、肿瘤大小和治疗方法是影响预后的独立因素,见表 2。
|
| 图 1 不同年龄的肺肉瘤样癌患者的生存曲线 Figure 1 Survival curves of PSC patients with of different ages |
|
| 图 2 不同肿瘤大小的肺肉瘤样癌患者的生存曲线 Figure 2 Survival curves of PSC patients with of different tumour sizes |
|
| 图 3 不同T分期的肺肉瘤样癌患者的生存曲线 Figure 3 Survival curves of patients with PSC different T stages |
|
| 图 4 不同M分期的肺肉瘤样癌患者的生存曲线 Figure 4 Survival curves of PSC patients with different M stages |
|
| 图 5 不同TNM分期的肺肉瘤样癌患者的生存曲线 Figure 5 Survival curves of PSC patients with different TNM stages |
|
| C: chemotherapy, S: surgery, R: radiotherapy 图 6 不同治疗方法的肺肉瘤样癌患者的生存曲线 Figure 6 Survival curves of PSC patients with of different therapeutic methods |
|
| 图 7 是否手术的肺肉瘤样癌患者的生存曲线 Figure 7 Survival curves of PSC patients with undergoing surgery or not |
|
79例PSC患者中,细胞角蛋白(cytokeratin, CK)和波形蛋白的阳性率较高,分别为91%(58/64)、93%(52/56);其次为上皮细胞膜抗原(epithelial membrane antigen, EMA)和CK7,阳性率分别为68%(17/25)、67%(24/36),CD68、甲状腺转录因子-1(thyroid transcription factor, TTF-1)的阳性率分别为27%(4/15)、26%(17/65),CK5/6、P63和S-100蛋白的阳性率较低,分别为14%(8/56)、13%(4/31)、12%(4/33)。
2.3 基因状态分析79例PSC样本中,11例进行EGFR基因突变状态检测,均未发现突变,13例进行ALK融合基因的检测,均未发现突变,6例进行MET基因检测,发现1例存在MET 14外显子突变,突变率为16.67%(1/6),9例进行Kras基因检测,阳性率为44.44%(4/9),其中Kras G12A突变率为22.22%(2/9)和Kras G12D突变率为22.22%(2/9),4例患者均为男性,4例进行Braf基因检测,均未发现突变。
3 讨论肉瘤样癌最早由Virchow在1864年提出,除了肺母细胞瘤外,其他亚型一般发生在中老年男性,约占肺恶性肿瘤的0.1%~0.4%[2-3],预后较其他非小细胞肺癌差[4-5]。相关文献报道称,PSC是一组起源于相同原始上皮,经上皮间质转化(epithelial-mesenchymal transition, EMT)及完全性间叶表型关闭后形成的一组转化性癌[2]。PSC潜在的双向分化模式及具有高度侵袭性的分子基础一直都不为人知。最近有研究表明驱动基因的改变,如最常见的Kras和MET突变,可能有助于PSC的发生[2, 6]。在上皮成分向肉瘤样成分转化时,由某些基因改变所驱动的EMT扮演着重要角色。
PSC多见于60岁以上中老年男性患者,半数以上患者有吸烟史,男女患者比例为4:1[5, 7-8],本组研究中男女比例为4.3:1,60%的患者有吸烟史(45/79),然而吸烟与否对于患者的预后并无显著的统计学意义(P=0.712)。与其他类型的肺癌相比,PSC侵袭性强,但临床表现并无特异性[9],根据肿瘤侵犯的部位可出现咳嗽、胸闷、发热、咳痰、痰中带血、咯血、胸痛等症状。鉴于PSC侵袭性强,多数患者在就诊时已是疾病的中晚期。本研究中确诊为Ⅲ期和Ⅳ期患者占86%(68/79)。此外,通常患者初次就诊时肿块就已较大,多数肿块边界清楚,有明显的出血和坏死,多位于两肺上叶[10],本研究中最大肿块直径达12 cm,多位于两肺上叶,其中左肺上叶占35%(28/79),右肺上叶占33%(26/79),右肺下叶占16%(13/79),左肺下叶占9%(7/79),右肺中叶占6%(5/79),以周围型多见,占66%(52/79),上述临床特征与既往文献报道一致。
2004年之前,没有统一的诊断标准来定义PSC,现在WHO要求诊断PSC需采用手术标本,可辅以免疫组织化学和电子显微镜检查。本研究中,由于部分患者在就诊时已处于疾病的中晚期,不具备手术指征,故标本的获取依靠纤维支气管镜活检或CT引导下肺穿刺,同时辅以免疫组织化学检查,确诊PSC。目前临床上针对PSC患者常用的免疫组织化学检测指标主要包括两大类:一类是上皮生物学标志物,包括细胞角蛋白(CK)、上皮细胞膜抗原(EMA)等;另一类是间质细胞生物学标志物,包括波形蛋白(Vimentin)、S-100蛋白、结蛋白(desmin)、CD68等[11-12, 7],本研究中CK及Vimentin阳性率较高,EMA及CK7中度表达,CD68、TTF-1、CK5/6、S-100及P63阳性率较低。
PSC的治疗原则同其他类型的NSCLC,手术是早期患者首选的治疗方式,既往文献报道,手术治疗的患者中位总生存时间约为14月[2, 13]。本研究中,有29例患者接受了手术治疗,其中有18例术后进行辅助化疗或局部放射治疗,中位总生存时间为12.5月,1年生存率为55.2%,相比于文献报道[2],本研究中手术患者的中位生存时间较短,可能与患者的手术分期较晚或术后患者未规律放化疗有关;而未接受手术治疗的患者共50例,其中位生存时间为6.8月,1年生存率为8.0%,两组比较差异有统计学意义(P < 0.001),说明手术切除在PSC治疗过程中起着至关重要的作用。文献报道,PSC的中位总生存时间为14月[14],本研究中为8月,低于文献报道,可能与本组患者分期较晚有关。既往文献报道,PSC对全身化疗的反应率极低,大约在0~17%[7],此外,目前无特定的生物标志物来提示化疗效果。本研究中,共有40例患者接受以铂为基础的方案化疗,其总体反应率为7%。鉴于传统化疗的效果令人失望,迫切需要新的治疗方法来更有效地治疗PSC。
驱动基因的识别,尤其是MET 14外显子跳跃突变的发现对肺肉瘤样癌的靶向治疗带来了曙光。关于PSC发生MET 14外显子跳跃突变的概率意见不一(3%~22%),这可能与人口、种族、临床及病理特征等相关[15-16]。本研究中有6例患者进行了MET基因的检测,其中仅有1例发生突变。针对PD-1/PD-L1通路的免疫治疗是近几年新兴的肺癌治疗方法,有文献报道,PSC患者肿瘤组织PD-L1表达率高达53%[17],这意味着,免疫治疗或许是未来PSC治疗的方向。此外,有文献报道,TP53基因、Kras基因突变率分别为58%和30%,ALK重排发生率为3%[18],且有文献报道,Kras基因突变的表达是PSC不良预后因素之一[19],本研究中9例患者进行Kras基因的检测,其中4例发生了突变,发生率与既往报道接近。因此目前临床医生对于PSC进行基因检测的意识需要加强,提高对PSC及相关突变基因的认识,以指导临床治疗。
综上所述,PSC多见于长期吸烟的老年男性,发病率低,临床表现不特异,需要组织学及免疫组织化学检查确诊,预后不良。主要治疗方法为手术切除辅助化放疗,少数患者存在MET突变,可以尝试靶向治疗。未来几年内,应该可以看到关于PSC的诊断及治疗指南快速更新。为了解肿瘤的双向分化模式、基因及功能异质性等,需要开展进一步的研究。
| [1] | Avila Martínez RJ, Marrón Fernández C, Hermoso Alarza F, et al. Primary pulmonary sarcomatoid carcinomas[J]. Arch Bronconeumol, 2013, 49(9): 405–7. DOI:10.1016/j.arbres.2012.12.002 |
| [2] | Elaine Shum, Matthew Stuart, Alain Borczuk, et al. Recent advance in management of pulmonary sarcomatoid carcinoma[J]. Expert Review of Respiratory Medicine, 2016, 10(4): 407–16. DOI:10.1586/17476348.2016.1157475 |
| [3] | Yendamuri S, Caty L, Pine M, et al. Outcomes of sarcomatoid carcinoma of the lung:a Surveillance, Epidemiology, and End Results Database analysis[J]. Surgery, 2012, 152(3): 397–402. DOI:10.1016/j.surg.2012.05.007 |
| [4] | Huang SY, Shen SJ, Li XY. Pulmonary sarcomatoid carcinoma: a clinicopathologic study and prognostic analysis of 51 cases[J]. World J Surg Oncol, 2013, 11: 252. DOI:10.1186/1477-7819-11-252 |
| [5] | Zehani A, Ayadi-Kaddour A, Marghli A, et al. Sarcomatoid carcinoma of the lung: retrospective study of 28 cases[J]. Ann Pathol, 2014, 34(2): 124–9. DOI:10.1016/j.annpat.2013.12.001 |
| [6] | Lee C, Usenko D, Frampton GM, et al. MET 14 Deletion in Sarcomatoid Non-Small-Cell Lung Cancer Detected by Next-Generation Sequencing and Successfully Treated with a MET Inhibitor[J]. J Thorac Oncol, 2015, 10(12): e113–4. |
| [7] | Ouziane I, Boutayeb S, Mrabti H, et al. Sarcomatoid carcinoma of the lung: a model of resistance of chemotherapy[J]. N Am J Med Sci, 2014, 6(7): 342–5. DOI:10.4103/1947-2714.136920 |
| [8] | 罗扬, 冯奉仪. 22例肺肉瘤样癌临床分析[J]. 肿瘤防治研究, 2009, 36(3): 247–50. [ Luo Y, Feng FY. Clinical analysis of pulmonary sarcomatoid carcinoma-22 cases report[J]. Zhong Liu Fang Zhi Yan Jiu, 2009, 36(3): 247–50. ] |
| [9] | Vieira T, Girard N, Ung M, et al. Efficacy of first-line chemotherapy in patients with advanced lung sarcomatoid carcinoma[J]. J Thorac Oncol, 2013, 8(12): 1574–7. |
| [10] | Shen XY, Lin ZF, Lin Q, et al. Pulmonary sarcomatoid carcinoma: a case report[J]. Contemp Oncol (Pozn), 2013, 17(2): 210–3. |
| [11] | Terra SB, Aubry MC, Yi ES, et al. Immunohistochemical study of 36 cases of pulmonary sarcomatoid carcinoma--sensitivity of TTF-1 is superior to napsin[J]. Hum Pathol, 2014, 45(2): 294–302. DOI:10.1016/j.humpath.2013.09.005 |
| [12] | Cadioli A, Rossi G, Costantini M, et al. Cancer histologic and immunohistochemical heterogeneity in the era of molecular therapies: analysis of 172 consecutive surgically resected, entirely sampled pulmonary carcinomas[J]. Am J Surg Pathol, 2014, 38(4): 502–9. |
| [13] | Petrov DB, Vlassov VI, Kalaydjiev GT, et al. Primary pulmonary sarcomas and carcinosarcomas-postoperative results and comparative survival analysis[J]. Eur J Cardiothorac Surg, 2003, 23(4): 461–6. DOI:10.1016/S1010-7940(03)00024-1 |
| [14] | 熊伟杰, 张新星, 黄媚媚, 等. 32例晚期及术后复发肺肉瘤样癌患者的治疗及生存分析[J]. 四川大学学报(医学版), 2014, 45(2): 320–3. [ Xiong WJ, Zhang XX, Huang MJ, et al. Outcomes of treatment of 32 cases of advanced or relapsed post-surgery pulmonary sarcomatoid carcinoma[J]. Sichuan Da Xue Xue Bao(Yi Xue Ban), 2014, 45(2): 320–3. ] |
| [15] | Giroux Leprieur E, Antoine M, Vieira T, et al. Clinical and molecular features in patients with advanced non-small-cell lung carcinoma refractory to first-line platinum-based chemotherapy[J]. Lung Cancer, 2013, 79(2): 167–72. DOI:10.1016/j.lungcan.2012.10.010 |
| [16] | Liu X, Jia Y, Stoopler MB, et al. Next-generation sequencing of pulmonary sarcomatoid carcinoma reveals high frequency of actionable MET gene mutations[J]. J Clin Oncol, 2016, 34(8): 794–802. DOI:10.1200/JCO.2015.62.0674 |
| [17] | Vieira T, Antoine M, Hamard C, et al. Sarcomatoid lung carcinomas show high levels of programmed death ligand-1 (PD-L1) and strong immune-cell infiltration by TCD3 cells and macrophages[J]. Lung Cancer, 2016, 98: 51–8. DOI:10.1016/j.lungcan.2016.05.013 |
| [18] | Terra SB, Jang JS, Bi L, et al. Molecular characterization of pulmonary sarcomatoid carcinoma: analysis of 33 cases[J]. Mod Pathol, 2016, 29(8): 824–31. DOI:10.1038/modpathol.2016.89 |
| [19] | Lococo F, Gandolfi G, Rossi G. Deep-sequencing analysis reveals that KRAS mutation is a marker of poor prognosis in pulmonary sarcomatoid carcinoma patients[J]. J Thorac Oncol, 2016, 11(8): 1282–92. DOI:10.1016/j.jtho.2016.04.020 |
 2018, Vol. 45
2018, Vol. 45


