文章信息
- 唾液中miRNA-21对早期喉鳞状细胞癌的诊断价值
- Diagnostic Values of Salivary miRNA-21 for Early Laryngeal Squamous Cell Carcinoma
- 肿瘤防治研究, 2018, 45(5): 320-325
- Cancer Research on Prevention and Treatment, 2018, 45(5): 320-325
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1137
- 收稿日期: 2017-09-12
- 修回日期: 2018-01-11
头颈癌是全世界第六大常见肿瘤类型,其中喉癌是头颈部最常见的恶性肿瘤之一,而喉鳞状细胞癌(laryngeal squamous cell carcinoma, LSCC)是喉癌中最常见的组织学类型(约85%~90%)[1]。随着医学的发展,喉癌的治疗方式也越来越多,但喉癌的死亡率并没有明显改善[2],其主要原因是目前缺乏简单适用的筛查方法。
微小RNA(microRNA, miRNA)是指长度约22个核苷酸的内源性微小非编码RNA,是多种生物学过程的有效调节子[3]。对miRNA的研究表明:miRNA参与了人体细胞内多种重要的调节过程[4]。其中miRNAs与肿瘤发生、发展的关系已成为目前研究的热点。近年来,有关miRNA在LSCC诊断及转移等方面的研究层出不穷,已有多项研究发现LSCC患者的组织和血液(包括血清和血浆)中有特别的miRNA表达谱[5-7],并能提示LSCC的诊断。而对于miRNA在LSCC患者唾液中的表达水平以及其对早期LSCC的诊断价值如何,国内外至今未见研究报道。唾液作为血液循环的末端产物,与血液中的很多物质都有相同的表达谱,目前,已发现唾液上清液(无细胞)中含有上千种分子物质,包括蛋白质、mRNA、miRNA、代谢产物等[8-11]。相比于组织标本,唾液的非侵入性更适合早期筛查。相比于血液标本,由于头颈部鳞状细胞癌大多数是涉及口腔及咽喉部的病变,唾液作为最邻近病变组织的标本来源,其miRNA的含量可能比血液高,因此唾液中的miRNA作为生物标志物对LSCC的诊断和预后判断是非常吸引人的。所以目前唾液miRNA在头颈部鳞癌中的研究仍是热点,其中口咽癌、食管癌等[12-13]都有单独的研究并发现有特征的唾液miRNA变化谱,而单独的LSCC患者唾液中miRNA的表达水平还未见报道过。
miRNA-21作为miRNAs家族中的一员,在许多肿瘤中扮演着重要的角色,包括乳腺癌、肝癌、食管癌、喉癌等[5, 13-15],其在LSCC患者唾液中的表达在国内外还缺乏前瞻性的研究。此次研究我们将探讨LSCC患者唾液中miRNA-21对LSCC早期诊断的临床价值。
1 资料与方法 1.1 研究对象与分组研究对象为西南医科大学附属医院就诊并收治的20例喉鳞状细胞癌患者、15例喉声带息肉(vocal cord polyp, VCP)患者以及体检中心的健康体检者。所有LSCC、VCP患者入院后均经病理活检证实,并且无伴发其他慢性病、传染性疾病、口腔疾病等,如糖尿病、结核、或口腔溃疡等,LSCC患者均为初诊患者,手术前未接受放化疗等治疗。以年龄、性别、无其他疾病的VCP患者、健康体检者作为对照组。所有纳入的研究个体均签署了知情同意书。
同时收集整理LSCC患者的临床资料,包括性别、年龄、个人史(吸烟、饮酒史)、肿瘤生长部位(分为声门、声门下、声门上)、分化程度(低、中、高)、临床病理分期。肿瘤临床分期根据肿瘤的生长范围及扩散程度,按2002年国际抗癌联盟(UICC)喉癌TNM分类分期方案分为Ⅰ~Ⅳ期。
1.2 唾液收集唾液收集前,所有研究个体需禁食、禁饮2 h以上。收集时使用50 ml无菌无酶离心管,采用非刺激性的收集方法使唾液自然流出,收集量需达3 ml。唾液在30 min内收集完。为了去除细胞碎片及一些不溶成分,唾液收集完后,4℃、1 900 g离心10 min取上层上清液至1.5 ml EP管,再以4℃、16 000 g离心10 min后再弃沉淀取上清液,将所获上清液以每管250 μl分装后置-80℃保存。标本收集好后需2 h之内作出上述处理。LSCC患者手术前和手术后6月各采集一次唾液标本;VCP患者术前采集一次唾液标本;健康体检者采集一次唾液标本。
1.3 总RNA提取及cDNA合成提取试剂选择德国Qiagen公司的血清/血浆miRNA提取试剂(miRNeasy Serum/Plasma)试剂盒(规格型号:217184)。按照试剂盒说明书,取解冻后的唾液上清液200 μl,加入1 000 μl裂解液(QIAzol Lysis Reagent),剧烈震荡后室温下(15℃~25℃)放置5 min;加入3.5 μl Qiagen公司的血清/血浆纯化试剂盒外参(miRNeasy Serum/Plasma Spike-In Control)(cel-39)(规格型号:219610)作为外参,混匀,再加200 μl氯仿,剧烈摇动15 s,室温保存2~3 min;4℃、12 000 g离心15 min;吸上层无色水相,移入另一EP管中(约400 μl);加入1.5倍体积的无水乙醇,混匀;吸700 μl样品到抽提微量RNA(RNeasy MinElute)离心柱中;10 000 g,室温离心15 s,弃去收集管中的液体;分别用700 μl缓冲液RWT、缓冲液RPE、80%乙醇洗脱后,总RNA结合到膜上,苯酚和其他污染物被有效洗去;最后加入14 μl无酶水将离心柱上的RNA洗脱下来。使用分光光度计(NanoDrop ND-1000)检测评价所提取总RNA的质量,总RNA的OD260/OD280值在1.8~2.1之间为合格的RNA样品,说明样品RNA制备较纯,无蛋白质污染,样品可进行下一步操作。
取12 μl提取的合格的RNA以Qiagen公司的miRNA反转录(miScript Ⅱ RT试剂盒)(规格型号:218161)进行反转录,该试剂采用poly(A)聚合酶多腺苷酰化成熟miRNA,并利用反转录酶及oligo-dT引物扩增将其转变为cDNA。按照试剂盒说明操作如下:加入2 μl miRNA反转录混合物(miScript Reverse Transcriptase Mix)(一种经优化的poly(A)聚合酶和反转录酶混合物)、2 μl miRNA反转录核酸混合物(10×miScript Nucleics Mix)(包括dNTPs、rATP、oligo-dT引物等)、4 μl缓冲液(5×miScript HiSpec Buffer),然后进行反转录,反应体积为20 μl,反应条件为37℃ 60 min,95℃ 5 min。反转录中加样过程置于冰上操作。反转录反应完成后cDNA用无酶水以1:10稀释后置-20℃保存。
1.4 RT-PCR检测miRNA-21以Qiagen公司miRNA定量(miScript SYBR Green PCR)试剂盒(规格型号:218073),按照25 μl反应体系进行RT-PCR检测。检测体系包括:2.5 μl稀释后的cDNA、2.5 μl特异前向引物(miRNA-21的引物由上海生工生物工程有限公司合成F:5' -AGCGTAGCTTATCAGACTGATGTTGA-3’;外参引物包含在Qiagen公司的提取试剂血清/血浆miRNA提取试剂(miRNeasy Serum/Plasma)试剂盒中、2.5 μl 10×miScript Universal Primer(通用的反向引物)、12.5 μl miRNA定量混合物(2×QuantiTect SYBR Green PCR Master Mix)、5 μl无酶水。RT-PCR条件为:95℃ 15 min后,94℃ 15 s,55℃ 30 s,70℃ 30 s,40个循环。同时做溶解曲线是判断基因扩增的特异性。扩增采用ABI 7500仪器进行。所有样品做3复孔,对测量的Ct值取平均值,排除掉Ct值大于35的数据。根据待测标本的Ct值,以Cel-miRNA-39作为外参,用2-ΔΔCt法对目的基因进行相对定量[16]。最后,扩增结束后将扩增产物置于1%的琼脂糖凝胶中以110 V电压电泳30 min,GBOX-CHemi-XR5凝胶成像系统做电泳结果分析。
1.5 统计学方法采用SPSS20.0统计软件进行处理,三组之间的年龄差异使用单因素方差分析检验。采用Shapiro-Wilk检验来验证数据的正态性,发现所有数据都不满足正态分布。因此采用Mann Whitney U检验来比较不同组间miRNA-21表达水平的差异。miRNA的相对表达水平以(x±s)表示。miRNA-21在LSCC中的诊断效能采用ROC曲线来分析。图像绘制采用GraphPad Prism5.0进行图像绘制。以P < 0.05为差异有统计学意义。
2 结果 2.1 研究对象的基本特征纳入的研究者均为男性,汉族。LSCC患者组平均年龄为59.65±8.97,VCP患者组平均年龄为53.13±8.58,健康体检者组平均年龄为54.33±7.93。采用单因素方差分析发现,三组之间的年龄均值差异无统计学意义(F=2.944,P=0.062)。
2.2 RT-PCR法扩增结果所有样本均可检出外参Cel-miRNA-39及miRNA-21,两种产物熔解曲线均为单峰,Tm值分别为76.0℃与75.6℃,扩增曲线均呈“S”形。产物琼脂糖凝胶电泳条带位于约80~100 bp,见图 1。说明该研究中外参Cel-miRNA-39及miRNA-21扩增的特异性良好,无非特异性扩增,符合本次实验的要求。
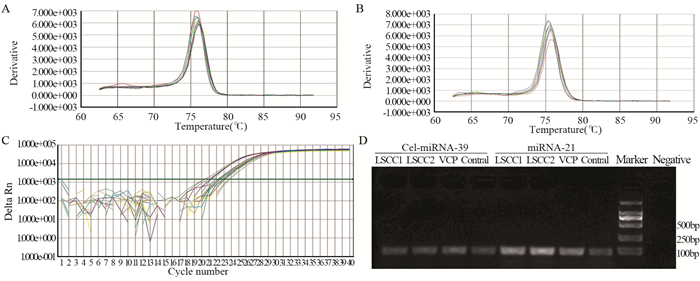
|
| A: the dissociation curve of Cel-miRNA-39; B: the dissociation curve of miRNA-21; C: amplification curve; D: electrophoresis results of RT-PCR products 图 1 RT-PCR法扩增结果 Figure 1 Amplification results of RT-PCR method |
采用RT-PCR定量检测20例LSCC患者和15例健康者唾液中的miRNA-21表达水平,发现与健康对照组(1.56±0.36)相比,LSCC患者的唾液中miRNA-21的表达水平(5.13±1.08)显著上调,差异有统计学意义(P=0.036)。15例VCP患者唾液中的miRNA-21的表达水平(2.42±0.84)相比于健康对照组也呈上调趋势,但差异无统计学意义(P=1.000),而比较LSCC患者和VCP患者唾液中miRNA-21的表达水平发现,VCP患者唾液中miRNA-21表达水平更低,但差异无统计学意义(P=0.086),见图 2。
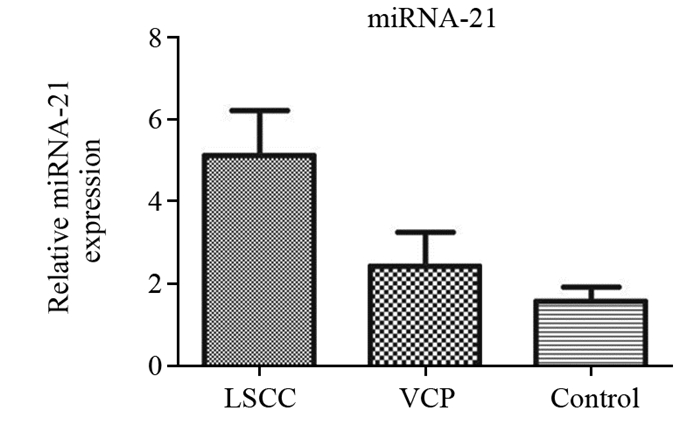
|
| 图 2 三组唾液中miRNA-21的相对表达水平 Figure 2 Relative expression of miRNA-21 in saliva of the three groups |
采用Mann Whitney U检验统计分析发现,肿瘤中分化者(7.13±2.69)较肿瘤高分化者(4.47±1.14)唾液中miRNA-21的相对表达量高,Ⅲ~Ⅳ期的LSCC患者唾液中miRNA-21的相对表达量(5.64±2.17)也高于Ⅰ~Ⅱ期的患者(5.04±1.23),但均未达到统计学意义(P=0.349, 0.616)。其他临床参数(包括患者年龄、吸烟、饮酒史、肿瘤的生长部位)与miRNA-21的表达水平均无明显相关性,见表 1。
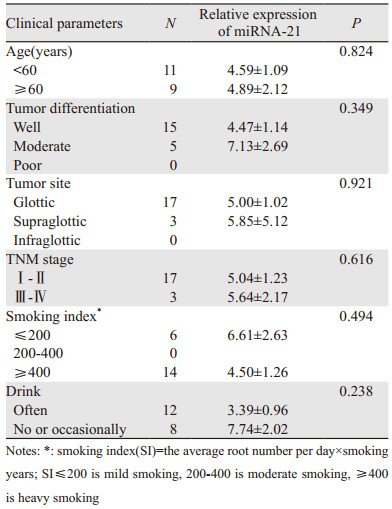
|
采用ROC曲线分析miRNA-21对LSCC的诊断价值发现,唾液中miRNA-21区分LSCC患者与健康者的曲线下面积为0.792(95%CI: 0.5353~0.885, P=0.036),截断值取1.223时,敏感度与特异性分别为75%与60%,见图 3。说明唾液中的miRNA-21检测可能可以作为LSCC诊断的生物标志物。
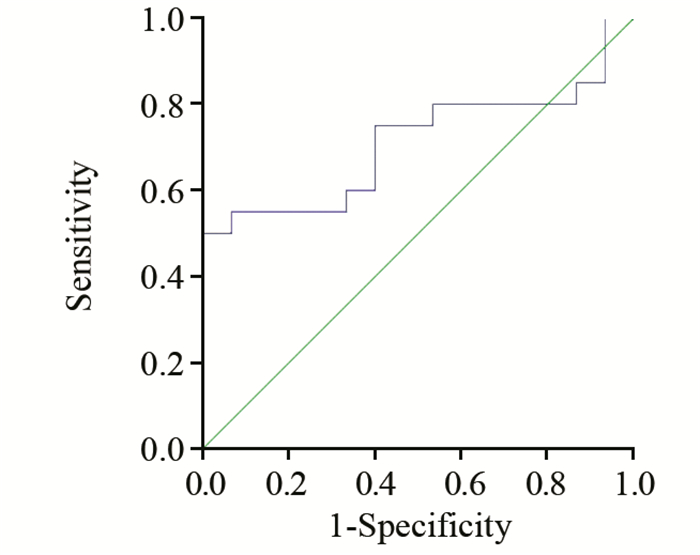
|
| 图 3 ROC曲线分析miRNA-21对LSCC的诊断价值 Figure 3 Prognostic value of miRNA-21 for LSCC analyzed by ROC curve |
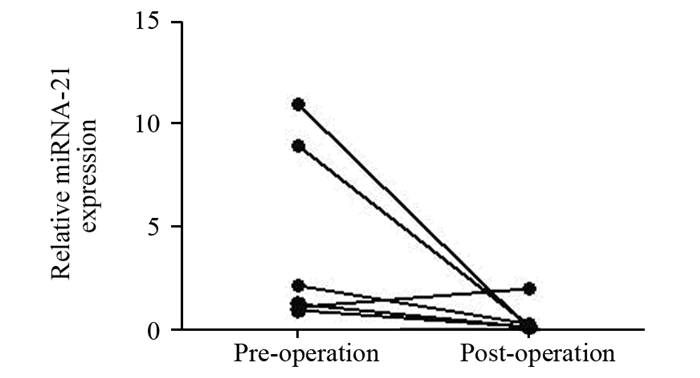
为了评价LSCC患者唾液中miRNA-21术前术后的动态变化,监测了6名LSCC患者手术前和手术后6月的miRNA-21变化,手术后miRNA-21相对表达水平(0.48±0.31)较手术前(5.35±2.45)明显下降,差异有统计学意义(P=0.041),见图 4。比较了手术后与健康对照组miRNA-21的表达量发现,手术切除肿瘤组织后,miRNA-21的水平显著下降,与健康对照组的miRNA-21表达量相比差异无统计学意义(P=0.800)。
|
| 图 4 LSCC患者手术前与手术后唾液中miRNA-21相对表达水平的关系 Figure 4 Relative expression of miRNA-21 in saliva of LSCC patients before and after operation |
目前已有很多研究发现miRNAs在肿瘤组织中的差异表达可用于肿瘤的诊断,但肿瘤组织的收集是侵入性、有创性的操作,且肿瘤组织的出现说明患者已出现了癌变,不适用于广泛人群的早期大规模普遍筛查。
LSCC作为头颈部肿瘤中最常见的恶性肿瘤之一,找到一个无创、方便且能够快速、早期诊断的方法显得尤为重要。唾液是一种非侵入性的、方便的、易获取的标本来源,唾液诊断的应用将开启无创诊断的大门,因此以唾液作为标本筛查疾病是非常吸引人的。近年来已有许多研究发现唾液中的一些分子物质可用于疾病的诊断,包括癌症、自身免疫性疾病和心血管疾病等[8-11]。如Zhang等[17]研究发现唾液中4种mRNA(KRAS、MBD3L2、ACRV1和DPM1)组合检测可以区分胰腺癌与非肿瘤患者(慢性胰腺炎和正常对照);Gursoy等[18]发现唾液中IL-1β与多个牙周致病菌的存在,可提示牙周炎的诊断;HIV也可通过检测口腔黏膜渗出液(OMT)中的HIV-1/2抗体来实现快速诊断,早在2002年,美国食品药品管理局就已批准了第一个应用OMT替代血液检测人类免疫缺陷病毒(HIV)的快速检测试剂[19-20]。随着高通量微阵列芯片检测技术和Real-time RT-PCR技术的广泛应用,唾液miRNA在各种肿瘤中的研究也逐渐增多。
目前,已有多项研究发现唾液miRNA可用于头颈部鳞癌中的诊断,如Salazar等[21]首先证明头颈部鳞状细胞癌患者唾液标本中miR-9、miR-191和miR-222的高表达,并且证实了从少量的唾液标本(200 μl)中就能够提取出足够的miRNA用于研究。Park等[12]检测了口腔癌患者的全唾液和经过离心后收集的唾液上清内的miRNA,发现miR-125a和miR-200a相比于健康对照组显著下调,说明其有望成为口腔癌的早期无创性诊断标志物。同时他们也发现唾液miRNA的表达非常稳定,不会轻易降解,其表达量可以长时间恒定表达。叶敏华等[22]研究发现检测miRNA-21在唾液中的表达诊断食管癌有望代替血浆检测。此外,还有研究发现[23],唾液中miRNA的表达量在同一机体内不会随时间的推移而改变,即唾液miRNA表达量恒定。这些研究都提示唾液miRNA的检测可能可以代替血液检测,开启疾病早期诊断的无创时代。
目前国内外有关miRNA在LSCC诊断及转移等方面的研究越来越多,但样本类型都局限于组织和血液(包括血清和血浆)中,其中miRNA-21已发现在喉癌组织及血液中都呈高表达[5, 24],目前认为miRNA主要通过与3’非编码区互补配对,并根据互补的差异性指导沉默复合体对同期的靶向mRNA进行切割或者翻译抑制,近来的研究发现,miRNA-21参与调节多种抑癌基因的表达[25],包括PTEN基因、TPM1基因等,因此其可能作为一种致癌因子促进LSCC的发生发展。在本研究中,我们发现LSCC患者的唾液中miRNA-21的表达水平相比于健康者显著上调,而与LSCC早期症状相似的VCP患者也呈上调趋势,但差异无统计学意义。VCP患者唾液中miRNA-21的表达水平与健康者虽然也有上调但差异无统计学意义。这说明检测唾液中miRNA-21的表达水平可用于区分LSCC与健康者,但其是否可用于区分LSCC与VCP还需更多的样本进一步验证。我们同时比较了6名LSCC患者手术前和手术后唾液中miRNA-21的动态变化,发现LSCC患者手术后唾液miRNA-21的水平显著下降,基本达到了健康组的水平。唾液中miRNA-21的这种变化趋势与之前肿瘤组织和血液研究中的miRNA-21变化一致,说明了其可能与血液相似,都是来源于肿瘤组织细胞的释放,这也与目前许多研究者认为的循环中核酸起源的假设一致[26],但其真正的来源与机制还需要进一步的研究探索。
本研究显示了唾液中的miRNA-21检测将来有望可作为LSCC诊断的生物标志物且诊断性能良好。同时我们分析了一些基本临床参数与miRNA-21表达水平的关系,虽然结果显示肿瘤中分化者较肿瘤高分化者唾液中miRNA-21的相对表达量高,Ⅲ~Ⅳ期的LSCC患者唾液中miRNA-21的相对表达量也高于Ⅰ~Ⅱ期的患者,但差异均无统计学意义(P=0.349, 0.616)。这可能与我们所纳入的研究样本较少、组间差异大有关,这其中的相关性尚需进一步研究。
综上所述,本次研究首次检测了LSCC患者唾液中miRNA-21的表达水平并发现唾液miRNA-21将来有望可能作为LSCC早期诊断的标志物。这对miRNA走向临床应用具有重大意义。本次研究由于是初步的探讨性研究,样本数量较少,需进一步扩大样本,进行更深入的研究。
| [1] | Landry D, Glastonbury CM. Squamous Cell Carcinoma of the Upper Aerodigestive Tract: A Review[J]. Radiol Clin North Am, 2015, 53(1): 81–97. DOI:10.1016/j.rcl.2014.09.013 |
| [2] | Macneil SD, Liu K, Shariff SZ, et al. Secular trends in the survival of patients with laryngeal carcinoma, 1995–2007[J]. Curr Oncol, 2015, 22(2): e85–99. DOI:10.3747/co.22.2361 |
| [3] | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281–97. DOI:10.1016/S0092-8674(04)00045-5 |
| [4] | Tong AW, Nemunaitis J. Modulation of miRNA activity in human cancer: a new paradigm for cancer gene therapy?[J]. Cancer Gene Ther, 2008, 15(6): 341–55. DOI:10.1038/cgt.2008.8 |
| [5] | Cao P, Liang ZM, Jin Z, et al. Comprehensive expression profiling of microRNAs in laryngeal squamous cell carcinoma[J]. Head Neck, 2013, 35(5): 720–8. DOI:10.1002/hed.v35.5 |
| [6] | Wang Y, Chen M, Tao Z, et al. Identification of predictive biomarkers for early diagnosis of larynx carcinoma based on microRNA expression data[J]. Cancer Genet, 2013, 206(9-10): 340–6. DOI:10.1016/j.cancergen.2013.09.005 |
| [7] | Ayaz L, Görür A, Yaroǧlu HY, et al. Differential expression of microRNAs in plasma of patients with laryngeal squamous cell carcinoma: potential early-detection markers for laryngeal squamous cell carcinoma[J]. J Cancer Res Clin Oncol, 2013, 139(9): 1499–506. DOI:10.1007/s00432-013-1469-2 |
| [8] | Wong DT. Salivary diagnostics[J]. Oper Dent, 2012, 37(6): 562–70. DOI:10.2341/12-143-BL |
| [9] | Denny P, Hagen FK, Hardt M, et al. The Proteomes of Human Parotid an Submandib- ular/Sublingual Gland Salivas Collected as the Ductal Secretions[J]. J Proteome Res, 2008, 7(5): 1994–2006. DOI:10.1021/pr700764j |
| [10] | Li Y, Zhou X, St John MA, et al. RNA profiling of cell-free saliva using microarray technology[J]. J Dent Res, 2004, 83(3): 199–203. DOI:10.1177/154405910408300303 |
| [11] | Wei J, Xie G, Zhou Z, et al. Salivary metabolite signatures of oral cancer and leukoplakia[J]. Int J Cancer, 2011, 129(9): 2207–17. DOI:10.1002/ijc.v129.9 |
| [12] | Park NJ, Zhou H, Elashoff D, et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection[J]. Clin Cancer Res, 2009, 15(17): 5473–7. DOI:10.1158/1078-0432.CCR-09-0736 |
| [13] | Cai EH, Gao YX, Wei ZZ, et al. Serum miR-21 expression in human esophageal squamous cell carcinomas[J]. Asian Pac J Cancer Prev, 2012, 13(4): 1563–7. DOI:10.7314/APJCP.2012.13.4.1563 |
| [14] | Han JG, Jiang YD, Zhang CH, et al. A novel panel of serum miR-21/miR-155/miR-365 as a potential diagnostic biomarker for breast cancer[J]. An Sur Treat Res, 2017, 92(2): 55–66. DOI:10.4174/astr.2017.92.2.55 |
| [15] | Correa-Gallego C, Maddalo D, Doussot A, et al. Circulating plasma levels of microrna-21 and microrna-221 are potential diagnostic markers for primary intrahepatic cholangiocarcinoma[J]. PLoS One, 2016, 11(9): e0163699. DOI:10.1371/journal.pone.0163699 |
| [16] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402–8. DOI:10.1006/meth.2001.1262 |
| [17] | Zhang L, Farrell JJ, Zhou H, et al. Salivary Transcriptomic biomarkers for detection of resectable pancreatic cancer[J]. Gastroenterology, 2010, 138(3): 949–57. DOI:10.1053/j.gastro.2009.11.010 |
| [18] | Gursoy UK, Könönen E, Uitto VJ, et al. Salivary interleukin-1beta concentration and the presence of multiple pathogens in periodontitis[J]. J Clin Periodontol, 2009, 36(11): 922–7. DOI:10.1111/cpe.2009.36.issue-11 |
| [19] | Jyoti B, Devi P. Detection of human immunodeficiency virus using oral mucosal transudate by rapid test[J]. Indian J Sex Transm Dis, 2013, 34(2): 95–101. DOI:10.4103/0253-7184.120539 |
| [20] | Centers for Disease Control and Prevention (CDC). Approval of a new rapid test for HIV antibody[J]. MMWR Morb Mortal Wkly Rep, 2002, 51(46): 1051–2. |
| [21] | Salazar C, Nagadia R, Pandit P, et al. A novel saliva-based microRNA biomarker panel to detect head and neck cancers[J]. Cell Oncol(Dordr), 2014, 37(5): 331–8. DOI:10.1007/s13402-014-0188-2 |
| [22] | 叶敏华, 叶鹏辉, 张伟珠, 等. 唾液与血浆微小RNA-21对早期食管癌的诊断价值[J]. 南方医科大学学报, 2014, 34(6): 885–9. [ Ye MH, Ye PH, Zhang WZ, et al. Diagnostic values of salivary versus and plasma microRNA-21 for early esophageal cancer[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(6): 885–9. ] |
| [23] | Patel RS, Jakymiw A, Yao B, et al. High resolution of microRNA signatures in human whole saliva[J]. Arch Oral Biol, 2011, 56(12): 1506–13. DOI:10.1016/j.archoralbio.2011.05.015 |
| [24] | Wang J, Zhou Y, Lu J, et al. Combined detection of serum exosomal miR-21 and HOTAIR as diagnostic and prognostic biomarkers for laryngeal squamous cell carcinoma[J]. Medi Oncol, 2014, 31(9): 148. DOI:10.1007/s12032-014-0148-8 |
| [25] | Huang Y, Yang YB, Zhang XH, et al. MicroRNA-21 gene and cancer[J]. Medi Oncol, 2013, 30(1): 376. DOI:10.1007/s12032-012-0376-8 |
| [26] | Schwarzenbach H, Hoon DS, Pantel K. Cell-free nucleic acids as biomarkers in cancer patients[J]. Nat Rev Cancer, 2011, 11(6): 426–37. DOI:10.1038/nrc3066 |
 2018, Vol. 45
2018, Vol. 45


