文章信息
- 阿帕替尼逆转P-gp转运体介导的乳腺癌化疗多药耐药性的作用及其机制
- Reversal Effect of Apatinib on P-gp-mediated Multidrug Resistance of Human Breast Cancer and Its Mechanisms
- 肿瘤防治研究, 2018, 45(4): 210-214
- Cancer Research on Prevention and Treatment, 2018, 45(4): 210-214
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1112
- 收稿日期: 2017-09-04
- 修回日期: 2017-10-30
乳腺癌是威胁女性生命健康最常见的恶性肿瘤之一,其发病率居女性易患恶性肿瘤首位,目前每年全世界约有140万乳腺癌新发患者[1-2]。我国乳腺癌患者数量以每年2%~3%的增长速率递增,同时发病年龄日趋年轻化,乳腺癌已成为当前社会的重大公共卫生问题[2]。化疗在乳腺癌综合治疗中占有极其重要的地位,而多药耐药性的产生是影响乳腺癌患者化疗疗效及生存的主要原因之一。
多药耐药性产生最根本的原因之一是由于细胞膜表面P-gp转运体的过表达[3]。作为一种ATP依赖性药物外排泵,位于细胞膜上的P-gp可通过消耗ATP,将其底物性化疗药物外排出细胞外,导致其在肿瘤细胞内的浓度降低,进而导致耐药性的产生。常见的P-gp底物药物包括紫杉醇、阿霉素、柔红霉素、长春碱类、秋水仙素等临床使用广泛的抗肿瘤化疗药[3]。因此,合成或筛选P-gp的抑制剂以逆转其介导的多药耐药性是抗肿瘤研究的热点之一[4-5]。近年来,抗肿瘤药物的开发已从传统的细胞毒性化疗药物过渡到分子靶向药物。目前,酪氨酸激酶是仅次于G蛋白偶联受体的第二大药物靶点。已有研究报道多种小分子靶向的酪氨酸激酶抑制剂类药物(tyrosine Kinase inhibitors, TKIs)可通过调控P-gp转运体进而增强化疗药物的疗效[6-7]。新近研究报道小分子的TKIs类药物在抑制P-gp的同时,也可作为P-gp转运体的底物进而被外排,即P-gp介导的药物外排同样是TKIs类药物耐药性的产生的原因之一[8]。因此,对TKIs类药物调控P-gp转运体的具体机制进一步研究具有重要的临床意义。
阿帕替尼是一种口服的小分子靶向的酪氨酸激酶抑制剂,目前已获批用于晚期胃癌的临床治疗,目前有关阿帕替尼对多药耐药性调控影响的研究报道较少。本实验通过研究阿帕替尼对乳腺癌化疗多药耐药性的影响及其潜在的分子机制,探讨阿帕替尼作为乳腺癌化疗耐药性逆转剂的潜能,为阿帕替尼应用于耐药性乳腺癌的临床治疗提供理论依据和实验基础。
1 材料与方法 1.1 细胞株人乳腺癌MCF-7细胞(货号:KG031)及其经阿霉素诱导的多药耐药细胞株MCF-7/ADR(货号:KG0311)均购自江苏凯基生物技术股份有限公司,培养于含10%胎牛血清的DMEM培养液中。常规培养时细胞置于37℃、5%CO2的培养箱中。
1.2 主要试剂阿帕替尼(Apatinib, CAS: 1218779-75-9)购自于大连美仑生物技术有限公司;DMEM培养液、胎牛血清、青-链霉素双抗溶液及胰蛋白酶溶液购自于美国Gibco公司;Pgp-GloTM Assay Systems试剂盒购自于美国Promega公司;全蛋白提取试剂盒购自于上海碧云天生物技术有限公司;蛋白浓度检测试剂盒购自于江苏凯基生物技术股份有限公司;一抗GAPDH、P-gp、AKT、p-AKT及二抗山羊抗兔IgG均购自于美国Cell Signaling Technology公司;PVDF膜及ECL发光检测试剂盒购自于美国Millipore公司;其余试剂为国产分析纯。
1.3 MTT法检测阿帕替尼对乳腺癌MCF-7及MCF-7/ADR细胞的毒性收集对数生长期的MCF-7及MCF-7/ADR细胞接种于96孔板,浓度为5×103个/孔,待细胞贴壁后,每孔分别加入不同浓度的阿帕替尼药液。继续培养48 h后,每孔加入20 μl的MTT试剂(5 mg/ml)继续置于培养箱孵育4 h,随后吸弃药液,加入200 μl的DMSO溶液,于微孔板振荡器上轻轻振荡5 min后,于多功能酶标仪490 nm波长处测量各孔吸光度值(OD值),并计算各组细胞的增殖抑制率:增殖抑制率=1-(OD实验组/OD对照组)×100%。每组设6个复孔,实验重复3次。
1.4 阿帕替尼对乳腺癌MCF-7及MCF-7/ADR细胞化疗敏感度的影响低毒浓度的阿帕替尼与紫杉醇及阿霉素联用,采用Bliss法根据各组增殖抑制率结果计算联用阿帕替尼前后紫杉醇及阿霉素对MCF-7及MCF-7/ADR细胞半数抑制浓度(IC50)。
1.5 药物蓄积实验考察阿帕替尼对罗丹明123蓄积的影响实验步骤:消化收集细胞至离心管,数量为1×106个/管,离心弃上清液,PBS洗涤后,加入不同浓度的阿帕替尼及5 μg/ml的罗丹明123的混合药液,于培养箱中继续孵育2 h后离心,冷的PBS洗涤3次后,将细胞重悬于0.5 ml冷的PBS中,于激发波长488 nm处检测各组的平均荧光强度(mean fluorescence intensity, MFI)。每组设3个复孔,实验重复3次。
1.6 阿帕替尼对P-gp转运体ATPase活性的影响采用Promega公司的Pgp-GloTM Assay Systems试剂盒考察阿帕替尼对P-gp转运体ATPase活性的影响,方法参照说明书。通过比较各组的化学发光强度值分析不同浓度的阿帕替尼对于P-gp转运体的ATPase活性的影响。
1.7 Western blot法检测阿帕替尼对耐药相关蛋白表达的影响MCF-7/ADR细胞经不同浓度的阿帕替尼处理48 h后,按全蛋白提取试剂盒说明书步骤提取总蛋白,测定上清液的蛋白浓度,调整蛋白浓度后,加入5×Loading buffer金属浴95℃蛋白变性5 min获得总蛋白样品。随后凝胶电泳分离总蛋白,每泳道上样30 μg,冰浴条件下将蛋白转膜至活化的PVDF膜上。5%的脱脂奶粉封闭1 h后,置于一抗中4℃孵育过夜(一抗的稀释倍数均为1:1 000)。过夜孵育后TBST溶液洗膜5 min×3次后,用1:5 000稀释的二抗室温条件下继续孵育1 h。TBST洗膜5 min×3次后,采用ECL化学发光试剂盒显色,拍照。
1.8 统计学方法数据以均数±标准差(x±s)表示,采用SPSS19.0分析数据。组间比较采用One-Way ANOVA,P < 0.05为差异有统计学意义。
2 结果 2.1 阿帕替尼联用浓度的选择体外逆转耐药性实验中,为了降低耐药性逆转剂固有的细胞不良反应,通常选用对肿瘤细胞增殖抑制率不超过10%时的浓度作为耐药性逆转剂在体外实验中的联用浓度。(0.1~16)μmol/L的阿帕替尼可浓度依赖性地抑制人乳腺癌MCF-7及MCF-7/ADR细胞的体外增殖,见图 1。0.5 μmol/L的阿帕替尼作用于MCF-7细胞48 h的增殖抑制率为8.95%,2.0 μmol/L的阿帕替尼作用于MCF-7/ADR细胞48 h的增殖抑制率为8.26%,均小于10%。故阿帕替尼与化疗药物联用于MCF-7及MCF-7/ADR细胞的三个浓度分别选为0.1、0.3、0.5 μmol/L及0.5、1.0、2.0 μmol/L。
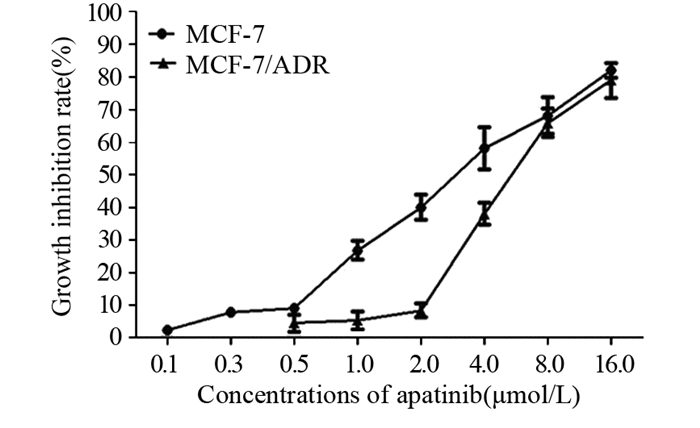
|
| 图 1 不同浓度阿帕替尼作用人乳腺癌MCF-7及MCF-7/ADR细胞48 h后的细胞增殖抑制率 Figure 1 Growth inhibition rates of human breast cancer cell lines MCF-7 and MCF-7/ADR treated with different concentrations of apatinib for 48 h |
人乳腺癌MCF-7/ADR细胞相较于MCF-7细胞对化疗药物紫杉醇及阿霉素高度耐药。当0.5、1.0及2.0 μmol/L的阿帕替尼与化疗药物阿霉素联用时,阿霉素对MCF-7/ADR细胞的半数抑制浓度(IC50)分别为(7.31±0.46)、(5.53±0.41)及(2.33±0.21)μmol/L,较未联用阿帕替尼组的(20.68±1.72)μmol/L分别下降了2.83倍、3.74倍及8.88倍,说明低浓度的阿帕替尼可浓度依赖性地逆转人乳腺癌耐药细胞株MCF-7/ADR对紫杉醇及阿霉素的多药耐药性,而不影响化疗敏感株MCF-7对紫杉醇及阿霉素的敏感度,见表 1。
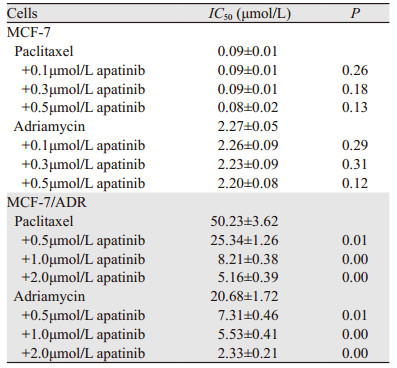
|
药物蓄积实验结果表明耐药乳腺癌细胞株MCF-7/ADR内罗丹明123的蓄积量远低于MCF-7细胞。与P-gp转运体外排功能性抑制剂维拉帕米作用相似,阿帕替尼可浓度依赖性地增加P-gp转运体底物性荧光指示剂罗丹明123在耐药乳腺癌细胞MCF-7/ADR内的蓄积(P < 0.05),而对化疗敏感株MCF-7细胞内的罗丹明123的蓄积没有影响,见图 2。上述结果表明阿帕替尼可增加P-gp底物药物在耐药乳腺癌细胞株MCF-7/ADR内的蓄积。
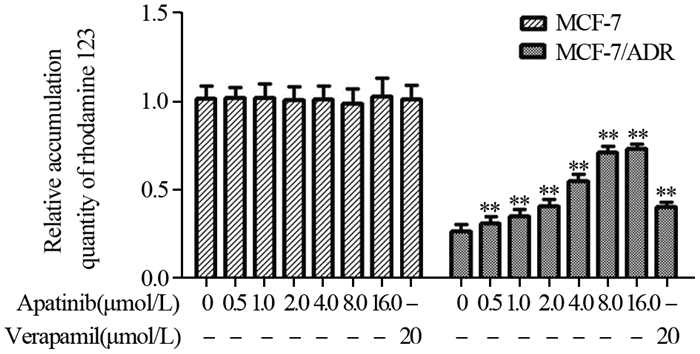
|
| **: P < 0.05, compared with 0 μmol/L apatinib group 图 2 罗丹明123蓄积实验检测阿帕替尼对罗丹明123在MCF-7及MCF-1/ADR细胞内蓄积的影响 Figure 2 Effects of apatinib on accumulation of rhodamine 123 in MCF-7 and MCF-7/ADR cells investigated by rhodamine 123 accumulation assay |
与P-gp转运体的底物竞争性抑制剂维拉帕米的作用效果相似,0.5~16.0 μmol/L的阿帕替尼可浓度依赖性地增加P-gp转运体的ATPase活性,见图 3。该结果表明阿帕替尼可能是P-gp转运体的底物之一。
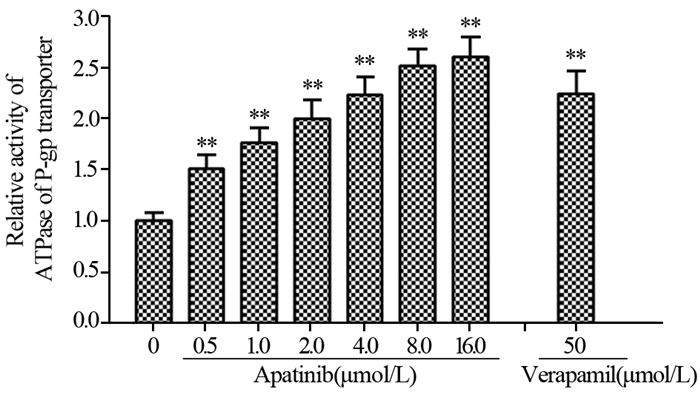
|
| **: P < 0.05, compared with 0 μmol/L apatinib group 图 3 Pgp-GloTM Assay Systems试剂盒检测阿帕替尼对P-gp转运体ATPase活性的影响 Figure 3 Effect of apatinib on ATPase activity of P-gp investigated by Pgp-GloTM Assay Systems |
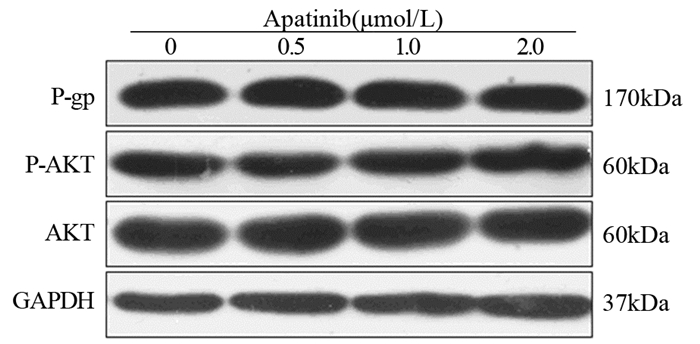
通过Western blot实验进一步研究了阿帕替尼对多药耐药相关蛋白P-gp、AKT及p-AKT的影响,结果显示,阿帕替尼对耐药乳腺癌细胞株MCF-7/ADR内P-gp的表达没有影响;此外,阿帕替尼对AKT的磷酸化水平也没有影响,见图 4。
|
| 图 4 Westerm blot实验检测阿帕替尼对MCF-7/ADR细胞中耐药相关蛋白表达的影响 Figure 4 Effects of apatinib on drug-resistance-related protein expression of in MCF-7/ADR cells investigated by Western blot |
乳腺癌化疗多药耐药性产生最根本原因之一是由于P-gp的过表达[3]。筛选P-gp的抑制剂是逆转P-gp介导的多药耐药性的解决策略之一。P-gp抑制剂通过抑制P-gp转运体的外排活性或下调P-gp的蛋白表达水平,降低化疗药物的外排,增加其在肿瘤细胞内的蓄积,进而逆转多药耐药性[4-5]。P-gp介导的多药耐药性逆转剂开发失败常见的原因包括药物选择性差、靶向性弱、起效剂量过大进而导致不良反应大,体内药动学过程不明确等。因此,从靶向性强、使用剂量小、体内代谢过程明确的临床药物中寻找可显著抑制P-gp活性的药物,作为P-gp介导的多药耐药性逆转剂进行开发,可能是一种较好的解决策略。近年来,一系列的研究表明基于TKIs类药物与P-gp间的相互作用,有望通过联用TKIs类药物及P-gp底物性化疗药物以逆转多药耐药性。如有研究报道伊马替尼、尼罗替尼[9]、达沙替尼[10]等可逆转P-gp介导的多药耐药性。靶向血管内皮生长因子2(VEGFR-2)起效的酪氨酸激酶抑制剂阿帕替尼已获FDA批准用于晚期胃癌的临床治疗,目前关于阿帕替尼对P-gp介导的多药耐药性的影响的报道十分有限。
本研究中我们首先基于MTT法考察了阿帕替尼对乳腺癌MCF-7及MCF-7/ADR细胞的毒性,依据增殖抑制率曲线选择了增殖抑制率低于10%的阿帕替尼的浓度作为其与化疗药物联用时的浓度。研究发现联用阿帕替尼后,紫杉醇及阿霉素对耐药乳腺癌细胞株MCF-7/ADR的IC50显著降低(P < 0.05),即阿帕替尼浓度依赖性的逆转了MCF-7/ADR的多药耐药性。随后本实验对阿帕替尼逆转多药耐药性的机制进行了研究。鉴于P-gp介导的多药耐药性的产生是乳腺癌患者化疗失败的重要原因之一,抑制P-gp转运体的外排活性,将有利于提高P-gp底物性化疗药物在P-gp转运体高表达的肿瘤细胞内的蓄积,进而增加化疗药物对肿瘤细胞的杀伤作用[10]。本研究通过P-gp底物性荧光指示剂罗丹明123的蓄积实验证实了阿帕替尼可增加P-gp底物性药物在乳腺癌MCF-7/ADR细胞内的蓄积,通过P-gp的ATPase活性实验证实了阿帕替尼可激活P-gp的ATPase活性。上述结果提示阿帕替尼可能是一种P-gp的底物竞争性抑制剂,可能通过与紫杉醇及阿霉素竞争性地结合P-gp的底物结合位点进而减少P-gp介导的紫杉醇及阿霉素的外排,增强其抗肿瘤疗效。
逆转P-gp介导的多药耐药性既可能是通过抑制P-gp的外排功能,也可能是通过下调P-gp在肿瘤细胞膜表面的表达水平来实现的。本研究随后考察了无毒浓度的阿帕替尼对耐药乳腺癌MCF-7/ADR细胞P-gp转运体表达的影响,结果表明阿帕替尼不影响MCF-7/ADR细胞内P-gp的表达。此外有研究报道抑制PI3K/AKT通路的激活可一定程度逆转多药耐药性的产生[11]。本研究发现所采用的低浓度的阿帕替尼对AKT的磷酸化没有影响,表明阿帕替尼逆转P-gp介导的多药耐药性的产生与抑制P-gp的表达及AKT的磷酸化不相关。
综上所述,体外实验证明阿帕替尼可逆转耐药乳腺癌细胞对紫杉醇及阿霉素的多药耐药性,是一种有潜力的乳腺癌化疗多药耐药逆转剂。阿帕替尼竞争性抑制P-gp转运体的外排功能,进而增加化疗药物紫杉醇及阿霉素在乳腺癌耐药细胞内的蓄积,可能是其发挥逆转多药耐药作用的机制之一。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [2] | DeSantis C, Ma J, Bryan L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 52–62. DOI:10.3322/caac.21203 |
| [3] | Chen KG, Sikic BI. Molecular pathways: regulation and therapeutic implications of multidrug resistance[J]. Clin Cancer Res, 2012, 18(7): 1863–9. DOI:10.1158/1078-0432.CCR-11-1590 |
| [4] | Gupta P, Garg T, Tanmay M, et al. Polymeric Drug-Delivery Systems: Role in P-gp Efflux System Inhibition[J]. Crit Rev Ther Drug Carrier Syst, 2015, 32(3): 247–75. DOI:10.1615/CritRevTherDrugCarrierSyst.v32.i3 |
| [5] | Zhu Y, Liu C, Nadiminty N, et al. Inhibition of ABCB1 expression overcomes acquired docetaxel resistance in prostate cancer[J]. Mol Cancer Ther, 2013, 12(9): 1829–36. DOI:10.1158/1535-7163.MCT-13-0208 |
| [6] | Zhang XY, Zhang YK, Wang YJ, et al. Osimertinib(AZD9291), a Mutant-Selective EGFR Inhibitor, Reverses ABCB1-Mediated Drug Resistance in Cancer Cells[J]. Molecules, 2016, 21(9): pii: E1236. DOI:10.3390/molecules21091236 |
| [7] | Hsiao SH, Lu YJ, Li YQ, et al. Osimertinib (AZD9291) Attenuates the Function of Multidrug Resistance-Linked ATP-Binding Cassette Transporter ABCB1 in Vitro[J]. Mol Pharm, 2016, 13(6): 2117–25. DOI:10.1021/acs.molpharmaceut.6b00249 |
| [8] | D'Cunha R, Bae S, Murry DJ, et al. TKI combination therapy: strategy to enhance dasatinib uptake by inhibiting Pgp-and BCRP-mediated efflux[J]. Biopharm Drug Dispos, 2016, 37(7): 397–408. DOI:10.1002/bdd.v37.7 |
| [9] | Mlejnek P, Kosztyu P, Dolezel P, et al. Reversal of ABCB1 mediated efflux by imatinib and nilotinib in cells expressing various transporter levels[J]. Chem Biol Interact, 2017, 273: 171–9. DOI:10.1016/j.cbi.2017.06.012 |
| [10] | Chen T, Wang CY, Liu Q, et al. Dasatinib reverses the multidrug resistance of breast cancer MCF-7 cells to doxorubicin by downregulating P-gp expression via inhibiting the activation of ERK signaling pathway[J]. Cancer Biol Ther, 2015, 16(1): 106–14. DOI:10.4161/15384047.2014.987062 |
| [11] | Choi BH, Kim CG, Lim Y, et al. Curcumin down-regulates the multidrug-resistance mdr1b gene by inhibiting the PI3K/Akt/NF kappa B pathway[J]. Cancer Lett, 2008, 259(1): 111–8. DOI:10.1016/j.canlet.2007.10.003 |
 2018, Vol. 45
2018, Vol. 45


