文章信息
- 大剂量粒系集落刺激因子使老年急性髓系白血病患者受益
- High-doses Granulocyte Colony-stimulating Factor (G-CSF) Benefit Elderly Patients with Acute Myeloid Leukemia
- 肿瘤防治研究, 2018, 45(5): 329-332
- Cancer Research on Prevention and Treatment, 2018, 45(5): 329-332
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.1096
- 收稿日期: 2017-09-01
- 修回日期: 2018-01-17
2. 300020天津,中国医学科学院血液病医院白血病诊疗中心
2. Division of Leukemia, Institute of Hematology and Blood Disease Hospital, Chinese Academy of Medical Sciences and Peking Union of Medical College, Tianjin 300020, China
急性髓系白血病(acute myeloid leukemia, AML)为恶性肿瘤性疾病之一,随着年龄的增长发病率也逐渐增高,中位发病年龄为67岁[1],54%的患者年龄≥65岁,而其中1/3患者年龄≥75岁[2]。老年AML的治疗一直是一个难题,老年患者治疗方案的选择除了与AML的危险分层有关外,还与对化疗的耐受性有重要关系。多项前瞻性临床试验报道,老年AML早期死亡率达16%~71%,而3年总体生存率仅有3.3%~39.5%,其中化疗耐受性差而引发的感染、重要脏器出血导致的化疗中断、住院时间延长等是重要原因[3]。目前美国国家癌症综合网(National Comprehensive Cancer Network, NCCN)和欧洲白血病网(European Leukemia Net, ELN)推荐的一线诱导和巩固治疗仍以化疗为主,支持治疗在老年AML治疗中起到了重要的地位。对于年龄 > 65岁接受化疗的患者,NCCN Myeloid Factors指南推荐在诱导和巩固化疗期间给予粒系集落刺激因子(granulocyte colony-stimulating factor, G-CSF)(5 μg/kg)缩短中性粒细胞缺乏期,从而减少感染,特别是真菌感染的发生率,减少早期死亡率,延长患者的生存期。我们回顾性分析了化疗期间采用标准剂量的G-CSF(5 μg/kg)与大剂量G-CSF(> 5 μg/kg)作为支持治疗的老年AML患者(年龄≥60岁)和55~59岁AML患者,观察其在化疗期间红细胞(RBC)、血小板(PLT)的输注情况、中性粒细胞缺乏时间、发热情况、广谱抗生素以及抗真菌药物的使用情况,寻找更适合老年AML患者的治疗策略。
1 资料与方法 1.1 资料收集2014年1月1日—2016年12月31日中国医学科学院血液病医院收治的82例初治年龄 > 55岁AML患者完成273个化疗周期的临床资料。所有患者均进行了形态学、细胞化学、免疫表型、细胞及分子遗传学检查,符合2016年WHO分类的AML诊断(AML伴有t(15;17)除外)。随访截至化疗开始的第6周。
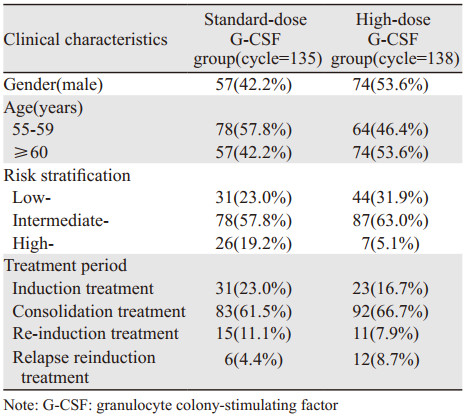
1.2 一般临床特征82例患者中男性41例、女性41例,男:女=1:1。中位年龄为60(55~80)岁,55~59岁的患者中位年龄为58(55~59)岁,≥60岁的患者中位年龄为62(60~80)岁。标准剂量组G-CSF的中位剂量4.8(4.1~5.0)μg/kg;大剂量组G-CSF的中位剂量6.2(5.1~8.9)μg/kg,见表 1,两组患者的临床特征相似,差异无统计学意义。
|
82例患者均采用标准剂量Ara-C(100 mg/(m2.d))为基础的诱导、巩固化疗,包括DA、MA、HA、AA;D—柔红霉素(45 mg/(m2.d)×3d),M—米托蒽醌(8 mg/(m2.d)×3d),H—高三尖杉酯碱(2.5 mg/(m2.d)×7d),A—阿克拉霉素(20 mg/d×7天)。分别分析化疗结束后骨髓抑制期期间(中性粒细胞≤1.0×109/L)以标准剂量G-CSF(5 μg/kg,1次/日,皮下注射)与大剂量G-CSF(> 5 μg/kg,1次/日,皮下注射)作为支持治疗直至中性粒细胞恢复至≥1.0×109/L的AML患者治疗期间情况,观察其在化疗期间的输注红细胞、血小板情况、中性粒细胞缺乏时间、发热情况、广谱抗生素以及抗真菌药物的使用情况。
1.4 评估标准中性粒细胞减少症定义为中性粒细胞绝对值< 1.0×109/L,粒缺伴发热定义为体温≥38.3℃或者体温≥38.0℃超过1 h。侵袭性真菌感染参照2012年ELN[4]的诊断标准及疗效判定标准;粒缺伴发热参照2010年美国感染病学会(Infectious Diseases Society of America, IDSA)指南的抗感染经验性治疗及疗效判定标准[5]。停抗感染治疗的标准为:a:中性粒细胞绝对值(absolute neutrophil count, ANC)≥0.5×109/L,体温正常持续72 h以上,无感染症状好体征;b:ANC≤0.5×109/L,体温正常,无感染的临床症状和体征持续5天。
1.5 统计学方法统计软件采用SPSS20.0,描述性统计分析采用的中位数、均数、百分比、频数进行统计分析。采用Pearson’s χ2和Fisher’s精确检验,P < 0.05为差异有统计学意义。
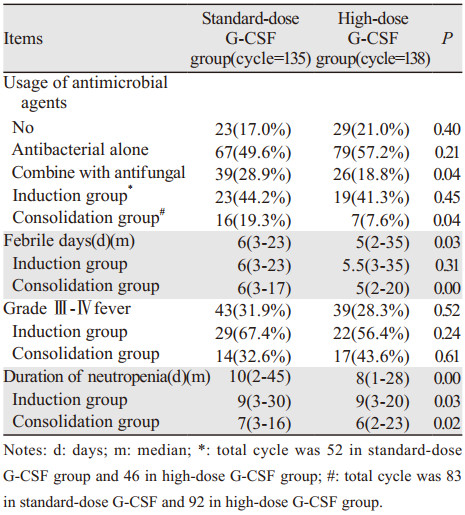
2 结果 2.1 治疗期间感染情况273个化疗周期期间合并感染223次(81.7%),其中因感染中断治疗患者11例(13.4%);2例(2.4%)患者在诱导治疗期间死亡,均为标准剂量组。治疗期间共15次合并败血症,其中标准剂量组10例(7.4%),大剂量组5例(3.6%)。在亚组分析中,将再次诱导及复发后再次诱导的患者均列为诱导组进行分析,见表 2。大剂量组可明显缩短发热的持续天数及减少抗真菌药物的使用,特别是在巩固治疗期间,两组之间差异有统计学意义(P=0.03),但在诱导治疗期间相似。同时大剂量组在诱导、巩固治疗期间可以明显缩短粒缺时间,两者之间差异有统计学意义(P=0.00)。
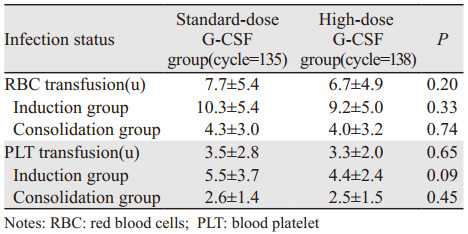
273个化疗周期期间,其中162个化疗周期输注了红细胞,269个化疗周期输注了血小板。平均每个化疗周期输注红细胞7.2 u,血小板3.5 u,见表 3。大剂量组可减少PLT输注总量趋势,但差异无统计学意义。在亚组分析中可见,诱导、巩固治疗期间,大剂量组有减少RBC、PLT输注的倾向,在诱导期间尤其显著,但和标准剂量组相比差异无统计学意义。
|
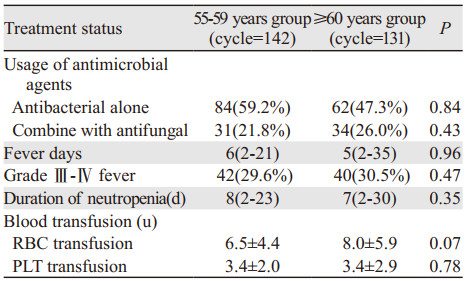
273个化疗周期期间,55~59岁患者完成142(52.0%)个化疗周期,≥60岁患者完成了131(48.0%)个化疗周期,两组病例在治疗期间抗菌药物的使用情况,发热持续天数、粒缺时间、输血情况等方面均相似,两者之间差异均无统计学意义,见表 4。
老年AML的治疗在临床上一直是比较棘手的问题,虽然随着新药(地西他滨、阿扎胞苷等)不断出现,低强度的治疗也可以使部分老年患者受益,减少了治疗相关死亡率,但目前的临床试验结果显示老年患者还是在高强度的化疗中受益更大[6],大量的流行病学数据已显示,对化疗耐受好的患者可以获得更长的生存期。因此如何降低老年患者的治疗相关死亡率,使更多的老年患者在高强度的化疗中受益一直都是临床上急需解决的问题。
Tawfik等[7]报道了老年AML化疗期间主要的并发症,其中50%患者合并感染、21.4%合并出血、14.3%合并心肌损伤、14.3%合并非感染相关的肾功能损伤。感染及治疗期间因PLT减低而发生的出血倾向是主要的治疗期间并发症,对于治疗期间合并感染的老年患者中,25%~40%的患者进展为真菌感染[8],而这两个主要并发症都与粒缺期的持续时间密切相关。目前化疗期间的支持治疗主要是预防感染、对症输注RBC、PLT、G-CSF的应用,而其中G-CSF的应用起到重要作用。G-CSF的合理应用缩短粒缺期的持续时间,进一步减少因中性粒细胞缺乏而导致的细菌、真菌感染及减少成分血的输注。NCCN Myeloid Factors推荐的预防性给予G-CSF(5 μg/kg)支持治疗的指征包括:预测真菌感染的危险因素 > 20%;年龄 > 65岁;体能状态较差;既往存在真菌感染;既往行放化疗;营养不良的患者;因骨髓侵犯而诱发的中性粒细胞减少;存在多种严重地并发症。本研究临床分析可见,55~60岁的患者与≥60岁的患者在化疗过程中感染发生率,发热时间及严重程度、粒缺时间及输血情况均相似,两组患者对化疗的耐受性相似。对于55~59岁的患者应与≥60岁的患者同样接受预防性给予G-CSF支持治疗,从而减少感染、发热的发生率。
NCCN Myeloid Factors推荐G-CSF合理使用剂量为5 μg/kg,更多的考虑G-CSF临床应用所并发的不良反应,10%~30%的患者在应用期间可出现中度骨骼肌肉疼痛,可以采用非麻醉类药物治疗后缓解[9],在提高剂量后出现明显骨骼、肌肉疼痛加重,少数病例还报道了引发的脾破裂而导致死亡[10]。其他的报道还包括呼吸窘迫综合征、肺泡出血、咯血等[11-12]。但不同人群对G-CSF的耐受性是不同的,本文临床分析显示,在≥55岁的患者预防性应用中,无严重的不良反应发生,仅出现了轻度骨骼及肌肉疼痛,未采用药物治疗都自行缓解,273次治疗周期中未出现因不良反应中断G-CSF应用。但在G-CSF提高剂量后明显地降低了真菌药物的联合使用,减少了因真菌感染而中断治疗,同时也减低了住院费用及住院时间。大剂量G-CSF应用后因缩短粒缺期而减少感染的发生,特别在巩固治疗期间,而诱导治疗期间因也出现减少感染发生的趋向,但差异无统计学意义。大剂量G-CSF应用后,PLT、RBC输注方面也出现了减少的趋势,但差异无统计学意义,需要进一步临床数据支持。
在老年AML的治疗期间,大剂量G-CSF应用后可以明显减少在化疗期间中发生感染、出血等并发症,更好地保证了老年AML治疗期间的安全性,提高了耐受性。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10–29. DOI:10.3322/caac.20138 |
| [2] | Lewis DR, Chen HS, Midthune DN, et al. Early estimates of SEER cancer incidence for 2012: Approaches, opportunities, and cautions for obtaining preliminary estimates of cancer incidence[J]. Cancer, 2015, 121(12): 2053–62. DOI:10.1002/cncr.v121.12 |
| [3] | Klepin HD. Elderly acute myeloid leukemia: Assessing risk[J]. Curr Hematol Malig Rep, 2015, 10(2): 118–25. DOI:10.1007/s11899-015-0257-2 |
| [4] | Tsitsikas DA, Morin A, Araf S, et al. Impact of the revised (2008) EORTC/MSG definitions for invasive fungal disease on the rates of diagnosis of invasive aspergillosis[J]. Med Mycol, 2012, 50(5): 538–42. DOI:10.3109/13693786.2011.630040 |
| [5] | Freifeld AG, Bow EJ, Sepkowitz KA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 Update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2011, 52(4): e56–93. DOI:10.1093/cid/cir073 |
| [6] | Othus M, Kantarjian H, Petersdorf S, et al. Declining rates of treatment-related mortality in patients with newly diagnosed AML given 'intense' induction regimens: a report from SWOG and MD Anderson[J]. Leukemia, 2014, 28(2): 289–92. DOI:10.1038/leu.2013.176 |
| [7] | Tawfik B, Pardee T, Isom S, et al. Comorbidity, age and mortality among adults treated intensively for acute myeloid leukemia (AML)[J]. J Geriatr Oncol, 2016, 7(1): 24–31. DOI:10.1016/j.jgo.2015.10.182 |
| [8] | Kuderer NM, Dale DC, Crawford J, et al. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients[J]. Cancer, 2006, 106(10): 2258–66. DOI:10.1002/(ISSN)1097-0142 |
| [9] | Lyman GH, Dale DC, Wolff DA, et al. Acute myeloid leukemia or myelodysplastic syndrome in randomized controlled clinical trials of cancer chemotherapy with granulocyte colony-stimulating factor: a systematic review[J]. J Clin Oncol, 2010, 28(17): 2914–24. DOI:10.1200/JCO.2009.25.8723 |
| [10] | Bennett CL, Djulbegovic B, Norris LB, et al. Colonystimulating factors for febrile neutropenia during cancer therapy[J]. N Engl J Med, 2013, 368(12): 1131–9. DOI:10.1056/NEJMct1210890 |
| [11] | Tigue CC, McKoy JM, Evens AM, et al. Granulocyte-colony stimulating factor administration to healthy individuals and persons with chronic neutropenia or cancer: an overview of safety considerations from the Research on Adverse Drug Events and Reports project[J]. Bone Marrow Transplant, 2007, 40(3): 185–92. DOI:10.1038/sj.bmt.1705722 |
| [12] | D'Souza A, Jaiyesimi I, Trainor L, et al. Granulocyte colony-stimul-ating factor administration: adverse events[J]. Transfus Med Rev, 2008, 22(4): 280–90. DOI:10.1016/j.tmrv.2008.05.005 |
 2018, Vol. 45
2018, Vol. 45