文章信息
- 小细胞肺癌中LncRNA AC009336.24的表达及其与化疗耐药的关系
- LncRNA AC009336.24 Expression in Small Cell Lung Cancer and Its Relationship with Chemotherapy Resistance
- 肿瘤防治研究, 2018, 45(4): 225-229
- Cancer Research on Prevention and Treatment, 2018, 45(4): 225-229
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0999
- 收稿日期: 2017-08-14
- 修回日期: 2017-12-28
小细胞肺癌约占肺癌的20%,是肺癌中起源于较大支气管的肺Kulchitsky细胞的一种未分化癌,其恶性程度较高、进展快、生存期短、预后较差[1]。小细胞肺癌对放疗及化疗敏感度均较高,治疗上应以全身化疗为主,联合放疗为主要治疗手段,早期对放化疗敏感,但极易出现放化疗抵抗而导致治疗失败[2]。因此,SCLC的多药耐药已成为目前临床亟待解决的难题。
LncRNA是指一类长度超过200个核苷酸的RNA分子的总称,已经成为当今分子生物学最热门的前沿研究领域之一[3]。虽然在人类基因组中已经发现了一些LncRNA,但关于其对基因组的调控及具体机制尚不清楚。前期预实验通过LncRNA芯片发现长链非编码RNA AC009336.24在SCLC耐药细胞株中的表达较化疗敏感细胞株明显增高,提示LncRNA AC009336.24可能与SCLC的耐药相关,然而关于LncRNA AC009336.24在SCLC中的表达及意义,目前国内外尚未见相关报道。本研究应用实时荧光定量PCR法检测LncRNA AC009336.24在SCLC组织中的表达,分析其与患者临床病理特征及化疗敏感度的关系。
1 资料与方法 1.1 病例资料收集2012年1月—2016年12月在川北医学院附属医院肿瘤科、胸外科及呼吸内科进行手术或穿刺活检或支气管镜活检的SCLC组织标本120例,其中35例为手术切除的SCLC患者的癌旁组织(距离癌组织≥2 cm),75例未进行手术治疗的患者的癌组织取自支气管镜或CT引导下的穿刺活检标本。所有患者的病例资料完整,手术前均未接受过放化疗。同期收集40例因各种原因导致肺外伤的正常肺组织标本作为对照组。120例SCLC患者中,男69例、女51例;年龄30~77岁,平均年龄为(54±3.5)岁;局限期49例,广泛期71例;淋巴结转移者66例,无淋巴结转移者54例;远处转移者62例,无远处转移者58例。120例患者均接受以铂类为主的化疗,首先给予一线化疗方案(依托泊苷+铂类)化疗;出现耐药后,给予二线化疗方案(伊立替康+铂类)。其中化疗敏感者(化疗4~5个周期后肿瘤缩小30%以上或消失)48例,化疗耐药者(化疗4~5周期后肿瘤增大30%或以上,或出现新的转移灶)72例;其中72例耐药者给予二线化疗方案治疗。本研究经我院伦理委员会批准,所有研究对象均签署知情同意书。
1.2 随访所有患者出院后都进行了随访,主要以电话和门诊进行随访,随访内容包括一般情况、临床症状及影像学检查(胸腹部CT、浅表淋巴结彩超)。随访起点为手术或病理活检日期,随访时间为4~66月,中位随访时间为42月,随访截止日期为2017年6月30日。至随访结束,存活44例,死亡76例。无失访病例。
1.3 实时荧光定量PCR法检测SCLC组织中LncRNA AC009336.24的表达水平应用TRIzol(美国Invitrogen公司产品)试剂提取SCLC组织、癌旁组织及正常肺组织标本中的总RNA。将提取的总RNA,参照AMV反转录试剂盒[宝生物工程(大连)有限公司产品]说明书提供的方法将其反转录成cDNA。采用2×SYBR Green PCR Master Mix[宝生物工程(大连)有限公司产品],以cDNA为摸板,进行实时荧光定量PCR。引物由宝生物工程(大连)有限公司合成。PCR反应条件:95℃ 10 min;(95℃ 15 s、60℃ 30 s、72℃ 30 s)共40个循环。以2-ΔΔCt值表示LncRNA AC009336.24的表达水平。
1.4 统计学方法用SPSS13.0软件进行数据统计分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验;计数资料采用χ2检验,Kaplan-Meier法绘制患者的生存曲线,并进行Log rank检验;单因素及多因素分析影响SCLC预后的因素,以P < 0.05为差异有统计学意义。
2 结果 2.1 LncRNA AC009336.24在SCLC组织中的表达实时荧光定量PCR检测LncRNA AC009336.24在120例SCLC组织、35例癌旁组织及40例正常肺组织中LncRNA AC009336.24的表达,结果提示LncRNA AC009336.24在SCLC组织中的平均表达水平(8.45±1.320)显著高于癌旁组织(1.370±0.220)及正常肺组织(1.080±0.140),差异有统计学意义(F=17.83, P < 0.001),见图 1A。进一步分析发现LncRNA AC009336.24在耐药患者中的表达明显高于化疗敏感者,差异有统计学意义(t=14.63, P < 0.001),见图 1B。
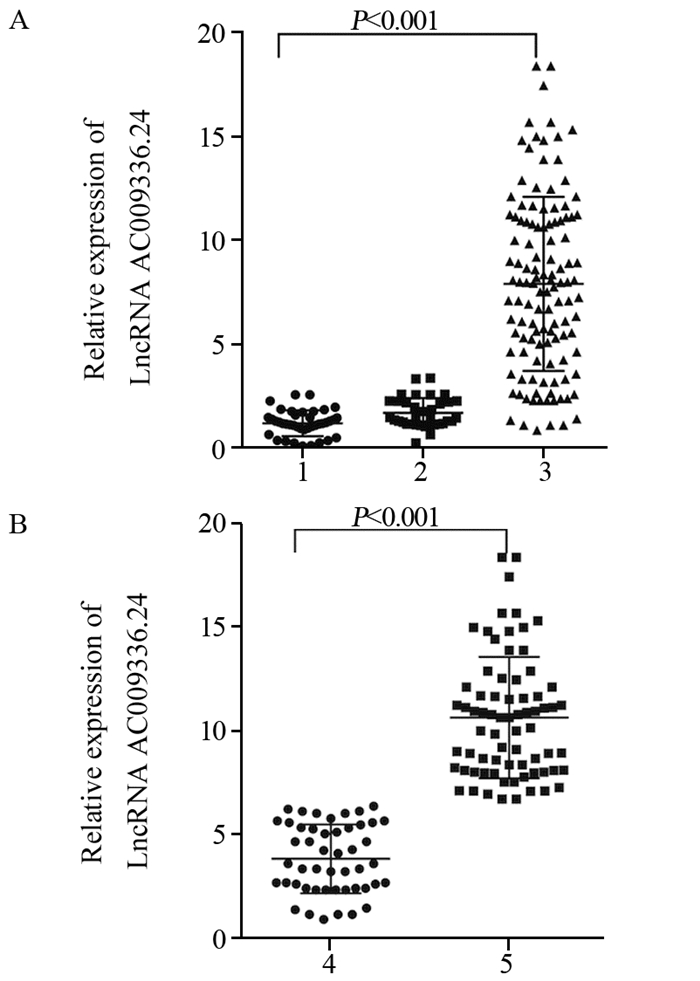
|
| 1: normal tissues(n=40); 2: paracancerous tissues(n=35); 3: cancer tissues(n=120); 4: chemosensitivity(n=48); 5: chemoresistance(n=72); A: the expressions of LncRNA AC009336.24 in SCLC tissues, para-cancerous tissues and normal lung tissues were measured by real-time fluorescent quantitative PCR; B: differential expressions of LncRNA AC009336.24 in chemosensitive and chemoresistant patients 图 1 LncRNA AC009336.24在SCLC组织中的表达 Figure 1 LncRNA AC009336.24 expression in small cell lung cancer (SCLC) tissues |
进一步分析LncRNA AC009336.24表达与患者临床病理特征的关系,结果发现LncRNA AC009336.24表达与患者的年龄、性别、吸烟无关(均P > 0.05),而与疾病分期、淋巴及远处转移、化疗敏感度及患者的生存状态明显相关(均P < 0.05),见表 1。
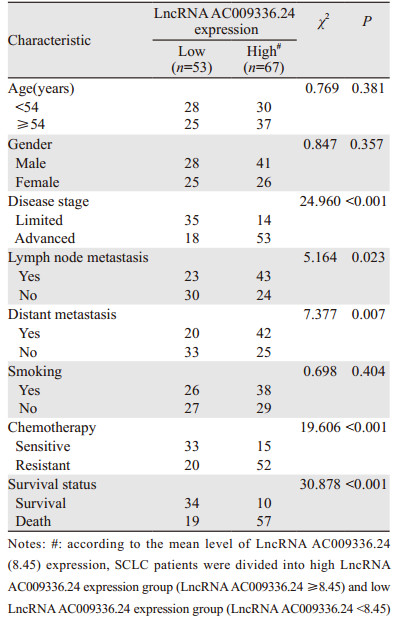
|
采用Kaplan-Meier法绘制SCLC患者的无进展生存及总生存曲线,结果发现LncRNA AC009336.24高表达患者的无进展生存时间((11.32±2.27)月)短于低表达者((18.93±1.66)月),差异有统计学意义(χ2=12.87, P=0.003),见图 2A;LncRNA AC009336.24高表达患者的总生存时间((19.35±1.73)月)短于低表达者((29.25±2.47)月),差异有统计学意义(χ2=21.43, P < 0.001),见图 2B。
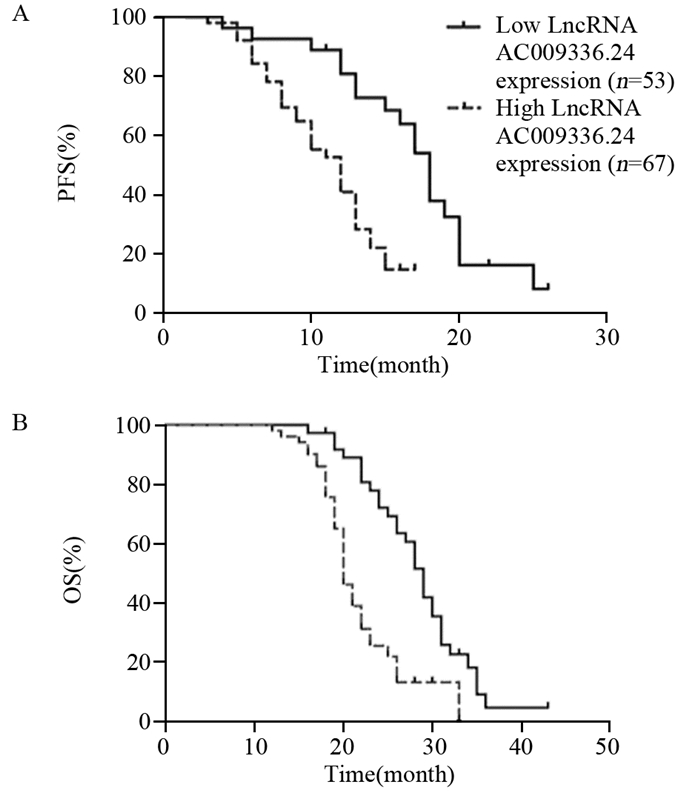
|
| 图 2 SCLC患者的无进展生存及总生存曲线 Figure 2 Progression-free survival(PFS) and OS curves of SCLC patients |
单因素分析发现,疾病分期、淋巴转移、远处转移、化疗敏感度、LncRNAAC009336.24表达与SCLC患者的OS有关(均P < 0.05);多因素分析结果显示,疾病分期、远处转移、LncRNAAC009336.24表达是SCLC患者预后的独立影响因素(均P < 0.05),见表 2。
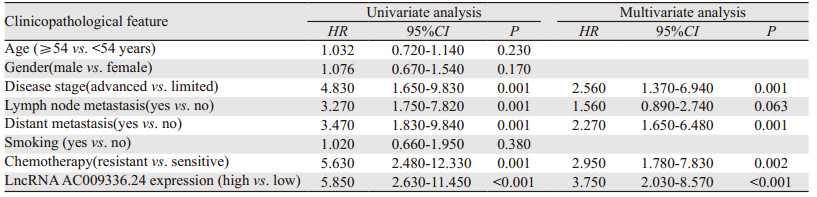
|
小细胞肺癌细胞生物学特性复杂:生长快、转移早、恶性程度高,属于一种特殊类型肺癌[4],其对放化疗敏感,应视为全身性肿瘤进行治疗,医疗界对其治疗方法长期存在争论[5-6]。上世纪70年代以前,手术治疗为首选,但疗效甚差,其原因有:术前体内微型转移灶未能得到控制,加上术中挤压、出血可使免疫力下降,术后很快会发生胸内复发及颅内、骨髓及肝脏等远处转移[7-8]。SCLC患者对化疗和放疗都非常敏感,但极易产生耐药和放疗抵抗,导致治疗失败[9],其具体的作用机制尚未完全阐明。
LncRNA是一类转录本长度超过200 nt的ncRNA,LncRNA一度曾被认为仅仅是RNA聚合酶Ⅱ转录时的副产物,是基因转录时的“噪音”和“垃圾”,并不具有特定的生物学功能,是一个“暗物质”。然而,近年来的研究发现,LncRNA在多种类型肿瘤细胞(包括肺腺癌、肝癌、前列腺癌、肺癌、黑色素瘤等)的増殖、克隆、调亡、侵袭、转移及药物耐药等方面均发挥着重要的作用,越来越多的LncRNA在基因调节等方面的功能被揭示出来[10-12]。LncRNA有望成为新的肿瘤标志物和肿瘤治疗靶点,在肿瘤诊断和治疗方面显示出良好的临床应用前景。有研究发现,转移相关肺腺癌转录本1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)作为早期肺腺癌患者预后的一个独立预后标志物,是第1个在肺癌中被研究的LncRNA[13]。HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)在非小细胞肺癌(non-small cell lung cancer, NSCLC)组织中高表达,HOTAIR高表达状态与NSCLC患者的淋巴结转移及临床分级相关,并预示着患者预后相对较差[14]。结肠癌相关转录因子2(colon cancer associated transcript 2, CCAT2)在NSCLC组织中高表达,CCAT2的高表达与肺腺癌差的预后相关,提示CCAT2可能是一个肺腺癌特异的LncRNA[15]。LncRNA生长停滞特异性转录本5(growth arrest-specific transcript 5, GAS5)在NSCLC组织中低表达,其表达水平与NSCLC的肿瘤大小及临床分级有关。LncRNA GAS6-AS1在NSCLC组织中低表达,其表达水平与NSCLC患者的淋巴结转移以及临床分级有关,而且GAS6-AS1是NSCLC患者的一个独立预后标志物[16]。Niu等[17]研究发现,牛磺酸调节基因1(taurine upregulated gene 1, TUG1)参与调节SCLC的生长和化疗耐药。LncRNA浆细胞瘤变异易位基因1(plasmacytoma variant translocation 1, PVT1)的上调是SCLC患者预后较差的标志物,参与调节SCLC患者的侵袭和迁移[18]。
本研究小组前期通过LncRNA芯片发现,LncRNA AC009336.24在SCLC耐药细胞株中的表达高于化疗敏感细胞株,提示LncRNA AC009336.24可能与SCLC的发生和发展有关。本研究通过实时荧光定量PCR法检测120例SCLC组织、35例癌旁组织及40例正常肺组织中LncRNA AC009336.24的表达,分析LncRNA AC009336.24表达与SCLC患者临床病理特征及预后的关系。结果发现SCLC组织中LncRNA AC009336.24的表达水平明显高于癌旁组织及正常肺组织。LncRNA AC009336.24在化疗耐药患者中的表达明显高于化疗敏感者;LncRNA AC009336.24表达与SCLC患者的性别、年龄无关,而与疾病分期、淋巴结转移、远处转移、化疗耐药相关。高表达LncRNA AC009336.24患者的总生存时间及无进展生存时间均短于低表达者。单因素及多因素分析发现LncRNA AC009336.24表达、疾病分期、远处转移是SCLC患者独立的预后因素。以上研究结果提示,LncRNA AC009336.24参与调节SCLC的发生和发展,可能作为潜在的SCLC患者疗效及预后评估的生物标志物。然而,影响SCLC预后的分子机制复杂,LncRNA AC009336.24调节SCLC患者预后的具体作用机制及参与的信号通路,尚需进一步研究。
| [1] | Gao H, Niu Y, Li M, et al. Identification of DJ-1 as a contributor to multidrug resistance in human small-cell lung cancer using proteomic analysis[J]. Int J Exp Pathol, 2017, 98(2): 67–74. DOI:10.1111/iep.2017.98.issue-2 |
| [2] | Wu AJ, Gillis A, Foster A, et al. Patterns of failure in limited-stage small cell lung cancer: Implications of TNM stage for prophylactic cranial irradiation[J]. Radiother Oncol, 2017, 25(1): 130–5. |
| [3] | Wang A, Meng M, Zhao X, et al. Long non-coding RNA ENST00462717 suppresses the proliferation, survival, and migration by inhibiting MDM2/MAPK pathway in glioma[J]. Biochem Biophys Res Commun, 2017, 485(2): 513–21. DOI:10.1016/j.bbrc.2017.02.015 |
| [4] | Aoyagi K, Kizaki J, Isobe T, et al. Long-term survival of a patient with small cell carcinoma of the stomach with metachronous lung metastases treated by multimodal therapy: a case report[J]. Surg Case Rep, 2015, 1(1): 125. DOI:10.1186/s40792-015-0126-1 |
| [5] | Haixia P, Yifeng B, Honglin H. Role and clinical significance of RLIP76 in regulation of multi-drug resistance of small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2015, 37(4): 266–71. |
| [6] | 罗树春, 白义凤, 兰海涛. 干扰WIG-1的表达对小细胞肺癌多药耐药的影响[J]. 中华肿瘤杂志, 2014, 36(10): 733–8. [ Luo SC, Bai YF, Lan HT. Influence of interference of WIG-1 on the multi-drug resistance in small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(10): 733–8. DOI:10.3760/cma.j.issn.0253-3766.2014.10.003 ] |
| [7] | Jungraithmayr W. Current Indications for Surgery in Small Cell Lung Cancer[J]. Zentralbl Chir, 2017, 142(S01): S44–S50. |
| [8] | Yang CJ, Chan DY, Speicher PJ, et al. Surgery Versus Optimal Medical Management for N1 Small Cell Lung Cancer[J]. Ann Thorac Surg, 2017, 103(6): 1767–72. DOI:10.1016/j.athoracsur.2017.01.043 |
| [9] | Park S, Lee E, Rhee S, et al. Correlation between Semi-Quantitative (18)F-FDG PET/CT Parameters and Ki-67 Expression in Small Cell Lung Cancer[J]. Nucl Med Mol Imaging, 2016, 50(1): 24–30. DOI:10.1007/s13139-015-0363-z |
| [10] | Jin Y, Cui Z, Li X, et al. Upregulation of long non-coding RNA PlncRNA-1 promotes proliferation and induces epithelial-mesenchymal transition in prostate cancer[J]. Oncotarget, 2017, 8(16): 26090–9. |
| [11] | Li H, Jiang X, Niu X. Long Non-Coding RNA Reprogramming (ROR) Promotes Cell Proliferation in Colorectal Cancer via Affecting P53[J]. Med Sci Monit, 2017, 23: 919–28. DOI:10.12659/MSM.903462 |
| [12] | Qi X, Shao M, Sun H, et al. Long non-coding RNA SNHG14 promotes microglia activation by regulating miR-145-5p/PLA2G4A in cerebral infarction[J]. Neuroscience, 2017, 348: 98–106. DOI:10.1016/j.neuroscience.2017.02.002 |
| [13] | Huang NS, Chi YY, Xue JY, et al. Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1 (MALAT1) interacts with estrogen receptor and predicted poor survival in breast cancer[J]. Oncotarget, 2016, 7(25): 37957–65. |
| [14] | Zhou C, Ye L, Jiang C, et al. Long noncoding RNA HOTAIR, a hypoxia-inducible factor-1alpha activated driver of malignancy, enhances hypoxic cancer cell proliferation, migration, and invasion in non-small cell lung cancer[J]. Tumour Biol, 2015, 36(12): 9179–88. DOI:10.1007/s13277-015-3453-8 |
| [15] | Qiu M, Xu Y, Yang X, et al. CCAT2 is a lung adenocarcinoma-specific long non-coding RNA and promotes invasion of non-small cell lung cancer[J]. Tumour Biol, 2014, 35(6): 5375–80. DOI:10.1007/s13277-014-1700-z |
| [16] | Shi X, Sun M, Liu H, et al. A critical role for the long non-coding RNA GAS5 in proliferation and apoptosis in non-small-cell lung cancer[J]. Mol Carcinog, 2015, 54 Suppl 1: E1–E12. |
| [17] | Niu Y, Ma F, Huang W, et al. Long non-coding RNA TUG1 is involved in cell growth and chemoresistance of small cell lung cancer by regulating LIMK2b via EZH2[J]. Mol Cancer, 2017, 16(1): 5. DOI:10.1186/s12943-016-0575-6 |
| [18] | Huang C, Liu S, Wang H, et al. LncRNA PVT1 overexpression is a poor prognostic biomarker and regulates migration and invasion in small cell lung cancer[J]. Am J Transl Res, 2016, 8(11): 5025–34. |
 2018, Vol. 45
2018, Vol. 45


