文章信息
- 晚期肺癌患者肺部感染死亡危险因素分析
- Risk Factors for Death of Advanced Lung Cancer Patients with Lung Infection
- 肿瘤防治研究, 2018, 45(4): 221-224
- Cancer Research on Prevention and Treatment, 2018, 45(4): 221-224
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0993
- 收稿日期: 2017-08-14
- 修回日期: 2017-11-23
2. 558000 都匀,贵州医科大学第三附属医院肿瘤科;
3. 558000 都匀,贵州医科大学第三附属医院呼吸内科
2. Department of Oncology, The Third Affiliated Hospital of Guizhou Medical University, Duyun 558000, China;
3. Department of Respiratory Medicine, The Third Affiliated Hospital of Guizhou Medical University, Duyun 558000, China
原发性肺癌是临床最常见的恶性肿瘤之一,其发病率与病死率均高居各类恶性肿瘤之首[1-2],尤其是晚期肺癌患者死亡率较高。在晚期肺癌患者的死亡原因中主要直接或间接死亡于肺部感染,芮萌等研究显示,68.18%肺癌患者直接或间接死于肺部感染[3]。本研究针对晚期肺癌伴肺部感染病原菌分布与死亡危险因素进行分析,旨在为临床治疗提供参考,结果报道如下。
1 资料与方法 1.1 临床资料2010年1月1日—2017年5月31日共收治伴肺部感染的晚期肺癌患者186例,其中男154例、女32例,年龄41~77岁、平均年龄(59.31±8.24)岁。
1.2 诊断标准晚期肺癌诊断标准:按照《中国晚期原发性肺癌诊治专家共识(2016年版)》进行诊断[4];肺部感染诊断标准:中华人民共和国卫生部颁发《医院感染诊断标准(2001版)》进行诊断[5]。
1.3 方法根据伴肺部感染晚期肺癌患者是否发生死亡分为死亡组和非死亡组,分别记录每例患者的临床资料,包括性别、年龄、病理类型、是否吸烟、体重指数(body mass index, BMI)值、肿瘤组织分化程度、功能状态评分(KPS评分)、转移部位、合并症、肺部感染类型、是否为多重耐药菌感染、是否有真菌感染、抗肿瘤治疗药物种数、靶向药物治疗、免疫治疗、血清白蛋白浓度、血红蛋白浓度、是否发生死亡、临床标本是否分离出病原菌、种类是否为多重耐药菌等。纳入标准为同时符合晚期肺癌与肺部感染诊断的患者。排除标准:(1)临床资料不全患者;(2)死亡原因不明患者。功能状态评分采用(Karnofsky performance status, KPS)评分。
1.4 统计学方法计数资料用率(%)表示,用χ2检验比较,计量资料用(x±s)表示,用t检验比较,多因素分析采用Logistic回归模型,统计软件采用SPSS20.0,P < 0.05为差异有统计学意义。
2 结果 2.1 死亡率186例伴肺部感染的晚期肺癌患者发生死亡52例,死亡率为27.96%。
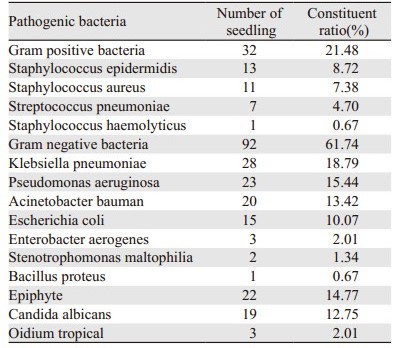
2.2 感染病原菌分布在186例伴肺部感染晚期肺癌患者临床标本中,共检出病原菌149株,其中革兰氏阳性菌32株占21.48%、革兰氏阴性菌92株占61.74%、真菌22株占14.77%,见表 1。
|
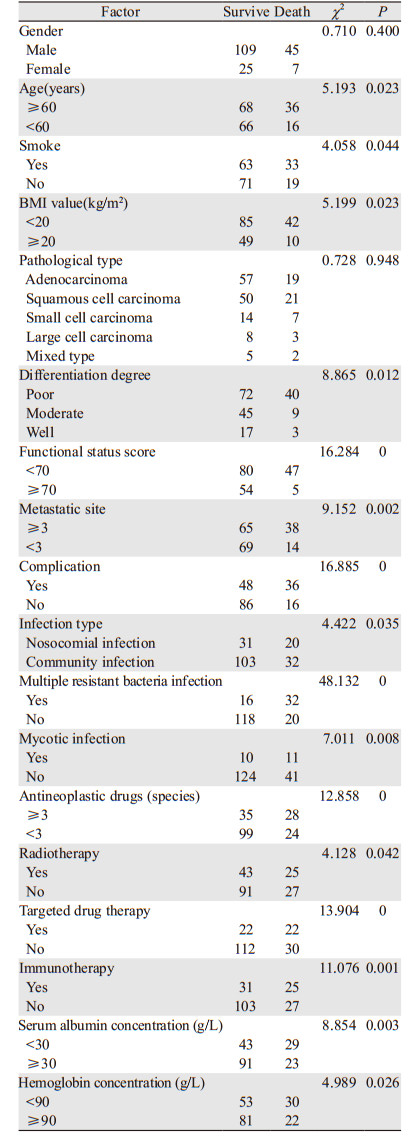
单因素分析显示,除性别与病理类型外,年龄(≥60岁)、吸烟、BMI值(< 20 kg/m2)、组织分化程度(低)、功能状态评分(< 70分)、转移部位(≥3)、合并症、感染类型(院内感染)、多重耐药菌感染、真菌感染、抗肿瘤治疗药物(≥3种)、靶向药物治疗、免疫治疗、血清白蛋白浓度(< 30 g/L)、血红蛋白浓度(< 90 g/L)均是肺癌患者肺部感染死亡的相关危险因素(P < 0.05),见表 2。
|
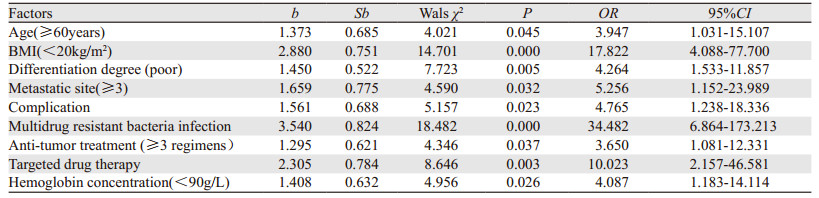
将单因素分析具有统计学意义的变量采用Logistic回归模型分析结果显示,年龄(≥60岁)、BMI值(< 20 kg/m2)、组织分化程度(低)、转移部位(≥3)、合并症、多重耐药菌感染、抗肿瘤治疗药物(≥3种)、靶向药物治疗、血红蛋白浓度(< 90 g/L)等均是晚期肺癌患者肺部感染死亡的独立危险因素(P < 0.05),见表 3。
本研究显示,186例伴肺部感染的晚期肺癌患者发生死亡52例,死亡率为27.96%,提示肺部感染是导致晚期肺癌患者死亡的主要原因之一,芮萌等[3]研究显示,直接或间接死于肺部感染的晚期肺癌患者占死亡晚期肺癌患者的68.18%,与本研究结果相近;在186例伴肺部感染晚期肺癌患者临床标本中,共检出病原菌149株,其中革兰阳性菌32株占21.48%、革兰阴性菌92株占61.74%、真菌22株占14.77%,提示晚期肺癌患者肺部感染病原菌以革兰阴性菌为主,可能主要来源于患者肺部定植菌和医院感染病原菌,当机体免疫功能下降时,定植菌可侵入人体引起感染[6],且多重耐药菌检出率也较多,本研究显示,多重耐药菌检出占病例的34.78%,其次真菌占比明显较多,尤其白色念珠菌感染较明显,占12.75%,可能与晚期肺癌患者反复出现肺部感染,反复长期联合使用抗菌药物引起菌群失调,真菌感染率上升有关[7],因此临床在诊治过程中应重视病原菌监测和研究,尽可能根据病原学培养与药敏试验合理选择抗菌药物,减少多重耐药菌感染快速上升与二重感染产生,提高治疗效果。
老年患者脏器生理功能大多有不同程度退化、机体防御机能衰减,一方面呼吸道黏膜清除功能降低,呼吸功能下降,咳嗽与吞咽反射也减弱,食物或气道分泌物易被误吸入肺,引起肺部感染进一步加重,另一方面患者合并症较多;合并其他呼吸系统疾病、心血管疾病、脑血管疾病、糖尿病等,这些合并症不仅增加晚期肺癌患者肺部感染的风险,也增加临床治疗的难度与死亡危险性,直接影响晚期肺癌患者肺部感染及其预后[8];而住院期间进行侵入性操作,显著增加了院内感染概率,而后者感染的病原菌的耐药性明显高于社区感染[9];广谱抗菌药物、免疫抑制剂与抗肿瘤化疗药物的广泛应用不仅使多重耐药菌与深部真菌感染等二重感染机会不断上升,病情更加复杂,治疗难度进一步上升,死亡率升高。接受放疗患者白细胞降低,抵抗力和免疫力均受到损害。靶向药物治疗与免疫治疗可引起肺部损伤,增加肺部感染机会;抗肿瘤化疗药物的应用,特别是多种抗肿瘤化疗药物的联合使用可损害免疫功能,造成难以恢复的骨髓急慢性损伤,肺部感染加重,甚至危及生命[10]。晚期肺癌患者广泛向肺、肝、脑、骨等重要器官转移可引起相应器官功能障碍,广泛向胸腔、腹腔和心包等浆膜腔转移,可引起患者胸闷、憋气、呼吸困难、纳差、腹胀等症状,导致多器官功能衰竭,病情加重,死亡增加[11]。晚期肺癌患者肿瘤细胞分化程度越低,恶性程度越高,侵袭力越强,转移越快,病情越重,治疗预后越差[12]。吸烟可损害呼吸功能,加重肺部感染[13]。晚期肺癌患者机体免疫系统常受到攻击,多数患者免疫功能已缺陷[14-15],再加上肿瘤消耗增加、纳差、肿瘤化疗造成的难以恢复的骨髓急慢性损伤、造血功能低下等原因,导致贫血、低蛋白血症、消瘦甚至恶病质,直接影响机体抵抗力。功能状态评分能综合考虑肿瘤相关症状与并发症,由患者自我感觉、医生主观判断与其他客观因素共同决定,具有综合性与个体化,是一项多维变量,临床医生可全面评价患者的一般状态,可对患者治疗方案的制定与预后具有较好的指导作用[16]。
综上所述,晚期肺癌肺部感染死亡与多个危险因素有关。临床应纠正贫血、补充白蛋白等营养物质,改善提高患者体质,提高免疫功能,治疗合并症,监测感染病原菌与耐药性,合理选用抗菌药物,减少多重耐药菌与二重感染,关注老年与多发转移患者功能状态,根据患者功能状态选用靶向治疗,合理制定个性化抗肿瘤化疗方案等为主的综合措施,是有效降低晚期肺癌肺部感染患者死亡率的方法[17]。
| [1] | Chen D, Zhang Y, Zhang X, et al. Overexpression of integrin-linked kinase correlates with malignant phenotype in non-small cell lung cancer and promotes lung cancer cell invasion and migration via regulating epithelial-mesenchymal transition (EMT)-related genes[J]. Acta Histochem, 2013, 115(2): 128–36. DOI:10.1016/j.acthis.2012.05.004 |
| [2] | Lopez Guerra JL, Gomez D, Zhuang Y, et al. Change in diffusing capacity after radiation as an objective measure for grading radiation pneumonitis in patients treated for non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(5): 1573–9. DOI:10.1016/j.ijrobp.2011.10.065 |
| [3] | 芮萌, 段蕴铀. 老年肺癌住院死亡患者肺部感染影响因素分析[J]. 肿瘤防治研究, 2015, 42(3): 252–5. [ Rui M, Duan YY. Influencing factors for pulmonary infection in dead elderly inpatients with lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(3): 252–5. ] |
| [4] | 石远凯, 孙燕, 于金明, 等. 中国肺癌脑转移诊治专家共识(2017年版)[J]. 中国肺癌杂志, 2017, 20(1): 1–13. [ Shi YK, Sun Y, Yu JM, et al. China Experts Consensus on the Diagnosis and Treatment of Brain Metastases of Lung Cancer (2017 version)[J]. Zhongguo Fei Ai Za Zhi, 2017, 20(1): 1–13. DOI:10.3779/j.issn.1009-3419.2017.01.01 ] |
| [5] | 中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314–20. [ Ministry of health of the People's Republic of China. Diagnostic criteria for nosocomial infection (proposed)[J]. Zhonghua Yi Xue Za Zhi, 2001, 81(5): 314–20. ] |
| [6] | 于海容, 张丽娜, 薛庆亮, 等. 晚期肺癌患者并发肺部感染的病原菌及药敏分析[J]. 军医进修学院学报, 2012, 33(8): 842–4. [ Yu HR, Zhang LN, Xue QL, et al. Pathogenic bacteria and their drug sensitivity in patients with advanced lung cancer accompanying lung infection[J]. Jun Yi Jin Xiu Xue Yuan Xue Bao, 2012, 33(8): 842–4. ] |
| [7] | 马闪珊, 赵硕, 孙冬梅, 等. 恶性血液病患者侵袭性真菌感染的影响因素及感染前后肠道菌群结构变化分析[J]. 中华医院感染学杂志, 2017, 27(5): 1039–42. [ Ma SS, Zhao S, Sun DM, et al. Influencing factors for invasive fungal infection in patients with malignant hematologic diseases and changes of intestinal flora structure before and after infection[J]. Zhonghua Yi Yuan Gan Ran Xue Za Zhi, 2017, 27(5): 1039–42. ] |
| [8] | 王延风, 杨敏, 彭黎黎, 等. 合并症对老年非小细胞肺癌患者预后及生存的影响[J]. 中国肿瘤临床与康复, 2012, 19(3): 213–7. [ Wang YF, Yang M, Peng LL, et al. The influence of comorbidity on the prognosis and survival of elderly patients with non-small cell lung cancer[J]. Zhongguo Zhong Liu Lin Chuang Yu Kang Fu, 2012, 19(3): 213–7. ] |
| [9] | 谢朝云, 熊芸, 孙静, 等. 医院感染与社区感染肺炎链球菌分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(23): 5341–3. [ Xie ZY, Xiong Y, Sun J, et al. Distribution and resistance of Streptococcus pneumoniae causing hospital and community-acquired infections[J]. Zhonghua Yi Yuan Gan Ran Xue Za Zhi, 2015, 25(23): 5341–3. ] |
| [10] | 廖美琳. 肺癌[M]. 北京: 中国医药科技出版社, 2003: 3881.] [ Liao ML. Lung cancer[M]. Beijing: Zhongguo Yi Yao Ke Ji Chu Ban She, 2003: 3881. ] |
| [11] | Nichols L, Saunders R, Knollmann FD. Causes of death of patients with lung cancer[J]. Arch Pathol Lab Med, 2012, 136(12): 1552–7. DOI:10.5858/arpa.2011-0521-OA |
| [12] | 梁英平, 刘娟妮, 白国栋, 等. ERCC1、β-Tubulin Ⅲ在非小细胞肺癌中的表达及其与肺癌预后相关性研究[J]. 陕西医学杂志, 2015, 44(7): 801–4. [ Liang YP, Liu JN, Bai GD, et al. The expression of ERCC1, β-TubulinⅢ and its relationship with prognosis in Non-small cell lung cancer[J]. Shaanxi Yi Xue Za Zhi, 2015, 44(7): 801–4. ] |
| [13] | 刘长浩, 朱佳, 刘宏旭. 吸烟肺癌患者应用纤维支气管镜灌洗吸痰预防术后肺部感染[J]. 肿瘤学杂志, 2017, 23(5): 445–7. [ Liu CH, Zhu J, Liu HX. Aspiration of sputum with fiberoptic bronchiascopic lavage in prevention of postoperative pulmonary infections in smoking patients with lung cancer[J]. Zhong Liu Xue Za Zhi, 2017, 23(5): 445–7. DOI:10.11735/j.issn.1671-170X.2017.05.B019 ] |
| [14] | Caras I, Grigorescu A, Stavaru C, et al. Evidence for immune defects in breast and lung cancer patients[J]. Cancer Immunol Immunother, 2004, 53(12): 1146–52. DOI:10.1007/s00262-004-0556-2 |
| [15] | Gao Y, Tang W, Dai X, et al. Effects of water-soluble Ganoderma lucidum polysaccharides on the immune functions of patients with advanced lung cancer[J]. J Med Food, 2005, 8(2): 159–68. DOI:10.1089/jmf.2005.8.159 |
| [16] | 李敏哲, 盛辉, 闫瑞华, 等. 功能状态评分对小细胞肺癌预后影响的Meta分析[J]. 中国老年学杂志, 2014, 34(23): 6632–4. [ Li MZ, Sheng H, Yan RH, et al. Meta analysis score and prognosis of small cell lung cancer[J]. Zhongguo Lao Nian Xue Za Zhi, 2014, 34(23): 6632–4. DOI:10.3969/j.issn.1005-9202.2014.23.043 ] |
| [17] | Gridelli C, Ardizzoni AL, Chevalier T, et al. Treatment of advanced nonsmall-call lung cancer patients with ECOG performance status 2: results of a European Experts Panel[J]. Ann Oncol, 2004, 15(3): 419–26. DOI:10.1093/annonc/mdh087 |
 2018, Vol. 45
2018, Vol. 45