文章信息
- 曲妥珠单抗治疗185例HER2阳性乳腺癌患者的心脏安全性评价
- Cardiac Safety of Trastuzumab on 185 Patients with HER2 Positive Breast Cancer
- 肿瘤防治研究, 2018, 45(2): 86-90
- Cancer Research on Prevention and Treatment, 2018, 45(2): 86-90
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0975
- 收稿日期: 2017-08-10
- 修回日期: 2017-10-31
乳腺癌是一种高度异质性疾病,不同分子分型的乳腺癌其治疗及预后差异较大[1-2]。在第13届St Gallen国际乳腺癌会议上,根据基因水平确定了一个新的乳腺癌分子分型标准,将乳腺癌分为4型:Luminal A型、Luminal B型、HER2过表达型和基底样型4个类型,其中每一个类型有特定的分子和临床特征,其预后和治疗手段也各不相同[3]。
人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)是由17q21号染色体上的原癌基因(HER2/neu)编码的跨膜受体样蛋白,具有酪氨酸激酶活性。原癌基因(HER2/neu)的扩增导致HER2的过度表达。研究表明15%~30%的乳腺癌、21%~33%的胃或食管结肠癌中存在HER2的过度表达[4]。同时,HER2阳性乳腺癌患者对某些化疗和内分泌治疗药物耐药,易早期复发或转移,导致生存率下降,约30%的复发转移患者为HER2过表达型乳腺癌[5-6]。曲妥珠单抗(商品名:赫赛汀,Herceptin)能特异结合HER2受体细胞外段,干扰HER2与其他ErbB家族成员形成异源二聚体,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[7]。1998年,美国FDA批准治疗HER2过表达的转移性乳腺癌药物赫赛汀上市。研究表明,HER2扩增的乳腺癌患者可以从赫赛汀治疗获益,最大可减低40%的复发风险,并减低37%的死亡风险[8],而未扩增的患者疗效不明显。赫赛汀从2002年在中国上市至今,中国人群在10多年的应用中积累了丰富的临床经验和数据。然而,任何药物都有或多或少、或轻或重的不良反应,曲妥珠单抗的心脏毒性从上市以来一直是临床医生关注的重点。本研究通过观察本院收治的185例HER2阳性乳腺癌患者应用曲妥珠单抗后的心脏安全性,为其应用于临床治疗提供更多的理论依据。
1 资料与方法 1.1 研究对象收集2012年1月至2013年1月在天津医科大学肿瘤医院接受曲妥珠单抗治疗的HER2阳性女性乳腺癌患者。随访截至2014年4月。诊断与入选标准:雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR),阳性标准:免疫组织化学染色阳性细胞≥10%。HER2免疫组织化学染色0或(+)被判定为阴性,(+++)被判定为阳性,(++)用荧光原位杂交(fluorescence in situ hybridization, FISH)进行验证,FISH结果阳性则判定为阳性。本研究中,185例HER2过表达型乳腺癌患者免疫组织化学染色显示HER2(+++)者为77例,FISH(+)者为108例。年龄≥18岁,至少在我院接受过1次含曲妥珠单抗方案的治疗,曲妥珠单抗可联合化疗或内分泌治疗。排除标准:无基线及后续心功能监测数据的病例,不能配合进行生存随访或造成生存期不明的失访病例。最终符合入组标准者共185例,所有病例均经组织病理学检查后确诊为浸润性乳腺癌,用药前用标准12个电极的心电图作筛选检查,结果均无明显异常,所有患者在用药前的左心室射血分数(left ventricular ejection firaction, LVEF)的基线值均 > 55%。
1.2 给药方法曲妥珠单抗的首次剂量为8 mg/kg,以后剂量为6 mg/kg,每3周给药1次。药物溶于0.9%氯化钠溶液中90 min内滴完。患者首次应用曲妥珠单抗要观察至少6 h(即在输注完后4.5 h)。如果首次应用未出现严重输注反应,第二次用药的观察期可缩短至2 h(即输注完后30 min)。
1.3 心脏安全性评价标准曲妥珠单抗相关心脏毒性(TACT)药物不良反应的判定标准:(1)曲妥珠单抗使用过程中LVEF较基线下降≥15%;(2)较基线下降≥10%且监测值 < 50%;(3)曲妥珠单抗使用过程中LVEF监测值 < 45%。LVEF监测:采用超声心动图法,分别于曲妥珠单抗使用前1月内(确定治疗前LVEF基线)、曲妥珠单抗使用期间及停药后进行监测,每3月监测1次。遵循中国《HER-2阳性乳腺癌临床诊疗专家共识》[9]中关于心脏不良反应的防治原则:如出现LVEF较基线下降达到16%及以上,或低于50%并且LVEF较治疗前下降≥10%,应停止曲妥珠单抗体治疗至少4周,并每4周检测1次LVEF,患者在4~8周内LVEF回升至正常范围或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单抗,LVEF持续下降超过8周,或者3次以上因心肌病而停止曲妥珠单抗治疗,应永久停止使用曲妥珠单抗[9]。按照NYHA分级标准,出现Ⅲ级或Ⅳ级心功能不全的患者应停止曲妥珠单抗的治疗。心电图监测:采用标准12导联心电图进行检查。每周期化疗前进行心电图检查,化疗结束后,每3月进行心电图检查。根据心电图检查报告中ST-T段的下移幅度判定心肌劳损程度。
1.4 统计学方法应用SPSS22.0统计软件进行分析。各组数据间的比较采用χ2检验,不同时间点LVEF值的比较采用t检验,P < 0.05为差异有统计学意义。
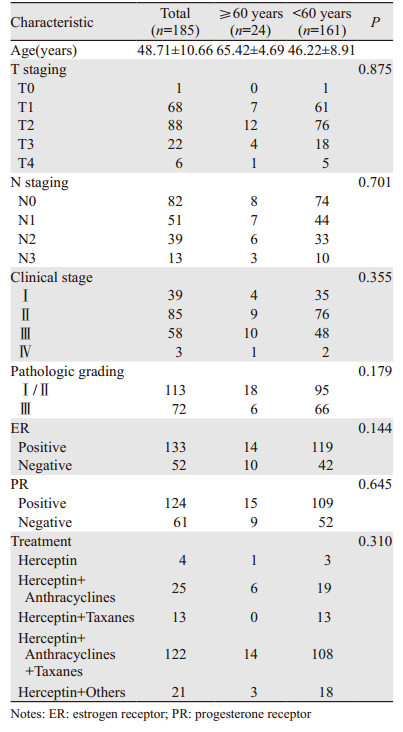
2 结果 2.1 患者的临床病理特征185例患者中位年龄为49(23~80)岁,其中绝经前123例、绝经后62例。以年龄为分组标准,按照联合国世界卫生组织对年龄的划分标准分为≥60岁组(老年组,24例)及 < 60岁组(非老年组,161例),两组间临床病理资料比较差异均无统计学意义(P > 0.05),见表 1。
|
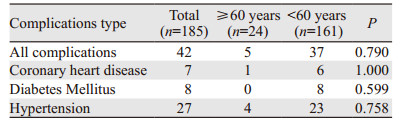
185例患者中有42例合并基础疾病。亚组统计分析结果表明,不同年龄组间并发症差异无统计学意义(P > 0.05),见表 2。
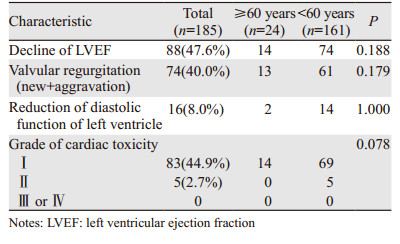
全组患者入组前的心功能评价、心电图检查、超声心动图检查结果均基本正常。记录患者治疗前的LVEF基线水平,全组患者LVEF基线水平为(63.76±2.55)%,≥60岁组为(63.25±2.21)%,< 60岁组为(63.83±2.60)%,两组间差异无统计学意义(P=0.826)。185例患者中接受曲妥珠单抗治疗≥1年的占59.8%,最长36周期,半年的占32.9%,治疗不到半年的占7.3%,全组患者中位治疗周期数是17个(4~36个)。早期停药的患者主要是因为经济原因或者是疾病进展。治疗后复查患者的超声心动图,未见Ⅲ或Ⅳ级心脏毒性发生。患者无自觉症状,没有停止治疗。185例患者中没有出现有症状的心功能不全,全组患者无因心脏毒性而推迟或停止曲妥珠单抗治疗,见表 3。
|
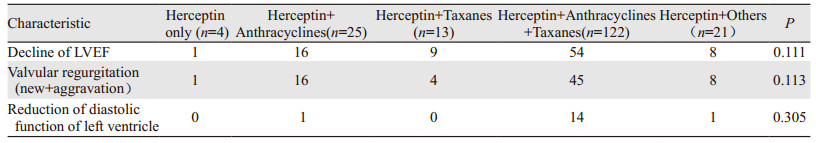
进一步评估赫赛汀合并不同化疗方案对于心脏毒性的影响发现,赫赛汀单药治疗、赫赛汀联合蒽环类药物治疗、赫赛汀联合紫杉类药物治疗、赫赛汀同时联合蒽环类药物和紫杉类药物治疗以及赫赛汀联合其他化疗药物治疗之间,射血分数下降、瓣膜反流改变及收缩功能的下降差异均无统计学意义(均P > 0.05),见表 4。
|
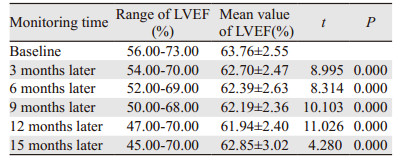
跟踪随访患者15月LVEF变化情况,仅有1例低于50%。进一步将上述资料采用配对t检验的方法,分别将第3、6、9、12、15月所观察到的LVEF与基线水平相比,LVEF的差异均有统计学意义(均P < 0.05),见表 5。
|
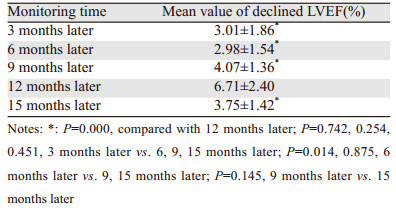
185例HER2阳性乳腺癌患者接受曲妥珠单抗治疗,88例出现LVEF下降,并监测治疗后3、6、9、12、15月时LVEF下降的程度。进一步将上述资料采用两两配对t检验的方法,分别将第3、6、9、12、15月所观察到的LVEF的下降值进行两两比较,12月时LVEF下降的均值与其余组相比,差异均有统计学意义(均P < 0.05),见表 6。
|
近年来,我国乳腺癌的发病率呈逐年上升趋势,且发病年龄较西方欧美国家有年轻化的趋势[10]。本研究中患者诊断为乳腺癌时的中位年龄为49岁,与文献报道的相似。乳腺癌是一种高度异质性、全身性疾病,每一种类型乳腺癌有其特定的分子表型和临床特征,其治疗手段及预后也各不相同,研究表明大约20%~30%的患者为HER2过表达型乳腺癌,是乳腺癌预后不良的风险因素[11-12]。
赫赛汀作为第一个靶向HER2的人源化单克隆抗体,可显著改善HER2阳性乳腺癌患者的预后与转归,目前已成为抗HER2治疗的标准[13]。入选患者总数超过13 000例的四大临床研究(HERA、NCCTG N9831、NSABP B-31及BCIRG 006)结果一致表明[14-18],HER2阳性乳腺癌患者在术后辅助化疗的基础上接受1年赫赛汀治疗能显著延长患者的无病生存期(disease-free survival, DFS)和总生存期(overall survival, OS),使早期乳腺癌患者复发风险降低36%~52%,死亡风险降低33%。2014年11月JCO杂志报道了NSABP B-31和NCCTG N9831随访10年的结果:赫赛汀联合化疗与单独化疗相比,可以相对提高37%的OS,10年OS由75.2%提高到84%,DFS也相对提高40%,10年DFS由62.2%提高到73.7%[19]。以上研究结果奠定了HER2阳性乳腺癌在术后辅助化疗基础上接受1年靶向治疗作为HER2阳性乳腺癌的标准治疗方案。
然而,作为曲妥珠单抗的主要不良反应之一,心脏毒性一直是研究者及医生关注的焦点,其中最主要的心脏不良事件的表现是无症状性LVEF的下降和充血性心力衰竭。研究显示,曲妥珠单抗治疗的乳腺癌患者中,有6.0%的患者出现心功能不全,3.3%的患者因严重不良反应导致停药[20]。在以上四大临床研究中,曲妥珠单抗治疗组的心脏毒性事件发生率明显高于对照组,不过严重心脏事件的发生率仍比较低。一项Ⅲ期大样本临床研究结果显示,曲妥珠单抗治疗后Ⅲ或Ⅳ级心脏毒性的发生率为23.2%,12.7%的患者经历了严重的心脏不良事件[21]。另外,出现无症状的LVEF下降在治疗中也备受关注。在NCCTG N9831研究中,LVEF下降的发生率为8%~10%,而HERA及NSABP B-31的发生率分别为3%和14%[16-17, 22]。
本研究中,对185例乳腺癌患者在曲妥珠单抗治疗后复查LVEF,其中88例(47.6%)出现了LVEF下降,74例出现瓣膜反流(新增+加重),16例出现左室舒张功能下降。发生心脏毒性88例(47.6%),其中Ⅰ级心脏毒性83例(44.9%),Ⅱ级心脏毒性5例(2.7%),未见Ⅲ或Ⅳ级心脏毒性发生。跟踪随访患者15月LVEF变化情况,185例患者在15月的过程中,第3、6、9、12、15月所观察到的LVEF与基线水平相比差异有统计学意义(P < 0.05)。这些结果说明曲妥珠单抗对心脏功能有一定影响,应在治疗中注意监测。虽然本组尚未发现明显心功能衰竭的患者,但参照以往文献大宗病例报告,这一可能性仍应警惕。
同时,我们比较了曲妥珠单抗单药及联合其他化疗药物治疗发现,不同的化疗方案,并未显著增加曲妥珠单抗相关的心脏毒性(P > 0.05),这也许与本试验观察例数较少有关,可以进一步扩大样本量以验证。
综上所述,对于HER2阳性乳腺癌患者在应用曲妥珠单抗治疗中,应注意监测和警惕对心脏的影响。从本组治疗经验来看,曲妥珠单抗较少造成严重的心功能损伤,对大多数患者而言是安全的。但是本研究的例数不多,尚需大样本的临床观察以提供更多的循证医学证据。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9–29. DOI:10.3322/caac.21208 |
| [2] | Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes--dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736–47. DOI:10.1093/annonc/mdr304 |
| [3] | Goldhirsch A, Winer EP, Coates AS, et al. Personalizing the treatment of women with early breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J]. Ann Oncol, 2013, 24(9): 2206–23. DOI:10.1093/annonc/mdt303 |
| [4] | Mignot F, Ajgal Z, Xu H, et al. Concurrent administration of anti-HER2 therapy and radiotherapy: Systematic review[J]. Radiother Oncol, 2017, 124(2): 190–9. DOI:10.1016/j.radonc.2017.07.006 |
| [5] | Florido R, Smith KL, Cuomo KK, et al. Cardiotoxicity from human epidermal growth factor receptor-2 (HER2) targeted therapies[J]. J Am Heart Assoc, 2017, 6(9): pii: e006915. DOI:10.1161/JAHA.117.006915 |
| [6] | Hynes NE, MacDonald G. ErbB receptors and signaling pathways in cancer[J]. Curr Opin Cell Biol, 2009, 21(2): 177–84. DOI:10.1016/j.ceb.2008.12.010 |
| [7] | Aitelhaj M, Lkhouyaali S, Rais G, et al. Cardiac safety of the adjuvant Trastuzumab in a Moroccan population: observational monocentric study of about 100 patients[J]. BMC Res Notes, 2013, 6: 339. DOI:10.1186/1756-0500-6-339 |
| [8] | Demonty G, Bernard-Marty C, Puglisi F, et al. Progress and new standards of care in the management of HER-2 positive breast cancer[J]. Eur J Cancer, 2007, 43(3): 497–509. DOI:10.1016/j.ejca.2006.10.020 |
| [9] | 中国抗癌协会乳腺癌专业委员会. Her-2阳性乳腺癌临床诊疗专家共识[J]. 中国癌症杂志, 2012, 22(4): 314–8. [ Committee on Breast Cancer of Chinese Cancer Society. Expert consensus on clinical diagnosis and treatment of Her-2 positive breast cancer[J]. Zhongguo Ai Zheng Za Zhi, 2012, 22(4): 314–8. ] |
| [10] | Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279–89. DOI:10.1016/S1470-2045(13)70567-9 |
| [11] | Sun Y, Li T, Zhang Y, et al. Evaluation of Left Ventricular Ejection Fractions in Breast Cancer Patients Undergoing Long-Term Trastuzumab Treatment[J]. Med Sci Monit, 2016, 22: 5035–40. DOI:10.12659/MSM.898807 |
| [12] | Jankowitz RC, Abraham J, Tan AR, et al. Safety and efficacy of neratinib in combination with weekly paclitaxel and trastuzumab in women with metastatic HER2 positive breast cancer: an NSABP Foundation Research Program phase Ⅰ study[J]. Cancer Chemother Pharmacol, 2013, 72(6): 1205–12. DOI:10.1007/s00280-013-2262-2 |
| [13] | da Fonseca LG, de Melo Gagliato D, Takahashi TK, et al. Cardiac safety of (neo)adjuvant trastuzumab in the community setting: a single-center experience[J]. Breast Care (Basel), 2014, 9(4): 255–60. |
| [14] | Nemeth BT, Varga ZV, Wu WJ, et al. Trastuzumab cardiotoxicity: from clinical trials to experimental studies[J]. Br J Pharmacol, 2016: 7. |
| [15] | Florido R, Smith KL, Cuomo KK, et al. Cardiotoxicity From Human Epidermal Growth Factor Receptor-2 (HER2) Targeted Therapies[J]. J Am Heart Assoc, 2017, 6(9): pii: e006915. DOI:10.1161/JAHA.117.006915 |
| [16] | Perez EA, Romond EH, Suman VJ, et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31[J]. J Clin Oncol, 2011, 29(25): 3366–73. DOI:10.1200/JCO.2011.35.0868 |
| [17] | Romond EH, Jeong JH, Rastogi P, et al. Seven-year follow-up assessment of cardiac function in NSABP B-31, a randomized trial comparing doxorubicin and cyclophosphamide followed by paclitaxel (ACP) with ACP plus trastuzumab as adjuvant therapy for patients with node-positive, human epidermal growth factor receptor 2-positive breast cancer[J]. J Clin Oncol, 2012, 30(31): 3792–9. DOI:10.1200/JCO.2011.40.0010 |
| [18] | Slamon D, Eiermann W, Robert N, et al. Adjuvant trastuzumab in HER2-positive breast cancer[J]. N Engl J Med, 2011, 365(14): 1273–83. DOI:10.1056/NEJMoa0910383 |
| [19] | Perez EA, Romond EH, Suman VJ, et al. Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer: planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831[J]. J Clin Oncol, 2014, 32(33): 3744–52. DOI:10.1200/JCO.2014.55.5730 |
| [20] | Jones SE, Collea R, Paul D, et al. Adjuvant docetaxel and cyclophosphamide plus trastuzumab in patients with HER2-amplified early stage breast cancer: a single-group, open-label, phase 2 study[J]. Lancet Oncol, 2013, 14(11): 1121–8. DOI:10.1016/S1470-2045(13)70384-X |
| [21] | Gligorov J, Ataseven B, Verrill M, et al. Safety and tolerability of subcutaneous trastuzumab for the adjuvant treatment of human epidermal growth factor receptor 2-positive early breast cancer: SafeHer phase Ⅲ study's primary analysis of 2573 patients[J]. Eur J Cancer, 2017, 82: 237–46. DOI:10.1016/j.ejca.2017.05.010 |
| [22] | Smith I, Procter M, Gelber RD, et al. 2-year follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer: a randomised controlled trial[J]. Lancet, 2007, 369(9555): 29–36. DOI:10.1016/S0140-6736(07)60028-2 |
 2018, Vol. 45
2018, Vol. 45