文章信息
- miR-130b调控RAB34的表达在胰腺癌发生发展中的作用
- Effect of miR-130b Targeting RAB34 Expression in Occurrence and Development of Pancreatic Cancer
- 肿瘤防治研究, 2018, 45(3): 144-147
- Cancer Research on Prevention and Treatment, 2018, 45(3): 144-147
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0960
- 收稿日期: 2017-08-07
- 修回日期: 2017-11-16
2. 430064 武汉,武汉市江汉区疾病预防控制中心检验科;
3. 430019 武汉,武汉市长江航务管理局疾病预防控制中心
2. Clinical Laboratory, Jianghan Center for Disease Prevention and Control in Wuhan, Wuhan 430064, China;
3. Disease Prevention and Control of Changjiang River Administration in Wuhan, Wuhan 430019, China
胰腺癌(pancreatic cancer, PC)是一种恶性程度极高的消化系统肿瘤,在全世界范围内每年死亡人数超过200 000例,预计到2030年将升至癌症致死率第二位,其5年生存率不到7%[1-2]。手术治疗是根治胰腺癌唯一方式,但大多数患者就诊时已处于中晚期,只能采用化疗或放疗延长生命[3]。Ras相关蛋白34(Ras-related proteins in brain 34, RAB34)是RAB家族的一员,该家族是涉及蛋白转运的小GTP酶[4]。研究发现RAB34与肿瘤的发生发展存在相关性[5-6],但在胰腺癌中尚无报道。本研究首次揭示RAB34和miR-130b在胰腺癌中的表达水平,并探讨miR-130b可能参与调控RAB34的表达。
1 资料与方法 1.1 研究对象及试剂2014年1月—2016年1月于华中科技大学同济医学院附属普爱医院、湖北省人民医院及湖北省肿瘤医院行手术治疗的初诊胰腺癌患者共22例(男:女=13:9),术后均经病理学诊断。收集胰腺癌组织及配对的距离肿瘤边缘5 cm以上的癌旁正常胰腺组织。患者平均年龄为(51.1±5.7)岁。所有患者均签署知情同意书。
RNA提取试剂盒和Lipofectamine 2000试剂盒由美国Invitrogen公司提供;TaqMan反转录试剂盒购自美国ABI公司;引物由Invitrogen公司合成;PANC-1、BxPC-3和HEK293细胞系均购自美国ATCC公司;Dual-Glo Luciferase Assay System购自美国Promega公司;兔抗人RAB34单克隆抗体购自美国Sigma公司;羊抗兔IgG抗体及β-actin购自武汉谷歌生物科技有限公司。
1.2 生物信息学检索在线访问GEO数据集,下载GSE28735数据,运用统计学分析RAB34 mRNA在胰腺癌及癌旁组织表达差异性;通过TargetScan和miRDB在线预测可能调控RAB34表达的miRNA。
1.3 RAB34及miR-130b mRNA表达检测遵照产品说明书采用TRIzol试剂提取组织总RNA,其后使用TaqMan反转录试剂盒进行RNA反转录。RAB34检测内参为β-actin;miR-130b检测内参为U6,运用2−ΔΔCt法分析(ΔΔCt=ΔCt胰腺癌组-ΔCt癌旁组)。
1.4 免疫组织化学技术检测RAB34表达石蜡切片使用二甲苯脱蜡后置于EDTA缓冲液中微波修复,冷却并用PBS洗后,置于冷却后PBS室温下避光孵育10 min;加入抗体稀释液稀释的一抗4℃过夜;PBS洗3次后滴加二抗室温孵育30 min,去除PBS液,每张切片加新鲜配制DAB显色液,显微镜掌握显色程度。蒸馏水冲洗终止显色,苏木精对比染色,酒精分化。切片梯度酒精依次浸泡,中性树胶封固。
1.5 Western blot检测RAB34表达RIPA裂解细胞后,提取组织总蛋白,使用BCA试剂盒检测蛋白浓度。采用SDS-PAGE分离蛋白,电转膜、封闭、洗膜后,稀释后兔抗人RAB34单克隆抗体4℃孵育过夜。洗膜后二抗室温摇床孵育1 h,曝光后检测。以β-actin为内参。
1.6 细胞转染将miR-130b mimic及阴性对照NC-miR转染胰腺癌PANC-1和BxPC-3细胞株,操作按照Lipofectamine 2000试剂盒产品说明书进行。转染后分为PANC-1 miR-130b mimic组、PANC-1 NC-miR组、BxPC-3 miR-130b mimic组及BxPC-3 NC-miR组。
1.7 转染及双荧光素酶报告基因根据miR-130b与RAB34的3’UTR区可能结合的位点,扩增并构建野生型RAB34 3’UTR片段3’UTR-WT,以及突变型RAB34 3’UTR片段3’RAB34-MUT。将上述两种片段克隆到psiCHECK-2 Vector载体上。复苏HEK293细胞,传代、接种于96孔板,按照Lipofectamine 2000说明书,将miR-130b/psiCHECK-2-RAB34 3’UTR-WT,miR-130b/psiCHECK-RAB34 3’UTR-MUT联合转染。转染48 h后根据Dual-Glo Luciferase Assay System试剂盒产品说明书操作,运用弱光检测仪检测荧光值。
1.8 统计学方法应用SPSS16.0统计软件分析。计量资料采用配对样本t检验;P < 0.05为差异有统计学意义。
2 结果 2.1 miR-130b与RAB34结合位点预测检索下载GSE28735数据库,通过统计学分析发现胰腺癌组织RAB34 mRNA表达明显高于配对的癌旁组织,见图 1A。通过TargetScan和miRDB在线预测,结果显示miR-130b可以与RAB34的3’UTR区结合。两者存在1个结合位点,即RAB34的3’UTR区第69~90位核苷酸位点,见图 1B,RAB34可能为miR-130b作用的靶基因。

|
| 图 1 miR-130b与RAB34结合位点预测(A)和RAB34 mRNA在胰腺癌及配对癌旁组织中的表达(B) Figure 1 Predicted target sites of miR-130b in 3'UTR of RAB34(A) and RAB34 mRNA level in pancreatic cancer (PC) tissues and adjacent tissues in dataset GSE28735(B) |
qRT-PCR结果显示,RAB34 mRNA在胰腺癌组织中高表达,而在癌旁组织中低表达,差异有统计学意义(P=1.07×10-4),见图 2A。针对miR-130b的检测发现,胰腺癌组织中miR-130b的表达显著低于癌旁组织(P=0.002),见图 2B。

|
| 图 2 RAB34及miRNA-130b mRNA在胰腺癌和癌旁组织中的表达 Figure 2 mRNA expression levels of RAB34 and miRNA-130b in 22 paired PC and adjacent tissues |
免疫组织化学结果显示RAB34在细胞核与细胞质中均表达,17例(77.3%)配对样本中,RAB34在胰腺癌组织中显著高表达,见图 3。

|
| 图 3 RAB34蛋白在胰腺癌(A)和癌旁组织(B)中的表达(IHC ×100) Figure 3 RAB34 protein expression in PC(A) and adjacent tissues(B) (IHC ×100) |
Western blot结果显示,22例配对组织中,18例(81.8%)胰腺癌组织中RAB34蛋白表达水平显著高于癌旁组织,差异有统计学意义(均P < 0.05),见图 4。
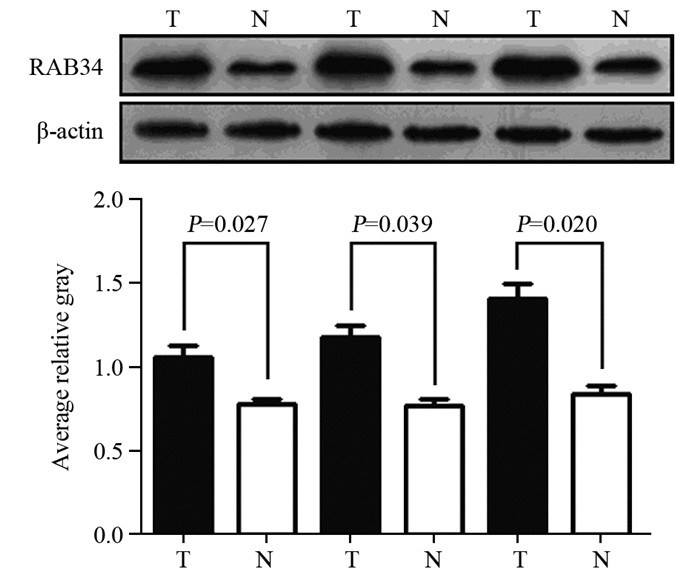
|
| 图 4 RAB34蛋白在胰腺癌和癌旁组织中的表达 Figure 4 Protein levels of RAB34 in PC and adjacent tissues |
结果提示,两种细胞miRNA-130b mimics组RAB34的表达显著降低(P=0.005, P=0.002),见图 5。
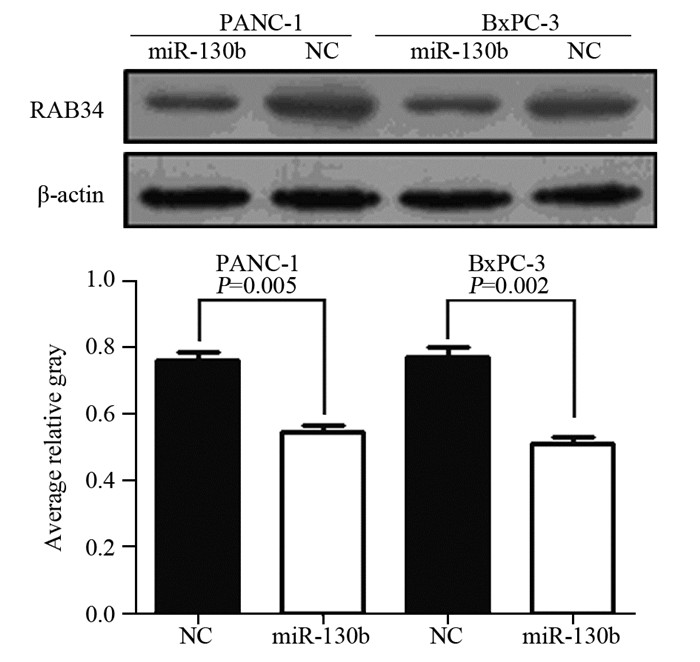
|
| 图 5 两种胰腺癌细胞系转染miR-130b后RAB34蛋白表达 Figure 5 Protein levels of RAB34 in PANC-1 and BxPC-3 cell lines transfected with miR-130b |
双荧光素酶报告基因检测结果提示,对比miR-130b/psiCHECK-RAB34 3’UTR-MUT组,共转染miR-130b/psiCHECK-2-RAB34 3’UTR-WT组细胞荧光素酶活性显著下降,两组差异有统计学意义(P=0.012),见图 6。说明miRNA-130b可以直接靶向RAB34 3’UTR而负向调节基因表达。

|
| 图 6 miRNA-130b对报告基因系统荧光素酶活性的影响 Figure 6 Effect of miR-130b on the luciferase activity of reporter gene system |
胰腺癌在消化道肿瘤中恶性程度最高,其发生发展的机制尚未阐明,越来越多的研究证实miRNA参与调控胰腺癌的发生发展。
RAB34是RAB家族的成员,是参与膜转运的重要调节蛋白[4]。Wang等[7]发现RAB34是Rab GTP酶家族的新成员,且可以通过Rab相关溶酶体蛋白(RILP)参与高尔基体调节溶酶体空间分布。Luo等[8]首次报道Rab34与肿瘤的关联,其研究显示RAB34在胃癌中显著高表达,且表达受miR-9调控。Wang等[5]揭示RAB34表达水平与神经胶质瘤分级密切相关,RAB34高表达提示肿瘤分级高、生存时间短、预后差,且MMP-11、HSPB1、IGFBP2、HSPA6、IGFBP5和MMP19表达可能受其调控。此外,Aakula等[6]报道RAB34在前列腺癌组织中显著高表达,并有潜在成为前列腺癌分子标志物的可能。
miR-130b被证实与胰腺癌、胃癌、结肠癌及肝癌等多种消化道恶性肿瘤的发生、发展及预后有关[9-12]。据报道miR-130b在胰腺癌、胃癌、结肠癌中的主要作用为抑制癌细胞的增殖、迁移和侵袭,且参与化疗药物的耐药性[9-11],而在肝癌中miR-130b高表达与肿瘤的进展及不良预后相关。Zhao等[9]研究显示,miR-130b在胰腺癌组织中显著低表达,且其低表达水平与瘤体大小、TNM分期、淋巴侵袭、远处转移及预后密切相关。因此提出miR-130b可能是胰腺癌诊断及治疗的标志物[9]。
本研究通过分析GEO数据集,免疫组织化学、Western blot、qRT-PCR技术证实RAB34在胰腺癌组织中高表达,通过生物信息学预测及双荧光素酶报告基因检测技术证实RAB34表达受miR-130b调控,据此提出RAB34和miR-130b可作为胰腺癌的分子标志物,且miR-130b调控RAB34表达可能与胰腺癌的发生有关。后续研究将阐明miR-130b调控RAB34表达与胰腺癌细胞的增殖、迁移、侵袭及耐药性的关联,此外应扩大样本量以揭示其与胰腺癌分期及预后的关系。
致谢
感谢湖北省人民医院陈浩主治医师、湖北省肿瘤医院高少阳检验技师对本课题组在病例收集方面提供的支持和帮助!
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [2] | 梁丁孔, 施思, 徐近, 等. 2016年胰腺癌研究及诊疗进展[J]. 中国癌症杂志, 2017, 27(4): 241–50. [ Liang DK, Shi S, Xu J, et al. Recent advances in basic research, clinical diagnosis and treatment of pancreatic cancer in 2016[J]. Zhongguo Ai Zheng Za Zhi, 2017, 27(4): 241–50. ] |
| [3] | Garrido-Laguna I, Hidalgo M. Pancreatic cancer: from state-of-the-art treatments to promising novel therapies[J]. Nat Rev Clin Oncol, 2015, 12(6): 319–34. DOI:10.1038/nrclinonc.2015.53 |
| [4] | Barr F, Lambright DG. Rab GEFs and GAPs[J]. Curr Opin Cell Biol, 2010, 22(4): 461–70. DOI:10.1016/j.ceb.2010.04.007 |
| [5] | Wang HJ, Gao Y, Chen L, et al. RAB34 was a progression-and prognosis-associated biomarker in gliomas[J]. Tumour Biol, 2015, 36(3): 1573–8. DOI:10.1007/s13277-014-2732-0 |
| [6] | Aakula A, Kohonen P, Leivonen SK, et al. Systematic identification of microRNAs that impact on proliferation of prostate cancer cells and display changed expression in tumor tissue[J]. Eur Urol, 2016, 69(6): 1120–8. DOI:10.1016/j.eururo.2015.09.019 |
| [7] | Wang T, Wong KK, Hong W. A unique region of RILP distinguishes it from its related proteins in its regulation of lysosomal morphology and interaction with Rab7 and Rab34[J]. Mol Biol Cell, 2004, 15(2): 815–26. |
| [8] | Luo H, Zhang H, Zhang Z, et al. Down-regulated miR-9 and miR-433 in human gastric carcinoma[J]. J Exp Clin Cancer Res, 2009, 28: 82. DOI:10.1186/1756-9966-28-82 |
| [9] | Zhao G, Zhang JG, Shi Y, et al. MiR-130b is a prognostic marker and inhibits cell proliferation and invasion in pancreatic cancer through targeting STAT3[J]. PLoS One, 2013, 8(9): e73803. DOI:10.1371/journal.pone.0073803 |
| [10] | Sun B, Li L, Ma W, et al. MiR-130b inhibits proliferation and induces apoptosis of gastric cancer cells via CYLD[J]. Tumour Biol, 2016, 37(6): 7981–7. DOI:10.1007/s13277-015-4632-3 |
| [11] | Zhao Y, Miao G, Li Y, et al. MicroRNA-130b suppresses migration and invasion of colorectal cancer cells through downregulation of integrin β1[J]. PLoS One, 2014, 9(2): e987938. |
| [12] | Tu K, Zheng X, Dou C, et al. MicroRNA-130b promotes cell aggressiveness by inhibiting peroxisome proliferator-activated receptor gamma in human hepatocellular carcinoma[J]. Int J Mol Sci, 2014, 15(11): 20486–99. DOI:10.3390/ijms151120486 |
 2018, Vol. 45
2018, Vol. 45


