文章信息
- 完全性淋巴结清扫对前哨淋巴结阳性黑色素瘤患者的预后价值Meta分析
- Prognostic Value of Completion Lymph Node Dissection on Melanoma Patients with Positive Sentinel Lymph Node Biopsy: A Meta-analysis
- 肿瘤防治研究, 2018, 45(5): 311-315
- Cancer Research on Prevention and Treatment, 2018, 45(5): 311-315
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0955
- 收稿日期: 2017-10-13
- 修回日期: 2018-01-09
尽管恶性黑色素瘤(malignant melanoma, MM)仅占皮肤恶性肿瘤的5%,但却有75%的皮肤恶性肿瘤患者死于该病[1]。伴有转移的MM患者2/3发生在区域淋巴结,另外1/3患者直接发展为远处转移,以至于过去选择性淋巴结清扫(elective lymph node dissection, ELND)这一术式及观念得以发展[2]。1992年,Morton等提出以前哨淋巴结活检(sentinel lymph node biopsy, SLNB)代替ELND[3],之后在那些已行SLNB确定淋巴结转移情况的患者中淋巴结清扫术被大大的限制。目前,SLNB对MM的预后价值已经被多项研究所证实[4];在MM的分期中亦被广泛应用;NCCN指南提示对于SLNB阳性患者建议行完全性淋巴结清扫(completion lymph node dissection, CLND)[5]。理论上,CLND在早期即可去除隐匿的区域淋巴结转移病灶从而改善预后,但在一项比较SLNB(阳性立刻行CLND或阴性行淋巴结观察)组与淋巴结观察组(不行SLNB及CLND)的患者预后情况的随机对照实验中,发现SLNB组在肿瘤特异性生存及无远处转移生存上无明显差异[4]。同时CLND能否改善SLNB阳性患者生存结果也存在争议[4, 6]。
本研究主要目的在于通过系统评价及Meta分析对已发表的相关文献及数据进行统计分析,以明确完全性淋巴结清扫对前哨淋巴结活检阳性的黑色素瘤患者的预后价值。
1 资料与方法 1.1 文献检索方法通过计算机对PubMed、Embase、Cochrane Library、中国知网(CNKI)和万方(Wanfang)数据库从建库到2017年6月30日的数据进行检索,并联合参考文献追查。英文检索词:Melanoma、(Lymph Node Dissection、Lymphadenectomy)、(Sentinel Node或Sentinel Lymph Node或Sentinel Lymph Node Biopsy)和(Positive或Metastasis),中文检索词:黑色素瘤、淋巴结清扫、前哨淋巴结活检、前哨淋巴结、阳性、转移。
1.2 文献选择标准纳入标准:(1)随机对照试验、队列研究等;(2)患者MM诊断明确,行SLNB且结果为阳性;(3)可以直接或间接获得预后结果风险比(hazard ratio,HR)及95%可信区间(confidence interval,CI)。排除标准:(1)病例报道、会议论文、动物实验或综述;(2)重复发表的数据;(3)无法获得有效数据的文献;(4)样本含量太低(≤10)的实验数据;(5)合并其他肿瘤的病例。
1.3 文献质量评价运用纽卡斯尔-渥太华量表(Newcastle Ottawa Scale, NOS)对纳入的队列研究进行评价,评价标准包括:研究人群选择(4个条目)、组间可比性(1个条目)和结果测量(3个条目),总计9个给分点。运用Cochrane风险偏倚评估工具对随机对照试验进行评价,主要包括:(1)选择偏倚:随机序列产生和分配隐藏;(2)实施偏倚:对研究者和受试者施盲;(3)测量偏倚:研究结果盲法评价;(4)随访偏倚:结果数据的完整性;(5)报告偏倚:选择性报告研究结果;(6)其他偏倚:其他偏倚来源。
1.4 数据提取分析通过Endnote X8对检索出的文献进行管理,两名研究者独立阅读文献题目、摘要和全文,根据纳入和排除标准进行文献筛选。将最后纳入的文献数据整合分析,见表 1。
肿瘤特异性生存率(melanoma-specific survival, MSS)、无复发生存率(recurrence-free survival, RFS)、无远处转移生存率(distant metastasis-free survival, DMFS)。
1.6 统计学方法采用RevMan5.0软件进行Meta分析,并进行异质性检验。若显示同质性较好(P > 0.05, I2 < 50%),采用固定效应模型分析,反之则采用随机效应模型分析(P≤0.05, I2≥50%)或亚组分析。如异质性仍较大,则进行描述性分析。提取各研究中生存结果的HR、CI,未直接给出数值者通过Engauge Digitizer 4.1对Kaplan-Meier生存曲线进行数据提取[7]。合并各研究风险比(HR)来表示生存分析的合并干预效应,漏斗图检验发表偏倚。
2 结果 2.1 文献检索结果及纳入文献基本特征共检索出1 644篇文献,通过纳入及排除标准的筛选(具体流程见图 1),最终共10篇文献被纳入:2篇随机对照试验,2篇前瞻性队列研究,6篇回顾性队列研究。队列研究NOS评分示文献质量可靠(评分均大于或等于6分);随机对照试验“Cochrane风险偏倚评估工具”评价均为低度偏倚风险。纳入本研究病例总数5 704例,其中3 822例行CLND,1 882例未行;主要来源于美国和欧洲;中位随访时间20~84月。纳入文献及各个研究的基本特征见表 1。
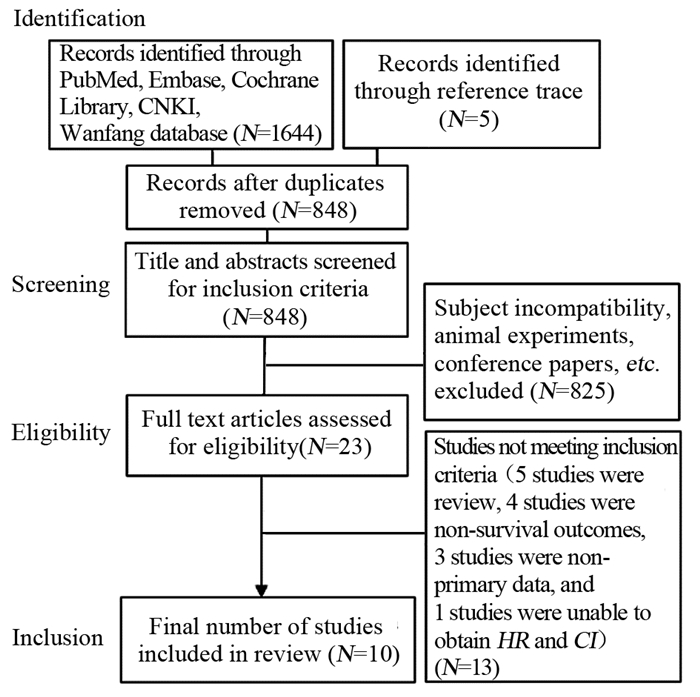
|
| 图 1 文献检索及筛选流程 Figure 1 Literature retrieval and screening process |
8篇文献描述了患者MSS情况,经异质性检验P=0.12, I2=39%,合并后HR: 0.99, 95%CI: 0.86~1.14,统计结果表明完全性淋巴结清扫(CLND)组与不行清扫的淋巴结观察(observation, OBS)组患者MSS差异无统计学意义(P=0.89),见图 2。结果虽然未发现明显的异质性,但是MM在不同人种之间尚存在一定差异,故将纳入文献按主要来源地区(美国和欧洲)行亚组分析。美国地区合并HR: 0.93, 95%CI: 0.60~1.44, P=0.75;欧洲地区合并HR: 0.96, 95%CI: 0.67~1.38, P=0.84。亚组分析后与总体结果仍一致,见图 3。
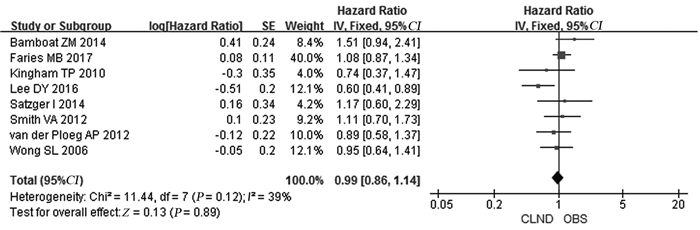
|
| 图 2 完全淋巴结清扫(CLND)与不行清扫的淋巴结观察(OBS)患者肿瘤特异性生存率(MSS)对比情况 Figure 2 Comparison of melanoma-specific survival between CLND and OBS group |
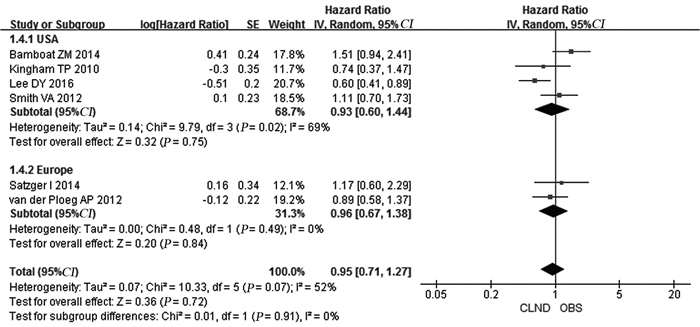
|
| 图 3 CLND与OBS患者MSS按地区分亚组对比情况 Figure 3 Comparison of melanoma-specific survival between CLND and OBS group by regional subgroup |
5篇文献描述了患者RFS情况,经异质性检验P=0.27, I2=22%,合并后HR: 0.89, 95%CI: 0.72~1.08,统计结果表明两组间患者RFS差异无明显统计学意义(P=0.24),见图 4。
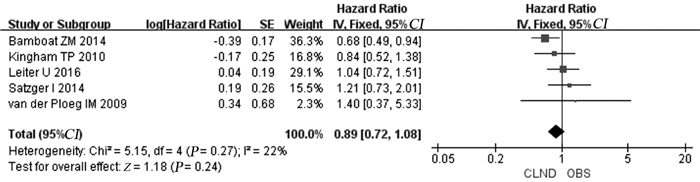
|
| 图 4 CLND与OBS患者RFS对比情况 Figure 4 Comparison of recurrence-free survival between CLND and OBS group |
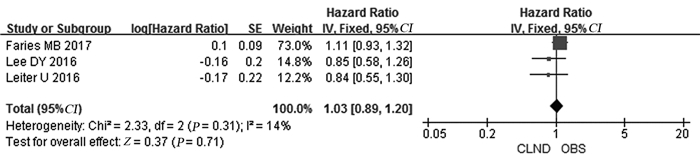
3篇文献描述了患者DMFS情况,经异质性检验P=0.31, I2=14%,合并后HR: 1.03, 95%CI: 0.89~1.20,统计结果表明两组间DMFS差异未见明显统计学意义(P=0.71),见图 5。
|
| 图 5 CLND与OBS患者DMFS对比情况 Figure 5 Comparison of distant metastasis-free survival between CLND and OBS groups |
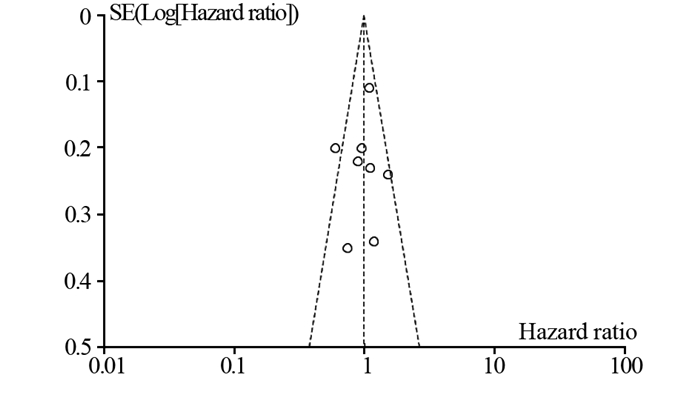
对肿瘤特异性生存率进行发表偏倚分析,图中8个点基本对称,经敏感度检测,图中在漏斗外的一点为Lee等[9]所得的阳性结果文献,其HR值在合并后95%CI之外,为异质性的主要来源,但并未影响最终结果。可见本研究纳入文献的发表偏倚较小,见图 6。
|
| 图 6 CLND与OBS患者MSS对比漏斗图 Figure 6 Funnel plots of melanoma-specific survival between CLND and OBS group |
早在上世纪90年代,Morton等[18]就开始推广SLNB用于MM患者的治疗,因前哨淋巴结(sentinel lymph node, SLN)是否转移是预估患者复发和生存的关键指标,故逐渐成为决定患者分期的诊疗标准。依据指南,CLND是SLNB阳性患者的标准治疗方式,但目前并无直接临床数据证明CLND可以为这些患者带来生存获益。CLND的理论基础是“孵化假说”(incubator hypothesis),该假说认为MM呈线性进展模式即原发灶产生免疫抑制因子且通过淋巴系统转移至SLN,进而诱导该淋巴结上恶性黑色素瘤表达,再经此SLN扩散至其他淋巴结,终致远处转移[19]。基于上述假说机制,CLND可通过清除转移区淋巴结即在局部达到完全控制,进而终止黑色素瘤线性进展[20]。但有大样本研究发现大多数SLNB阳性的MM患者转移病灶仅局限于SLN,在这些病例中SLNB已经清除了转移的淋巴结,CLND就不再必要[4, 20]。如此,CLND更有可能是使那些伴有非SLN转移的SLNB阳性患者获益,而这部分患者据之前文献报道仅占所有SLNB阳性患者的10%~25%[11, 21];此外CLND并发症(23.2%)发生率明显高于单纯SLNB(4.6%)[14-15, 20],包括严重的淋巴水肿、淋巴瘘、血清肿、切口延迟愈合等[13, 16];更有学者指出CLND组患者的生存质量较仅行SLNB组患者要差的多[16, 22],所以越来越多的学者开始质疑是否所有SLNB阳性的患者都需要行CLND[20]。
本研究通过严格的标准共纳入10篇质量较高的文献,通过Meta分析后未发现明显异质性及发表偏倚,结果提示:对于SLN阳性的MM患者,CLND并不能在肿瘤特异性生存、无复发生存和无远处转移生存有显著贡献。可能是因为大部分SLNB阳性患者均仅为SLN转移,而这部分人群是不能从CLND中获益的,从而使CLND的疗效被部分减弱[16]。Lee[9]和Bamboat[11]的研究分别在肿瘤特异性生存率和无复发生存率中得出有意义结果,可能与其研究样本量小和实验及对照组患者之间基线水平不一致相关。但值得注意的是,很多研究都指出CLND在区域淋巴结转移的控制和改善患者肿瘤分期上具有重要意义[9, 11, 13, 16]。
在多篇文献报道的非SLN转移的原发病灶中,都具有一些类似的临床病理特征:如原发灶溃疡、卫星病灶、嗜神经性、侵犯脉管等,这些患者就有必要行CLND并从中获益[16, 23-25]。这些特征可在临床实际工作中对该类患者的预判起到一定指导作用,但目前仍没有一个固定且信度高的指标,以至大多数SLNB阳性的患者常规行CLND。在MM患者中若阳性的SLN仅一个或者最大直经≤1mm称为SLN微转移,现有文献大多认为这类患者在治疗上考虑暂不行CLND,可密切随访观察[13, 16, 24]。因为多数研究发现在SLN微转移的MM患者中,存在非前哨淋巴结转移的仅在5%以下[14, 24],并有研究对这些患者是否行CLND的预后进行分析:Leiter等[13]进行的临床随机对照试验发现两组患者的无远处转移生存差异无统计学意义(HR: 1.09, 90%CI: 0.72~1.66);Satzger等[10]亦发现该类患者的总生存期(P=0.610)及无复发生存期(P=0.346)差异无统计学意义。
本研究仅纳入了已发表的文献,目前还有一项大型的临床随机对照试验(EORTC 1208 Minitub)正在进行中,所以本文可能存在发表偏倚。本研究纳入一些队列研究,且有些研究的对照组例数很小,可能会对结果产生一定的影响。本文仅作一阶段性的总结,具体的循证医学证据还需要进一步完善。
总之,对于前哨淋巴结活检阳性的黑色素瘤患者,完全性淋巴结清扫并不能带来生存获益,尤其是那些不伴有非前哨淋巴转移的患者。所以对于前哨淋巴结活检阳性的患者,要充分考虑其临床及病理特征,预判是否存在非前哨淋巴结转移,特别是转移的阳性前哨淋巴结仅为1个或者最大直径≤1 mm的患者,慎重决定是否行完全性淋巴结清扫。
| [1] | Santos-Juanes J, Fernandez-Vega I, Galache Osuna C, et al. Sentinel lymph node biopsy plus wide local excision vs. Wide location excision alone for primary cutaneous melanoma: A systematic review and meta-analysis[J]. J Eur Acad Dermatol Venereol, 2017, 31(2): 241–6. DOI:10.1111/jdv.2017.31.issue-2 |
| [2] | Tejera-Vaquerizo A, Nagore E. Effect of time to sentinel lymph node biopsy on cutaneous melanoma survival: A matter of discussion[J]. Am J Surg, 2017, 213(1): 204–5. DOI:10.1016/j.amjsurg.2016.06.014 |
| [3] | Morton DL, Cochran AJ. The case for lymphatic mapping and sentinel lymphadenectomy in the management of primary melanoma[J]. Br J Dermatol, 2004, 151(2): 308–19. DOI:10.1111/bjd.2004.151.issue-2 |
| [4] | Morton DL, Thompson JF, Cochran AJ, et al. Final trial report of sentinel-node biopsy versus nodal observation in melanoma[J]. N Engl J Med, 2014, 370(7): 599–609. DOI:10.1056/NEJMoa1310460 |
| [5] | National Comprehensive Cancer Network. (NCCN) Clinical practice guidelines in oncology. Melanoma. Version 1. 2017[EB/OL]. Http://www.Nccn.Org/professionals/physician_gls/f_guidelines.Asp. Accessed 10 November 2016. |
| [6] | Kyrgidis A, Tzellos T, Mocellin S, et al. Sentinel lymph node biopsy followed by lymph node dissection for localised primary cutaneous melanoma[J]. Cochrane Database Syst Rev, 2015(5): CD010307. |
| [7] | Tierney JF, Stewart LA, Ghersi D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J]. Trials, 2007, 8: 16. DOI:10.1186/1745-6215-8-16 |
| [8] | Smith VA, Cunningham JE, Lentsch EJ. Completion node dissection in patients with sentinel node-positive melanoma of the head and neck[J]. Otolaryngol Head Neck Surg, 2012, 146(4): 591–9. DOI:10.1177/0194599811432672 |
| [9] | Lee DY, Lau BJ, Huynh KT, et al. Impact of completion lymph node dissection on patients with positive sentinel lymph node biopsy in melanoma[J]. J Am Coll Surg, 2016, 223(1): 9–18. DOI:10.1016/j.jamcollsurg.2016.01.045 |
| [10] | Satzger I, Meier A, Zapf A, et al. Is there a therapeutic benefit of complete lymph node dissection in melanoma patients with low tumor burden in the sentinel node?[J]. Melanoma Res, 2014, 24(5): 454–61. DOI:10.1097/CMR.0000000000000081 |
| [11] | Bamboat ZM, Konstantinidis IT, Kuk D, et al. Observation after a positive sentinel lymph node biopsy in patients with melanoma[J]. Ann Surg Oncol, 2014, 21(9): 3117–23. DOI:10.1245/s10434-014-3758-7 |
| [12] | Wong SL, Morton DL, Thompson JF, et al. Melanoma patients with positive sentinel nodes who did not undergo completion lymphadenectomy: A multi-institutional study[J]. Ann Surg Oncol, 2006, 13(6): 809–16. DOI:10.1245/ASO.2006.03.058 |
| [13] | Leiter U, Stadler R, Mauch C, et al. Complete lymph node dissection versus no dissection in patients with sentinel lymph node biopsy positive melanoma (decog-slt): A multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2016, 17(6): 757–67. DOI:10.1016/S1470-2045(16)00141-8 |
| [14] | van der Ploeg AP, van Akkooi AC, Rutkowski P, et al. Prognosis in patients with sentinel node-positive melanoma without immediate completion lymph node dissection[J]. Br J Surg, 2012, 99(10): 1396–405. DOI:10.1002/bjs.v99.10 |
| [15] | Kingham TP, Panageas KS, Ariyan CE, et al. Outcome of patients with a positive sentinel lymph node who do not undergo completion lymphadenectomy[J]. Ann Surg Oncol, 2010, 17(2): 514–20. DOI:10.1245/s10434-009-0836-3 |
| [16] | Faries MB, Thompson JF, Cochran AJ, et al. Completion dissection or observation for sentinel-node metastasis in melanoma[J]. N Engl J Med, 2017, 376(23): 2211–22. DOI:10.1056/NEJMoa1613210 |
| [17] | van der Ploeg IM, Kroon BB, Antonini N, et al. Is completion lymph node dissection needed in case of minimal melanoma metastasis in the sentinel node?[J]. Ann Surg, 2009, 249(6): 1003–7. DOI:10.1097/SLA.0b013e3181a77eba |
| [18] | Morton DL, Wen DR, Wong JH, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma[J]. Arch Surg, 1992, 127(4): 392–9. DOI:10.1001/archsurg.1992.01420040034005 |
| [19] | Morton DL. Overview and update of the phase iii multicenter selective lymphadenectomy trials (mslt-i and mslt-ii) in melanoma[J]. Clin Exp Metastasis, 2012, 29(7): 699–706. DOI:10.1007/s10585-012-9503-3 |
| [20] | Link J. Completion lymph node dissection in patients with melanoma and positive sentinel lymph node biopsy[J]. JAAPA, 2017, 30(7): 31–4. |
| [21] | Sabel MS, Rice JD, Griffith KA, et al. Validation of statistical predictive models meant to select melanoma patients for sentinel lymph node biopsy[J]. Ann Surg Oncol, 2012, 19(1): 287–93. DOI:10.1245/s10434-011-1979-6 |
| [22] | Egger ME, Kimbrough CW, Stromberg AJ, et al. Melanoma patient-reported quality of life outcomes following sentinel lymph node biopsy, completion lymphadenectomy, and adjuvant interferon: Results from the sunbelt melanoma trial[J]. Ann Surg Oncol, 2016, 23(3): 1019–25. DOI:10.1245/s10434-015-5074-2 |
| [23] | Nagaraja V, Eslick GD. Is complete lymph node dissection after a positive sentinel lymph node biopsy for cutaneous melanoma always necessary? A meta-analysis[J]. Eur J Surg Oncol, 2013, 39(7): 669–80. DOI:10.1016/j.ejso.2013.02.022 |
| [24] | van der Ploeg AP, van Akkooi AC, Haydu LE, et al. The prognostic significance of sentinel node tumour burden in melanoma patients: An international, multicenter study of 1539 sentinel node-positive melanoma patients[J]. Eur J Cancer, 2014, 50(1): 111–20. DOI:10.1016/j.ejca.2013.08.023 |
| [25] | Egger ME, Bower MR, Czyszczon IA, et al. Comparison of sentinel lymph node micrometastatic tumor burden measurements in melanoma[J]. J Am Coll Surg, 2014, 218(4): 519–28. DOI:10.1016/j.jamcollsurg.2013.12.014 |
 2018, Vol. 45
2018, Vol. 45



