文章信息
- miR-155/PTEN调控轴在肝癌中的表达及其机制
- Expression of miR-155/PTEN Axis in Hepatocellular Carcinoma and Its Mechanism
- 肿瘤防治研究, 2018, 45(2): 67-72
- Cancer Research on Prevention and Treatment, 2018, 45(2): 67-72
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0931
- 收稿日期: 2017-08-03
- 修回日期: 2017-10-24
2. 430022 武汉,华中科技大学同济医学院附属同济医院胸外科
2. Department of Thoracic Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
肝癌是我国病死率最高的恶性肿瘤之一,我国每年约有38.3万人死于肝癌,占全球肝癌死亡病例数的51%[1]。虽然目前已有手术治疗、放化疗、介入治疗、靶向治疗、生物治疗、肝移植等多种治疗模式,但总体治疗效果不佳[2]。
MicroRNA(miRNA)是一种广泛存在于生物体内的非编码单链RNA,其通过与靶基因mRNA的3’非翻译区(3’-UTR)集合,降解或沉默靶基因mRNA,抑制靶基因的表达[3]。miR-155被证实在肝癌、肺癌、结肠癌、血液系统肿瘤中高表达,发挥促肿瘤作用[4-7]。我们前期研究发现,miR-155在ⅢA期肺腺癌中表达上调,与淋巴结转移相关,是预后的不利因素[5]。
PI3K/AKT通路异常激活是肿瘤常见的基因异常之一。PI3K通路激活与肿瘤的增殖、侵袭、转移密切相关[7]。第10号染色体缺失的磷酸酶及张力蛋白同源物基因(PTEN)通过负性调控PI3K通路发挥抗肿瘤作用[8]。本研究旨在明确miR-155在体内和体外对PTEN的调控作用,分析miR-155/PTEN调控轴对肝癌的促进作用。
1 资料与方法 1.1 临床资料收集深圳市人民医院2015年1月—2017年5月手术切除并经病理证实的肝细胞癌标本30例。切除肿瘤区域和癌旁组织标本(距病灶2 cm),置于液氮中快速冷冻,-80℃冰箱保存。收集患者一般信息,如性别、年龄、肿瘤大小、AFP水平等。所有患者术前未经放化疗。
1.2 细胞培养HL7702、Huh7、HepG2细胞株购于上海中科院细胞库,培养于含10%胎牛血清的RPMI 1640培养液中,置于5%CO2、37℃的恒温培养箱。细胞贴壁生长3~4天,待细胞长至80%~90%融合度时消化传代,使用对数生长期的细胞用于实验。
1.3 细胞转染使用Lipofectamine3000(Thermo公司,#L3000-015)进行转染。使用逆向转染法,将细胞悬液和转染混合液轻柔混匀,接种于细胞培养板中。miR-155 mimic(#miR10000646-1-5)和阴性对照(control, #miR01201-1-5)购于广州锐博公司。转染24 h后进行RNA检测,48 h后进行蛋白检测。
1.4 细胞增殖实验(CCK-8)使用逆向转染法,将细胞悬液和转染混合液轻柔混合,接种于96孔板中。每孔加入100 μl细胞悬液,种板密度为3 000~4 000个细胞每孔。24、48和72 h后按照CCK-8(日本同仁)说明书操作,450 nm波长测量吸光度OD值。
1.5 Transwell实验Transwell侵袭小室(Corning公司)上室加入无血清培养液转染48 h后的细胞制成的单细胞悬液,计数后按每室30 000个细胞每100 μl接种。下层小室内加入700 μl含10%胎牛血清的RPMI 1640培养液,培养24 h后吸去上室培养液,使用1×PBS洗3遍,每次5 min,再用4%多聚甲醛固定细胞20 min后,1×PBS洗3遍,每次5 min,使用0.1%结晶紫溶液染色15 min。倒置显微镜下采用10倍物镜观察,随机选取3个不同视野拍照。
1.6 Western blot实验提取转染后的细胞总蛋白,经BCA法进行蛋白定量,100℃ 5 min蛋白变性。10%SDS-聚丙烯酰胺凝胶电泳,每孔蛋白上样量40 μg,将分离的蛋白转移至PVDF膜,用溶解有5%脱脂奶粉的TBST摇床上常温封闭1 h,然后TBST洗涤3次,每次5 min,再加入一抗,4℃过夜。回收一抗,TBST洗涤3次,每次5 min,加入二抗(5%脱脂奶粉的TBST配置),室温孵育1 h,TBST摇床洗涤3次后,ECL法显色。anti-phospho-AKT(#4060),anti-β-Actin(#3700),anti-PTEN(#9188)购于Cell Signaling Technologies(Danvers, MA)公司。
1.7 RNA提取使用TRIzol法(武汉谷歌生物公司)提取总RNA,以A260/A280进行总RNA质控。按照TAKARA反转录试剂盒(宝生物工程有限公司,大连)说明书进行miRNA-155和U6反转录合成cDNA,放置-20℃冰箱保存备用。
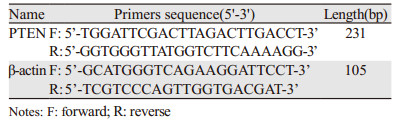
1.8 荧光实时定量PCR(quantitative Real-time PCR,qRT-PCR)使用ThermoFisher公司的Fast SYBR® Green Master Mix(#4385612)。冰上配制PCR反应液:SYBR 10 μl,PCR正向引物(20 μmol/L)0.4 μl,PCR反向引物(20 μmol/L)0.4 μl,具体引物序列见表 1。miR-155和U6引物直接由广州锐博公司提供。cDNA溶液1 μl,ddH2O 8.2 μl,总反应体系20 μl。第一阶段:95℃ 20 s灭活反转录酶及预变性,第二阶段:扩增过程95℃ 3 s、60℃ 30 s,40循环,第三阶段:融解曲线95℃ 15 s、60℃ 1 min、95℃ 15 s。定量PCR实验条件均以试剂盒说明书为参考,每个样本重复3次实验,miRNA-155和PTEN对应的单拷贝基因分别为U6和β-actin,计算公式为2-ΔΔCT。ΔΔCT=(CT实验组靶基因-CT实验组内参)-(CT对照组靶基因-CT对照组内参)。
应用cBioPortal for cancer genomics公共数据库(www.cbioportal.org)进行生存分析。选取癌症基因图谱实时更新数据(TCGA, Provisional)肝癌队列(n=442),11%的患者发生PTEN表达缺失,比较PTEN缺失组和其他表达正常患者的生存情况。筛选患者进行miR-155表达的生存分析。筛选标准如下:(1)亚裔人群;(2)乙型肝炎感染患者或无肝炎病毒感染;(3)术后病理诊断肝细胞癌;(4)既往无恶性肿瘤病史;(5)有miR-155表达数据。共筛选102例患者。根据患者的miR-155表达水平中位数,将其分为miR-155高表达组和miR-155表达组,进行Kaplan-Meier生存分析。
1.10 点突变质粒构建和双荧光素酶报告基因实验使用工具细胞HEK-293T细胞进行实验。实验步骤见文献[9]。使用PGL6质粒分别构建PTEN野生型(WT),PTEN突变型(Mutant)质粒,将miR-155 mimic与WT质粒/Mutant质粒,内参质粒共转染到细胞内。根据试剂说明书进行检测(#E1910, Promega, USA)。
1.11 统计学方法使用SPSS 19.0软件进行统计学分析,两组间差异的比较采用t检验;组间相关性采用Pearson检验;应用Kaplan-Meier法进行单因素生存分析,差异显著性检验采用对数秩检验(Log rank test);以P < 0.05为差异有统计学意义。
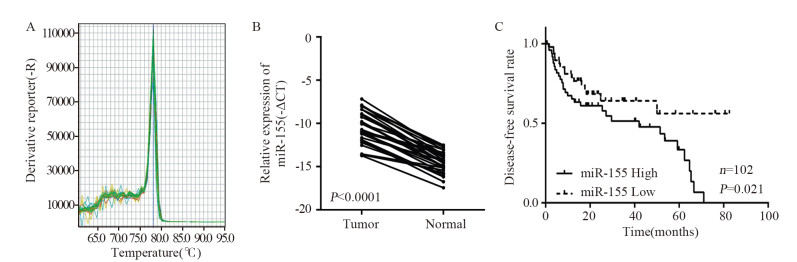
2 结果 2.1 miRNA-155在肝细胞癌和癌旁组织中的表达检测30例肝细胞癌患者癌与癌旁正常组织中miRNA-155相对于单拷贝基因U6的表达量,见图 1B。miR-155的表达与患者的临床病理特征见表 2。肝细胞癌组织中miRNA-155表达量显著高于配对癌旁组织,差异具有统计学意义(P < 0.0001)。TCGA数据库分析提示miR-155低表达的疾病无进展生存期(DFS)显著优于miR-155高表达组((54.353±5.70)月 vs. 36.687±4.11)月,P=0.021),见图 1C。
|
| A: miR-155 expression was detected by qRT-PCR; B: Expression of miR-155 in hepatocellular carcinoma and paired adjacent tissues; C: Kaplan-Meier plotter analysis of disease-free survival (DFS) based on the expression levels of miR-155 (TCGA, Provisional database) (54.353±5.70) months vs. (36.687±4.11) months, n=102, P=0.021) 图 1 miRNA-155在肝细胞癌和癌旁组织中的表达 Figure 1 Expression of miR-155 in hepatocellular carcinoma tissues and paired adjacent tissues |
|
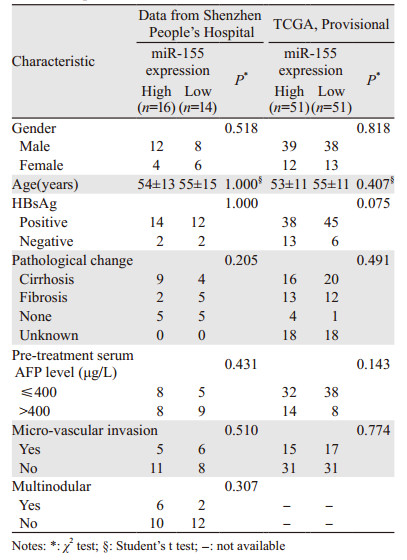
肝癌细胞HepG2和Huh7的miR-155表达水平显著高于人肝正常细胞HL-7702。Huh7细胞的miR-155表达水平偏低,故选择在Huh7细胞中高表达miR-155进行后续实验,见图 2A。细胞增殖实验提示,转染miR-155 mimic后72 h,Huh7细胞的增殖活性显著高于对照组,差异具有统计学意义(P < 0.0001),见图 2B。细胞迁移实验提示,miR-155 mimic转染24 h后,穿过Transwell小室的细胞数明显多于对照组,见图 2C。上述结果表明miR-155高表达促进Huh7的增殖和迁移。

|
| A: miR-155 levels in hepatocellular carcinoma cells and human normal liver cell line; B: miR-155 overexpression promoted the proliferation ability of Huh7 cells showed by CCK-8 assay; C: miR-155 overexpression promoted the migration ability of Huh7 cells showed by Transwell assay 图 2 miR-155促进肝癌细胞Huh7细胞的增殖和迁移 Figure 2 miR-155 promoted Huh7 cells proliferation and migration |
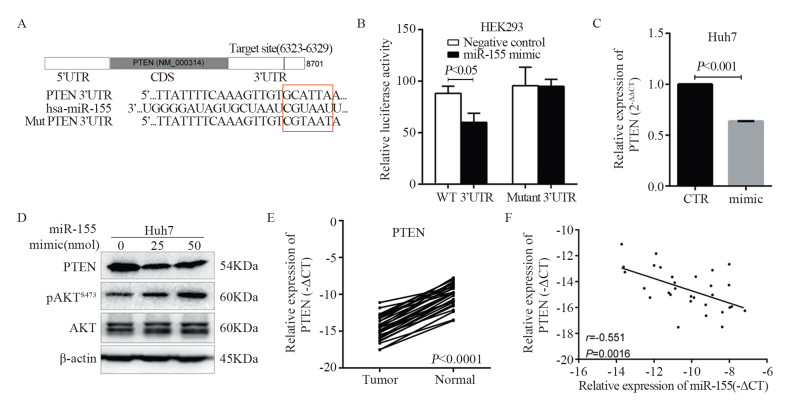
Targetscan、miRbase预测软件提示,PTEN基因的3’-UTR区有miR-155的结合位点,提示PTEN可能是miR-155的靶基因,见图 3A。使用双荧光素酶报告基因系统验证。将PTEN 3’-UTR区的野生型/突变型质粒与miR-155 mimic共转染到HEK-293T细胞内,比较两者荧光素酶活性的差异。野生型3’-UTR质粒组的荧光素酶活性显著降低,差异具有统计学意义(P < 0.05),见图 3B。RT-PCR和Western blot实验提示miR-155降低PTEN的mRNA和蛋白水平,见图 3C~D。PTEN是PI3K信号通路主要的抑制分子,PTEN的脂质磷酸酶活性抑制PI3K通路的激活,发挥抗肿瘤作用。因此,我们发现miR-155降低PTEN的蛋白水平,并且升高AKT的磷酸化水平。在肝癌组织中,PTEN mRNA表达水平较癌旁组织显著降低,并且与miR-155的表达水平呈负相关(r=-0.551, P=0.0016),见图 3E~F。综上所述,miR-155直接负性调控PTEN的表达。
|
| A: The putative miR-155 binding sequence in the 3’-UTR of PTEN mRNA; B: Suppressed luciferase activity of wild-type 3’-UTR of PTEN by miR-155; C: The expression of PTEN was inhibited by miR-155 at mRNA level; D: The expression of PTEN was inhibited by miR-155 at protein level; E, F: An negative correlation between PTEN mRNA and miR-155 expression in clinical specimens (Pearson’s correlation r=-0.551, P=0.0016) 图 3 miR-155负性调控PTEN的表达 Figure 3 Expression of PETN was suppressed by miR-155 expression |
为验证PTEN是否与miR-155在肝癌中的生物学作用相关,我们使用SiRNA技术下调PTEN的表达。SiRNA-PTEN显著降低PTEN的蛋白表达,并增强了AKT的磷酸化水平,见图 4A。细胞增殖实验和迁移实验表明PTEN下调增加Huh7的增殖活性和迁移能力,这与miR-155高表达的生物学作用相类似,见图 4B~C。
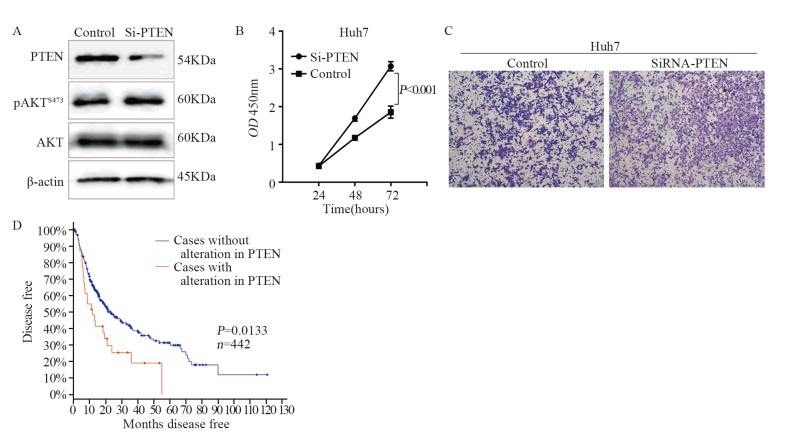
|
| A: PTEN siRNA efficiently inhibited the expression of PTEN; B: Downregulation of PTEN expression promoted the proliferation of Huh7 cells; C: Downregulation of PTEN expression promoted the migration of Huh7 cells; D: Kaplan-Meier Plotter analysis of disease-free survival (DFS) based on the expression levels of PTEN in 442 patients with hepatocellular carcinoma (TCGA, Provisional database). Patients with expression deletion of PETN showed better DFS than others (P=0.0133) 图 4 PTEN的表达下调促进肝癌细胞增殖和迁移能力 Figure 4 Downregulation of PTEN expression promoted proliferation and migration of Huh7 cells |
通过cBioPortal for cancer genomics公共数据库,分析442例肝癌患者的预后信息,其中原发性肝细胞癌431例,占97.51%。442例患者中11%的患者PTEN表达缺失,其疾病无进展生存期(DFS)较其他患者显著降低,差异具有统计学意义(P=0.0133),见图 4D。综上所述,PTEN是肝癌中重要的抑癌基因。
3 讨论本研究发现,相对于癌旁组织,miR-155在肝癌组织中表达上调。TCGA数据库提示miR-155高表达患者的DFS较低表达组显著降低。体外实验中,miR-155通过负性调控PTEN的表达进而促进其PI3K通路下游效应分子AKT的磷酸化,促进肝癌细胞的增殖、迁移。PTEN在肝癌组织中表达降低,并且与miR-155的表达水平呈负相关。在体外实验中,下调PTEN表达的生物学作用与高表达miR-155的作用相似。基于数据库的生存分析显示PTEN低表达的肝癌患者疾病无进展生存期显著低于对照组。Han等研究提示miR-155的高表达是肝移植术后肿瘤复发的危险因素[10]。综上所述,miR-155/PTEN调节通路在肝癌的发生发展中发挥重要作用。
30%的人体蛋白质编码基因受到miRNA调节[11]。miRNA通过调节多个靶基因广泛参与肿瘤的发生、发展、复发、转移等环节。我们的体内和体外研究结果提示miR-155是促进肝细胞癌发生发展的促癌miRNA。病毒性肝炎和非酒精性脂肪性肝硬化是原发性肝细胞癌最常见的病因[2]。Wang等通过胆碱缺乏和氨基酸限制的饮食(CDAA)诱导建立非酒精性脂肪型肝炎小鼠模型,并在饲养84周后成功诱导肝细胞癌发生。发现miR-155在肝炎发展至肝癌的各个阶段均表达升高。在肝癌细胞中,炎性反应激活NF-κB通路,并上调miR-155的表达,miR-155通过靶向C/EBPβ促进肝癌的进展[12]。Zhang等研究发现,体外转染肝炎病毒也会上调miR-155的表达水平。异常表达的miR-155通过激活Wnt信号通路发挥促肿瘤作用[13]。说明miR-155在炎性反应介导的肝癌发生发展中发挥作用。Li等研究发现,PTEN在Ⅰ型干扰素介导的抗病毒反应中发挥重要作用,并且不依赖于PI3K和AKT磷酸化水平[14]。本研究结果表明,肝癌组织中miR-155表达升高并且下调PTEN的表达。综上所述,慢性持续性炎性反应会促进肝癌发生,miR-155/PTEN是联系肝癌进展和机体炎性反应的重要环节。深入理解miR-155在炎性反应促进肿瘤中的机制,可能为肝癌的治疗提供新的方向。
单个miRNA可以通过调节多个靶基因发挥生物学作用。有研究证实miR-155可以负性调节SOCS-1[15]。IFN-γ/STAT1在炎性反应细胞成熟分化中发挥作用,SOCS-1是IFN-γ/STAT1通路最主要的负性调控蛋白[16]。在炎性反应细胞中,miR-155抑制SOCS-1表达,进而增强IFN-γ/STAT1通路信号,促进炎性反应。miR-155通过抑制Wnt通路抑制剂APC的表达,激活肝癌细胞中的Wnt信号,进而促进肝癌细胞增殖[13]。PTEN是PI3K信号通路关键的抑制分子,PI3K通路的激活是肿瘤细胞增殖关键步骤。本研究发现miR-155下调PTEN的表达,进而促进PI3K通路关键效应分子AKT的磷酸化。综合现有的报道和本实验结果,miR-155调节多个信号通路中的关键分子,是典型的多功能miRNA,在肿瘤发生发展中发挥网络性调节作用。
深入理解肝癌发生发展相关的miRNA,不仅能帮助寻找有用的生物标志物,进行肝癌的分子分型,实现肝癌的精准治疗,更有利于研究新的治疗手段。近年来,miRNA已从基础研究逐渐走向临床应用。已有miR-34的药物MXR34进入Ⅰ期临床试验[17]。但是,如何将miRNA治疗药物安全高效特异地转运靶点细胞,仍是亟待解决的难题[18]。如前所述,miR-155作为典型的多功能miRNA,其多样的生物学靶点和广泛的组织分布,是临床应用中的双刃剑。
本研究首次探讨了miR-155通过调控PTEN影响PI3K信号通路,进而促进肝癌的进展,这为肝癌的综合治疗提供了新的研究思路。研究团队正在继续完善miR-155对肝癌患者预后价值的队列研究及miR-155在动物体内的作用研究。
| [1] | 吕桂帅, 陈磊, 王红阳. 我国肝癌研究的现状与前景[J]. 生命科学, 2015, 27(3): 237–48. [ Lyu GS, Chen L, Wang HY. Research progress and prospect of liver cancer in China[J]. Sheng Ming Ke Xue, 2015, 27(3): 237–48. ] |
| [2] | Bruix J, Sherman M, Practice Guidelines Committee, et al. Management of hepatocellular carcinoma[J]. Hepatology, 2005, 42(5): 1208–36. DOI:10.1002/hep.v42:5 |
| [3] | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281–97. DOI:10.1016/S0092-8674(04)00045-5 |
| [4] | Huang X, Shen Y, Liu M, et al. Quantitative proteomics reveals that miR-155 regulates the PI3K-AKT pathway in diffuse large B-cell lymphoma[J]. Am J Pathol, 2012, 181(1): 26–33. DOI:10.1016/j.ajpath.2012.03.013 |
| [5] | Kong X, Liu F, Gao J. MiR-155 promotes epithelial-mesenchymal transition in hepatocellular carcinoma cells through the activation of PI3K/SGK3/β-catenin signaling pathways[J]. Oncotarget, 2016, 7(40): 66051–60. |
| [6] | 黄少军, 汪晶晶, 江华, 等. 结肠癌组织中miR-155表达在预测复发转移中的价值及其与血清CEA的相关性[J]. 肿瘤防治研究, 2014, 41(6): 606–9. [ Huang SJ, Wang JJ, Jiang H, et al. Value of miR-155 Expression in Forecast of Recurrence or Metastasis and Its Correlation with Serum CEA Levels after Operation[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(6): 606–9. ] |
| [7] | 高轶, 付圣灵, 江文洋, 等. pⅢ期非小细胞肺癌中miR-155的表达与预后关系的研究[J]. 中国肺癌杂志, 2014, 17(5): 417–23. [ Gao Y, Fu SL, Jiang WY, et al. A ssociation of miR-155 expression with prognosisin in resected stage Ⅲ Non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2014, 17(5): 417–23. DOI:10.3779/j.issn.1009-3419.2014.05.10 ] |
| [8] | Milella M, Falcone I, Conciatori F, et al. PTEN: Multiple Functions in Human Malignant Tumors[J]. Front Oncol, 2015, 5: 24. |
| [9] | Gao Y, Fan X, Li W, et al. miR-138-5p reverses gefitinib resistance in non-small cell lung cancer cells via negatively regulating G protein-coupled receptor 124[J]. Biochem Biophys Res Commun, 2014, 446(1): 179–86. DOI:10.1016/j.bbrc.2014.02.073 |
| [10] | Han ZB, Chen HY, Fan JW, et al. Up-regulation of microRNA-155 promotes cancer cell invasion and predicts poor survival of hepatocellular carcinoma following liver transplantation[J]. J Cancer Res Clin Oncol, 2012, 138(1): 153–61. DOI:10.1007/s00432-011-1076-z |
| [11] | Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?[J]. Nat Rev Genet, 2008, 9(2): 102–14. DOI:10.1038/nrg2290 |
| [12] | Wang B, Majumder S, Nuovo G, et al. Role of microRNA-155 at early stages of hepatocarcinogenesis induced by choline-deficient and amino acid-defined diet in C57BL/6 mice[J]. Hepatology, 2009, 50(4): 1152–61. DOI:10.1002/hep.23100 |
| [13] | Zhang Y, Wei W, Cheng N, et al. Hepatitis C virus-induced up-regulation of microRNA-155 promotes hepatocarcinogenesis by activating Wnt signaling[J]. Hepatology, 2012, 56(5): 1631–40. DOI:10.1002/hep.25849 |
| [14] | Li S, Zhu M, Pan R, et al. The tumor suppressor PTEN has a critical role in antiviral innate immunity[J]. Nat Immunol, 2016, 17(3): 241–9. |
| [15] | Vigorito E, Kohlhaas S, Lu D, et al. miR-155: an ancient regulator of the immune system[J]. Immunol Rev, 2013, 253(1): 146–57. DOI:10.1111/imr.2013.253.issue-1 |
| [16] | Platanias LC. Mechanisms of type-Ⅰ-and type-Ⅱ-interferon-mediated signalling[J]. Nat Rev Immunol, 2005, 5(5): 375–86. DOI:10.1038/nri1604 |
| [17] | Callegari E, Gramantieri L, Domenicali M, et al. MicroRNAs in liver cancer: a model for investigating pathogenesis and novel therapeutic approaches[J]. Cell Death Differ, 2015, 22(1): 46–57. DOI:10.1038/cdd.2014.136 |
| [18] | Cheng CJ, Bahal R, Babar IA, et al. MicroRNA silencing for cancer therapy targeted to the tumour microenvironment[J]. Nature, 2015, 518(7537): 107–10. DOI:10.1038/nature13905 |
 2018, Vol. 45
2018, Vol. 45