文章信息
- 常用血清肿瘤标志物在可手术肺癌患者预后中的价值
- Role of Serum Tumor Markers in Prognosis of Operable Non-small Cell Lung Cancer Patients
- 肿瘤防治研究, 2018, 45(1): 24-28
- Cancer Research on Prevention and Treatment, 2018, 45(1): 24-28
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0854
- 收稿日期: 2017-07-17
- 修回日期: 2017-09-05
肺癌是世界范围内发病率和死亡率第一位的恶性肿瘤,而由于早期肺癌缺乏特异性的症状,大多数的患者一经发现均已属晚期,生存期有限[1]。近年来,越来越多的血清肺癌相关肿瘤标志物进入我们的视野,对早期诊断肺癌、监测疗效、评价病程进展及预后都有非常重要的作用。但肺癌不像肝癌或前列腺癌有特异性的肿瘤标志物甲胎蛋白(AFP)或前列腺特异抗原(PSA)[2-3],肺癌缺乏特异性的标志物,目前临床上常用于肺癌患者检测的相关肿瘤标志物包括癌胚抗原(carcino-embryonic antigen, CEA)、糖抗原125(carbohydrate antigen 125, CA125)、糖抗原199(carbohydrate antigen 199, CA199)、神经元特异性烯醇化酶(neuron-specific enolase, NSE)、细胞角蛋白片段19(CYFRA21-1)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen, SCC-Ag)等[4-8]。目前各医院对肺癌患者术前开展的肿瘤标志物检验不尽相同,本研究旨在对这六项指标在可手术期肺癌患者中进行差异分析和生存分析,评价其在预测疾病严重程度和预后方面的临床应用价值,希望能够促进检验项目的规范化合理化应用。
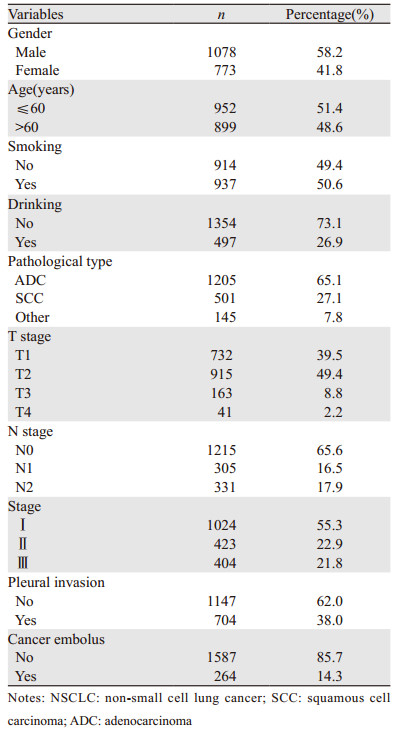
1 资料与方法 1.1 一般资料收集北京大学肿瘤医院胸外二科2005年1月至2014年12月间收治的1 851例患者的临床病理资料及随访信息,所有患者均接受了标准肺癌根治手术,病理确诊为非小细胞肺癌,患者的一般资料见表 1。其中男1 078例,女773例,年龄范围16~86岁,平均年龄(59.7±9.7)岁。按世界卫生组织(2015年)肺肿瘤组织学分类,其中腺癌1 205例,占65.1%;鳞癌501例,占27.1%;其他类型145例,占7.8%。根据国际肺癌研究协会(IASLC)第8版TNM分期,Ⅰ期1 024例,占55.3%;Ⅱ期423例,占22.9%;Ⅲ期404例,占21.8%。所有患者在初治前均行完整的肿瘤分期检查,如胸部CT、腹部颈部超声、全身骨扫描、脑MRI或CT,部分患者行全身PET/CT除外远处转移,患者在初治前1月内抽血检验常用肺相关肿瘤标志物,包括CEA、CA125、CA199、NSE、CYFRA21-1、SCC-Ag等。对所有患者在门诊或通过电话随访,中位随访时间51.6月,失访率1.51%(28/1851)。
患者在初治前空腹抽取全血,即时分离血清,采用酶联免疫吸附法进行瘤标的检验,全部检测工作由北京大学肿瘤医院检验科完成。CEA的正常参考范围为0~5.0 ng/ml,CA199为0~37.0 u/ml,CA125为0~35.0 u/ml,NSE为0~15.2 ng/ml,CYFRA21-1为0~3.3 ng/ml,SCC-Ag为0~1.5 ng/ml,超过正常参考范围则判定该肿瘤标志物阳性。
1.3 统计学方法应用SPSS23.0统计软件进行数据计算,采用Kaplan-Meier方法计算不同分组之间的生存率,比较差异时用Log rank检验;采用卡方检验比较不同分期下各肿瘤标志物阳性率的差异;采用多因素Cox回归比例风险模型分析肺癌患者的独立预后因素,P < 0.05为差异有统计学意义。
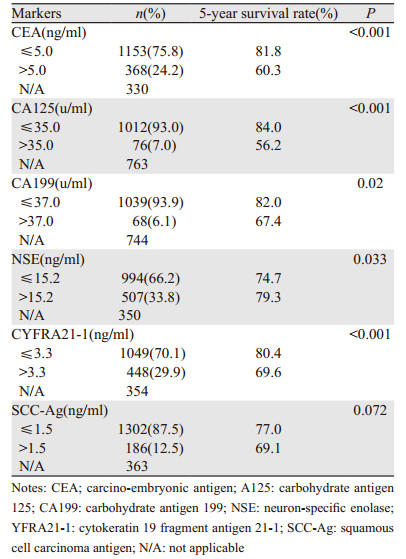
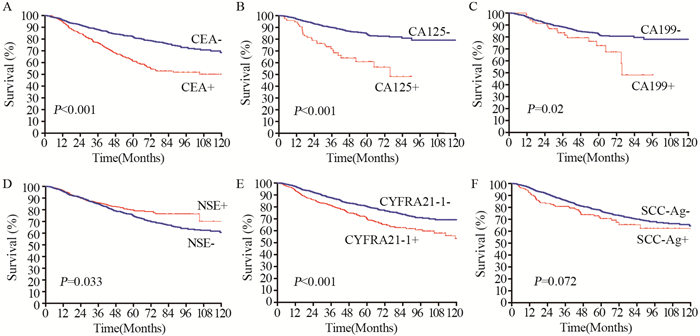
2 结果 2.1 六种肺癌相关肿瘤标志物对患者生存的影响全部1 851例患者资料中,CEA的阳性率24.2%(368/),CA125为7.0%(76/1 088),CA199为6.1%(68/1 107),NSE为33.8%(507/1 501),CYFRA21-1为29.9%(448/1 497),SCC-Ag为12.5%(186/1 488)。比较阳性组与阴性组患者的生存差异,发现CEA、CA125、CA199、CYFRA21-1的阴性组患者生存率显著高于阳性组患者(均P < 0.05);而NSE阴性组的远期生存率低于阳性组患者(P=0.033);SCC-Ag阳性组与阴性组患者的远期生存率差异无统计学意义(P=0.072),见表 2和图 1。
 |
|
| 图 1 六种肿瘤标志物对肺癌患者预后的影响 Figure 1 Effect of six tumor markers on survival of NSCLC patients |
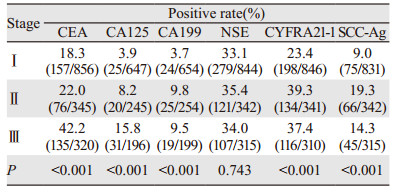
不同分期患者中的各个肿瘤标志物阳性率的差异采用卡方检验,结果显示CEA、CA125、CA199、CYFRA21-1和SCC-Ag在Ⅰ、Ⅱ、Ⅲ期患者中的阳性率存在明显差异,且Ⅱ和Ⅲ期的患者阳性率明显高于Ⅰ期患者(均P < 0.001);NSE在不同分期中的阳性率差异无统计学意义(P=0.743),见表 3和图 2。
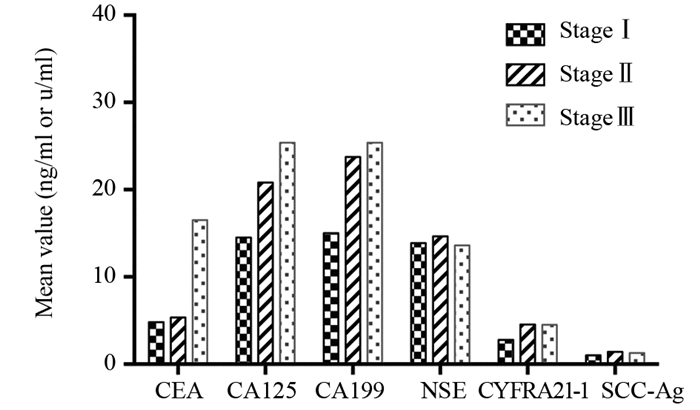
|
| 图 2 不同分期肺癌患者肿瘤标志物水平 Figure 2 Average level of tumor markers in different stages |
对患者的性别、年龄、吸烟史、饮酒史、病理类型、胸膜侵犯、脉管癌栓和CEA、CA125、CA199、NSE、CYFRA21-1、SCC-Ag进行Cox回归比例风险模型分析,发现年龄、吸烟、病理类型、CEA、CA125、CYFRA21-1、胸膜侵犯和脉管癌栓是独立预后因素,见表 4。
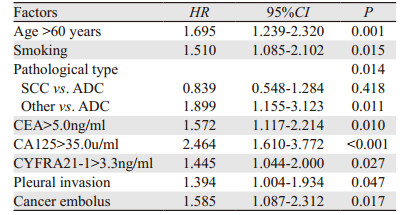 |
目前临床实践中,肿瘤标志物的检验常被作为肺癌诊断、疗效评估和预后判断的重要参考指标,常测的肺癌相关肿瘤标志物包括CEA、CA125、CA199、NSE、CYFRA21-1、SCC-Ag等六项。本研究对肺癌的临床病理资料和六项肿瘤标志物进行多因素生存分析,发现相关肿瘤标志物中仅CEA、CA125和CYFRA21-1是影响生存的独立预后因素。
CEA是一个广谱性的肿瘤标志物,最初发现于结肠癌和胎儿肠组织中,因此而得名。CEA升高常见于大肠癌、胰腺癌、胃癌、乳腺癌、甲状腺髓样癌等,但吸烟、妊娠期和心血管疾病、糖尿病、非特异性结肠炎等疾病也有部分患者血清CEA会升高,但升高水平要低于恶性肿瘤[9-10]。本研究中所有肺癌患者CEA的阳性率仅为24.2%,可见CEA诊断肺癌的特异性和敏感度均不高,但是我们发现随着肺癌分期的递进,CEA的水平呈现明显升高的趋势,Ⅲ期肺癌患者的CEA水平均值可高达16.5 ng/ml,另外CEA阳性患者的远期生存率明显低于CEA阴性患者。可见CEA能反映肺癌的病情发展,并且是预后估计的一个较好肿瘤标志物。
CA125是卵巢癌的特异性标志物[11],但近年来越来越多的研究发现肺癌患者的CA125水平也会升高,且与肿瘤负荷增加有关,肺癌患者体内的代谢产物不断地刺激组织细胞,引起细胞代谢旺盛,使CA125抗原物质大量释放入血液,尤其合并胸水的患者,CA125升高明显,是因为CA125可由胸水刺激胸膜的间皮细胞分泌[12-13]。本研究发现肺癌患者中CA125的阳性率仅为7.0%,但随着分期的递进,CA125水平也呈明显上升趋势,并且CA125阳性患者预后较差。
CA199也是糖抗原的一种,其水平增高多提示有胰腺炎、肝硬化、糖尿病或消化道肿瘤的可能[14],CA199在本研究对象中的阳性率为6.1%,是所有相关肿瘤标志物中阳性率最低的一个,随着肺癌分期的递进,其水平呈现上升趋势,其阳性患者的远期生存率要低于阴性患者,但多因素分析显示其并不是肺癌患者的独立预后因素。
在单因素的生存率分析中,CYFRA21-1阳性的患者生存率也明显低于阴性患者,而Ⅱ~Ⅲ期肺癌的阳性率和均值水平明显高于Ⅰ期患者,且多因素分析显示CYFRA21-1是肺癌的独立预后因素。SCC-Ag在单因素和多因素生存分析中,差异均无统计学意义,说明SCC-Ag可能并不是提示肺癌预后的一个良好指标。
近年来,很多患者因为检测到NSE升高,怀疑自己患了小细胞肺癌,造成不必要的焦虑。NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白,是神经内分泌肿瘤的特异性标志,70%的小细胞肺癌可能伴有NSE的升高[15]。本研究中所有患者均为非小细胞肺癌,NSE的阳性率为33.8%,可见NSE并不是小细胞肺癌所特有,但单因素的生存分析显示NSE阳性患者的生存率要好于阴性患者,而且随着肺癌分期的递进,并未观察到NSE的递进变化趋势,另外多因素生存分析显示NSE并不是影响非小细胞肺癌预后的独立因素。
此外,本研究进行Cox回归比例风险模型分析时,虽纳入了性别、年龄、吸烟史、饮酒史、病理类型、胸膜侵犯、脉管癌栓和CEA、CA125、CA199、NSE、CYFRA21-1、SCC-Ag等多个潜在阳性因素,但考虑到肿瘤标志物和分期之间存在内交互影响,并没有纳入T分期和N分期进行分析,尽管分期是公认的独立预后因素[16],但这并不影响我们分析肿瘤标志物对肺癌患者的预后判断。
本研究属于回顾性研究,时间跨度比较长,不可避免的存在一些缺陷,比如全部1 851例患者并不是每例患者都有完整的六项肿瘤标志物检测,六项资料全部完整的患者只有1 059例,占57.2%,另外本研究仅包含做了根治性手术的肺癌患者,并不包括部分不可手术的Ⅲ期和Ⅳ期患者,至于肿瘤标志物用于肺癌术后复发后再治疗和晚期肺癌的疗效监测应用价值,有待于进一步的研究探讨。可见,常用的肺癌肿瘤标志物CEA、CA125和CYFRA21-1在评价非小细胞肺癌手术预后方面有良好的应用价值,而CA199、NSE和SCC-Ag等指标价值有限,可不作参考。
致谢
本研究感谢索闻博识科技(北京)有限公司在数据库建设和数据分析方面给予的帮助!
| [1] | Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: proposals for revision of the tnm stage groupings in the forthcoming (eighth) edition of the tnm classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39–51. DOI:10.1016/j.jtho.2015.09.009 |
| [2] | Sauzay C, Petit A, Bourgeois AM, et al. Alpha-foetoprotein (AFP): A multi-purpose marker in hepatocellular carcinoma[J]. Clin Chim Acta, 2016, 463: 39–44. DOI:10.1016/j.cca.2016.10.006 |
| [3] | Tanase CP, Codrici E, Popescu ID, et al. Prostate cancer proteomics: Current trends and future perspectives for biomarker discovery[J]. Oncotarget, 2017, 8(11): 18497–512. |
| [4] | Grunnet M, Sorensen JB. Carcinoembryonic antigen (CEA) as tumor marker in lung cancer[J]. Lung Cancer, 2012, 76(2): 138–43. DOI:10.1016/j.lungcan.2011.11.012 |
| [5] | Zhou C, Chen Z, Dong J, et al. Combination of serum miRNAs with Cyfra21-1 for the diagnosis of non-small cell lung cancer[J]. Cancer Lett, 2015, 367(2): 138–46. DOI:10.1016/j.canlet.2015.07.015 |
| [6] | Li X, Zhang Q, Jin X, et al. Combining serum miRNAs, CEA, and CYFRA21-1 with imaging and clinical features to distinguish benign and malignant pulmonary nodules: a pilot study[J]. World J Surg Oncol, 2017, 15(1): 107. DOI:10.1186/s12957-017-1171-y |
| [7] | Liu L, Teng J, Zhang L, et al. The combination of the tumor markers suggests the histological diagnosis of lung cancer[J]. Biomed Res Int, 2017, 2017: 2013989. |
| [8] | Nakamura H, Nishimura T. History, molecular features, and clinical importance of conventional serum biomarkers in lung cancer[J]. Surg Today, 2017, 47(9): 1037–59. DOI:10.1007/s00595-017-1477-y |
| [9] | Hodge JW, Grosenbach DW, Aarts WM, et al. Vaccine therapy of established tumors in the absence of autoimmunity[J]. Clin Cancer Res, 2003, 9(5): 1837–49. |
| [10] | Turriziani M, Fantini M, Benvenuto M, et al. Carcinoembryonic antigen (CEA)-based cancer vaccines: recent patents and antitumor effects from experimental models to clinical trials[J]. Recent Pat Anticancer Drug Discov, 2012, 7(3): 265–96. DOI:10.2174/157489212801820020 |
| [11] | Bottoni P, Scatena R. The role of ca 125 as tumor marker: biochemical and clinical aspects[J]. Adv Exp Med Biol, 2015, 867: 229–44. DOI:10.1007/978-94-017-7215-0 |
| [12] | Lian S, Huang Y, Yang H, et al. Serum carbohydrate antigen 12-5 level enhances the prognostic value in primary adenosquamous carcinoma of the lung: a two-institutional experience[J]. Interact Cardiovasc Thorac Surg, 2016, 22(4): 419–24. DOI:10.1093/icvts/ivv369 |
| [13] | Li CS, Cheng BC, Ge W, et al. Clinical value of CYFRA21-1, NSE, CA15-3, CA19-9 and CA125 assay in the elderly patients with pleural effusions[J]. Int J Clin Pract, 2007, 61(3): 444–8. DOI:10.1111/ijcp.2007.61.issue-3 |
| [14] | Chen Y, Gao SG, Chen JM, et al. Serum CA242, CA199, CA125, CEA, and TSGF are Biomarkers for the Efficacy and Prognosis of Cryoablation in Pancreatic Cancer Patients[J]. Cell Biochem Biophys, 2015, 71(3): 1287–91. DOI:10.1007/s12013-014-0345-2 |
| [15] | Yu Z, Lu H, Si H, et al. A Highly efficient gene expression programming (gep) model for auxiliary diagnosis of small cell lung cancer[J]. PLoS One, 2015, 10(5): e0125517. DOI:10.1371/journal.pone.0125517 |
| [16] | Rami-Porta R, Bolejack V, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for the Revisions of the T Descriptors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2015, 10(7): 990–1003. DOI:10.1097/JTO.0000000000000559 |
 2018, Vol. 45
2018, Vol. 45