文章信息
- 剂量体积联合等效均匀剂量优化在鼻咽癌调强放疗危及器官优化中的应用
- Application of Dose-volume Combined with Equivalent Uniform Dose Optimization in Optimization of OAR in IMRT on Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2018, 45(3): 160-162
- Cancer Research on Prevention and Treatment, 2018, 45(3): 160-162
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0804
- 收稿日期: 2017-07-06
- 修回日期: 2017-10-24
调强放疗在肿瘤放射治疗中扮演着非常重要的角色,已广泛用于各种类型的肿瘤,相对于三维适形放疗,调强放疗能够使肿瘤靶区剂量更高更适形且剂量更加均匀,同时危及器官剂量更低,大大提高了患者的生存质量[1-7]。基于剂量体积(dose-volume, DV)的优化方法已经用于大部分放疗计划系统中,基于等效均匀剂量(equivalent uniform dose, EUD)优化方法也广泛用于各主流放疗计划系统中。DV优化通过修改剂量和体积的大小与权重参数对肿瘤和危及器官进行限制,EUD优化是通过修改等效均匀剂量大小、a值和权重参数对肿瘤和危及器官进行限制。已有多篇文献对不同危及器官独立DV优化与独立EUD优化进行了比较[8-10],本研究试图将DV优化与EUD优化联合起来并应用于鼻咽癌调强放疗危及器官的优化中。
1 资料与方法 1.1 资料随机选取西南医科大学附属医院肿瘤科放疗室接受鼻咽癌患者调强放疗计划55例,其中鼻咽癌调强放疗患者T2期23例、T3期22例、T4期10例,N0期9例、N1期14例、N2期16例、N3期10例、N4期6例。
1.2 等效均匀剂量(EUD)EUD用于评价某一解剖结构受到不均匀剂量照射的生物学效应。对于受到不均匀剂量照射的解剖结构,其产生的放射生物效应与某均匀剂量等效,该均匀剂量称为不均匀剂量分布解剖结构的等效均匀剂量(EUD),其可通过如下公式进行计算:
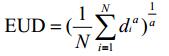 |
其中N为解剖结构计算点数目,di是第i个计算点的剂量,a是与解剖结构相关的EUD特性参数。当a=∞时,EUD等于该解剖结构的最大剂量;a=−∞时,EUD等于该解剖结构的最小剂量;当a=1时,EUD等于该解剖结构的算术平均剂量;当a=-1时,EUD等于该解剖结构的几何平均剂量。
1.3 鼻咽癌靶区勾画及处方剂量同一医师根据2010鼻咽癌调强放疗靶区及剂量设计指引专家共识[11]勾画肿瘤靶区(gross tumor volume, GTV):GTVnx,GTVrnp,GTVnd;临床靶区(clinical target volume, CTV):CTV1,CTV2;对上述对应各靶区在患者前后、左右、头脚方向上外扩3 mm作为计划靶区(planning target volume, PTV)。PGTVnx, PGTVrnp单次剂量2.10~2.25 Gy,总剂量66~76 Gy;PGTVnd单次剂量2.00~2.25 Gy,总剂量66~70 Gy;PCTV1单次剂量1.80~2.05 Gy,总剂量60~62 Gy;PCTV2单次剂量1.80 Gy,总剂量56 Gy。处方剂量评估要求:PTV接收≥110%处方剂量的体积 < 1%,PTV接受 < 93%的处方剂量的体积 < 1%。
1.4 危及器官限量单侧内耳平均剂量≤45 Gy,口腔平均剂量≤40 Gy,腮腺平均剂量 < 26 Gy,或对于腮腺与PCTV2相交体积过大的情况至少单侧D50% < 30 Gy或剂量尽量低,声门喉平均剂量≤45 Gy,环后区咽平均剂量≤45 Gy,食管平均剂量≤45 Gy。本研究选取以上六种危及器官进行研究,对于串行器官其优先权重甚至大于靶区,因此未纳入本研究中。所有入组患者均由同一医师对危及器官进行勾画。
1.5 调强放疗计划设计与优化所有调强治疗计划均采用Pinnacle 8.0(Pinnacle3, version 8.0m, Philips Medical Systems)治疗计划系统、6MV X线共面9野均分直接子野设计方法。优化方法分为以下两种:(1)常规DV优化法;(2)DV与EUD联合优化法。具体实施如下:常规DV优化完毕后,危及器官再继续加入MAX EUD(a=1)作为优化参数,不断调节优化目标剂量与权重对DV优化后的计划继续进行EUD再优化,整个优化过程中危及器官的DV优化参数不需要去除。其中方法一优化时间控制在3 h以内,方法二在方法一的基础上继续进行EUD优化的时间控制在1 h以内,两种优化方法均保证靶区处方剂量与危及器官限量符合评估要求。
1.6 统计学方法通过SPSS13软件中配对样本t检验的方法对上述两种优化方法的肿瘤靶区处方剂量、均匀性指数与适形度指数以及上述两种方法优化后的危及器官平均剂量差异性进行分析。
2 结果两种方法优化后肿瘤靶区处方剂量、均匀性指数、适形度指数以及脊髓、脑干、晶体、视神经、视交叉等串行器官最大剂量之间差异均无统计学意义(均P > 0.05);两种方法优化后六种危及器官平均剂量差异均有统计学意义,方法二得到的危及器官平均剂量低于方法一(均P < 0.001)。
假定δ = [Dmethod1–Dmethod2]/Dmethod2,Dmethod1为本研究中鼻咽癌患者调强计划通过方法一优化后危及器官平均剂量的均值,Dmethod2为本研究中鼻咽癌患者调强计划通过方法二优化后危及器官平均剂量的均值。δ取值见表 1,δ越大说明Dmethod1与Dmethod2差别越大。

|
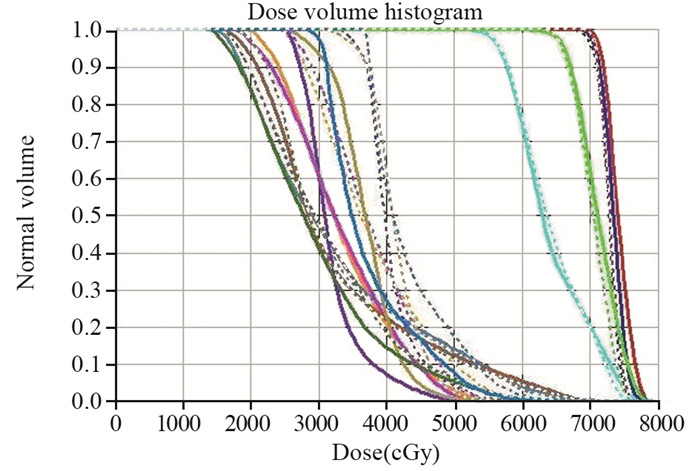
第15例鼻咽癌患者通过方法一与方法二优化后的肿瘤靶区与危及器官的DVH图,见图 1。
|
| The dotted line represented the DVH obtained using conventional DV optimization and the solid line represented the DVH obtained using DV and EUD combined optimization; skyblue was PCTV2, green was PCTV1, blue was PGTVnd, red was PGTVnx, pink was Right inner ear, orange was Left inner ear, forest green was oral cavity, brown was Right parotid, steelblue was Left parotid, slateblue was larynx, pale blue was postcricoid region of the hypopharynx, olive was esophagus 图 1 第15例鼻咽癌患者方法一与方法二优化后的肿瘤靶区与危及器官的DVH图 Figure 1 DVH graphs of target regions and OARs in 15th patient with nasopharyngeal carcinoma after conventional DV optimization and DV and EUD combined optimization |
使危及器官剂量尽量低是放疗的基本原则之一,本研究以鼻咽癌为例,将常规DV优化法与DV与EUD联合优化法得到的靶区处方剂量、均匀性指数与适形度指数以及上述两种方法优化后的六种危及器官平均剂量进行了比较,在两种方法的靶区处方剂量、均匀性指数与适形度指数以及脊髓、脑干、晶体、视神经、视交叉等串行器官最大剂量基本相同的情况下,方法二得到的六种危及器官平均剂量均小于方法一,说明DV与EUD联合优化法对于降低危及器官受量取得很好的效果,且方法二并不会增加太多的优化时间。从δ的值可以发现六种危及器官平均剂量方法二比方法一均有不同程度下降,其中声门喉下降的最多,说明对于调强放疗优化过程中,医生或物理师并不能只关注危及器官的统一验收标准,还应建立不同患者各危及器官受量验收的个体化标准,使在现有设备条件下不同患者各危及器官受量尽量低。
我们可加大样本量,通过不断调节危及器官的MAX EUD(a=1)的优化目标剂量与权重,使靶区满足评估条件前提下危及器官剂量尽量低并统计出不同危及器官δ的均值(δ),对于不同放疗中心或不同计划制作者得到的δ均值与Dmethod1或有不同。通过公式δ= [Dmethod1–Dmethod2]/ Dmethod2可以在已知的δ值与Dmethod1的前提下计算出Dmethod2,这样就可以在利用DV与EUD联合优化法制作调强计划前通过常规DV优化法的Dmethod1预测出Dmethod2,将其作为该危及器官MAX EUD(a=1)的优化目标剂量对调强计划进行优化,并作为调强计划该危及器官受量的验收标准,减少调强放疗计划中人为主观因素对危及器官受量的影响。该方法并不只局限于鼻咽癌调强优化,未来可采取多中心合作的方式,对不同病种放疗患者、具有EUD调强功能的不同计划系统以及不同的调强计划实施机器均可建立出适合患者个体化的危及器官受量验收标准。
| [1] | Sun X, Su S, Chen C, et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma: an analysis of survival and treatment toxicities[J]. Radiother Oncol, 2014, 110(3): 398–403. DOI:10.1016/j.radonc.2013.10.020 |
| [2] | Kiang A, Weinberg VK, Cheung KH, et al. Long-term disease-specific and cognitive quality of life after intensity-modulated radiation therapy: a cross-sectional survey of nasopharyngeal carcinoma survivors[J]. Radiat Oncol, 2016, 11(1): 127. DOI:10.1186/s13014-016-0704-9 |
| [3] | Bian X, Song T, Wu S. Outcomes of xerostomia-related quality of life for nasopharyngeal carcinoma treated by IMRT: based on the EORTC QLQ-C30 and H & N35 questionnaires[J]. Expert Review Anticancer Ther, 2015, 15(1): 109–19. DOI:10.1586/14737140.2015.961427 |
| [4] | Joseph K, Vos LJ, Warkentin H, et al. Patient reported quality of life after helical IMRT based concurrent chemoradiation of locally advanced anal cancer[J]. Radiother Oncol, 2016, 120(2): 228–33. DOI:10.1016/j.radonc.2016.06.020 |
| [5] | Wortel RC, Incrocci L, Pos FJ, et al. Acute toxicity after image-guided intensity modulated radiation therapy compared to 3D conformal radiation therapy in prostate cancer patients[J]. Int J Radiat Oncol Biol Phys, 2015, 91(4): 737–44. DOI:10.1016/j.ijrobp.2014.12.017 |
| [6] | McDonald MW, Liu Y, Moore MG, et al. Acute toxicity in comprehensive head and neck radiation for nasopharynx and paranasal sinus cancers: cohort comparison of 3D conformal proton therapy and intensity modulated radiation therapy[J]. Radiat Oncol, 2016, 11: 32. DOI:10.1186/s13014-016-0600-3 |
| [7] | Song T, Fang M, Zhang XB, et al. Sustained improvement of quality of life for nasopharyngeal carcinoma treated by intensity modulated radiation therapy in long-term survivors[J]. Int J Clin Exp Med, 2015, 8(4): 5658–66. |
| [8] | Senthilkumar K, Maria Das KJ, Balasubramanian K, et al. Estimation of the effects of normal tissue sparing using equivalent uniform dose-based optimization[J]. J Med Phys, 2016, 41(2): 123–8. DOI:10.4103/0971-6203.181631 |
| [9] | Mihailidis DN, Plants B, Farinash L, et al. Superiority of equivalent uniform dose (EUD)-based optimization for breast and chest wall[J]. Med Dosim, 2010, 35(1): 67–76. |
| [10] | Qi XS, Semenenko VA, Li XA. Improved critical structure sparing with biologically based IMRT optimization[J]. Med Phys, 2009, 36(5): 1790–9. DOI:10.1118/1.3116775 |
| [11] | 中国鼻咽癌临床分期工作委员会. 2010鼻咽癌调强放疗靶区及剂量设计指引专家共识[J]. 中华放射肿瘤学杂志, 2011, 20(4): 267–9. [ Working committee for the clinical stage nasopharyngeal carcinoma (NPC) in China. 2010 expert consensus of nasopharyngeal carcinoma IMRT target and dosage design[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2011, 20(4): 267–9. ] |
 2018, Vol. 45
2018, Vol. 45
