文章信息
- 胃腺癌组织中UCP2的表达及其对癌细胞生物学功能的影响
- Expression of UCP2 in Gastric Adenocarcinoma Tissues and Its Effect on Biological Function of Gastric Adenocarcinoma Cells
- 肿瘤防治研究, 2018, 45(4): 215-220
- Cancer Research on Prevention and Treatment, 2018, 45(4): 215-220
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0740
- 收稿日期: 2017-10-11
- 修回日期: 2017-12-25
胃癌是世界上第四大类常见的恶性肿瘤,并且一半以上的病例发生在东亚地区,虽然近年来发病率在不断下降,但是由于早诊率低,致死率仍居高不下[1-3]。因此寻找判断胃癌预后的标志物及其潜在靶点很有必要。UCP2(uncoupling protein-2)是线粒体解偶联蛋白家族的成员[4],能使氧化磷酸化的过程解偶联,减少ROS的生成,对肿瘤细胞有保护作用[5]。腺癌为胃癌最普遍的病理类型,本研究采用免疫组织化学法检测UCP2在胃腺癌及癌旁正常胃黏膜组织中的表达,分析其与胃腺癌的临床病理特征和预后的关系,并且在UCP2高表达的细胞株中沉默UCP2的表达,并检测其对胃腺癌细胞的增殖、迁移等生物学行为的影响。
1 资料与方法 1.1 组织标本与患者临床资料纳入自2008年1月1日至2009年1月1日于天津医科大学肿瘤医院行胃癌根治性切除术的新发胃腺癌患者,并于天津医科大学肿瘤医院肿瘤组织标本库获得经病理组织学确诊为胃腺癌的组织142例,及单纯随机抽样法取自癌切缘断端5 cm以远的癌旁正常胃黏膜组织25例。病理诊断根据世界卫生组织颁布的诊断标准,采用第7版国际抗癌联盟(Union for International Cancer Control, UICC)TNM分期标准。142例胃癌患者中,男101例,女41例;年龄24~82岁,中位年龄60岁;低分化癌104例,高中分化癌38例;侵及黏膜或黏膜下层12例,侵及肌层11例,侵及浆膜下层13例,侵及浆膜或浆膜外106例;TNM分期:Ⅰ期13例,Ⅱ期41例,Ⅲ期88例;淋巴结转移阳性97例,阴性45例。所有患者术前均未接受过放疗、化疗等治疗。通过电话、门诊等方式进行随访,随访截止时间为2015年3月25日。组织标本离体后均经10%中性福尔马林固定,石蜡包埋,并由天津医科大学肿瘤医院标本库妥善保存。
1.2 实验方法 1.2.1 细胞系和细胞培养胃腺癌细胞系SGC7901购自上海歌凡生物科技有限公司,培养于含10%胎牛血清(美国Gibco公司)、1%青链霉素(中国索莱宝公司)的DMEM培养液(美国Gibco公司)中,环境为37℃、5%CO2。细胞用0.05%胰蛋白酶(美国Gibco公司)进行消化传代。
1.2.2 细胞转染培养胃腺癌SGC7901细胞系,分为两组,分别转染UCP2 siRNA(sc-42682)及其阴性对照NC siRNA,UCP2 siRNA及其对照购自美国Santa Cruz公司,转染采用Lipofectamine 2000(美国Invitrogen公司)和Opti-MEM(美国Gibco公司)试剂。
1.2.3 蛋白提取和Western blot检测细胞转染48 h后,运用RIPA裂解法(中国索莱宝公司)提取蛋白,裂解液中加入蛋白酶抑制剂(PMSF,1:100)(中国索莱宝公司),收集蛋白。用NanoDrop 2000仪器(美国赛默飞世尔科技公司)进行蛋白定量。10%的SDS-PAGE垂直电泳分离,上样量为每孔50微克,转移蛋白至PVDF膜(美国密理博公司)上,用2%的BSA封闭后,1:200 UCP2鼠抗人单克隆抗体(sc-390189, 美国Santa Cruz公司)或1:500的β-actin鼠抗人单克隆抗体(sc-47778, 美国Santa Cruz公司)4℃过夜,加入l:2 000倍稀释的鼠二抗(美国Santa Cruz公司)室温孵育1 h,用ECL发光系统进行显影,β-actin为参照物。电泳及转膜相关仪器购自美国Bio-Rad公司。
1.2.4 EdU检测细胞增殖在24孔板接种细胞并转染UCP2 siRNA及NC siRNA,24 h后每孔加入50 μmol/ml的EdU试剂孵育5 h以解开DNA双链,用4%多聚甲醛固定后加入0.5% Triton-X清洗,加入Apollo试剂孵育30 min,细胞核用DAPI染色。实验至少重复3次,所有实验方法按照试剂盒(中国锐博公司)使用说明操作。结果判定:实验重复至少三次,分别统计正在增殖的细胞占总细胞的百分比,进行统计分析。
1.2.5 细胞迁移实验用划痕实验观察细胞的迁移能力,接种细胞至12孔板,转染UCP2 siRNA及NC siRNA,用20 μl的枪头在细胞中央画一条宽约1 mm的线,2%胎牛血清的DMEM培养液培养,在0、12、24、48 h拍照观察细胞的迁移能力,实验至少重复3次。
1.2.6 免疫组织化学实验将石蜡标本4 μm厚连续切片,采用免疫组织化学SP法检测胃癌组织中UCP2的表达。免疫组织化学试剂盒、DAB显色试剂盒均购自北京中杉金桥公司。对组织切片进行脱蜡、水化处理,用枸橼酸修复液高温高压进行抗原修复,封闭内源性过氧化物酶后,滴加一抗4℃孵育过夜,清洗后滴加鼠二抗,37℃孵育40 min,现配的DAB显色液显色,滴加苏木精染色液(中国索莱宝公司)染核,对切片进行脱水处理后树胶(中国索莱宝公司)封片。结果判定:UCP2蛋白主要分布在细胞质,呈棕黄色颗粒;在光学显微镜下观察全部视野,首先以阳性细胞百分率计分:阳性细胞占肿瘤细胞总数的百分率,0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为 > 75%;按染色强度记分:无显色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。以上均由两名有经验的临床病理医师采用双盲法阅片。染色强度与阳性细胞百分比的乘积 > 3分为免疫反应(+)[6]。
1.3 统计学方法采用SPSS19.0软件进行统计学分析。UCP2蛋白表达与胃腺癌临床病理参数间的相关性分析采用Pearson χ2检验;采用Kaplan-Meier法分析累积生存率;总体生存率预后的危险因素分析采用Cox风险回归模型评估,实验组和对照组之间的比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 UCP2在胃腺癌及癌旁正常胃黏膜组织中的表达在142例胃腺癌组织和25例癌旁正常胃黏膜组织的免疫组织化学结果显示,UCP2蛋白主要位于细胞质,见图 1,且在胃腺癌组织中,UCP2的表达明显高于癌旁正常胃黏膜组织(65.5%(93/142)vs. 36%(9/25),P=0.005)。
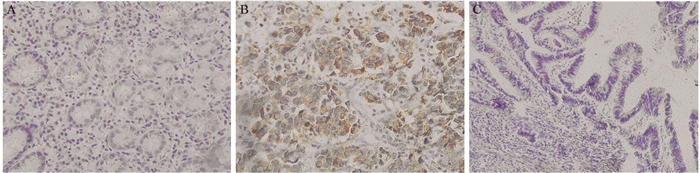
|
| A: negative expression of UCP2 in adjacent normal tissues; B: strongly positive expression of UCP2 in gastric cancer tissues; C: negative expression in gastric cancer tissues 图 1 UCP2在胃腺癌及癌旁正常胃黏膜组织中的表达情况(×400) Figure 1 Expression of UCP2 in gastric adenocarcinoma tissues and adjacent normal mucosa tissues (×400) |
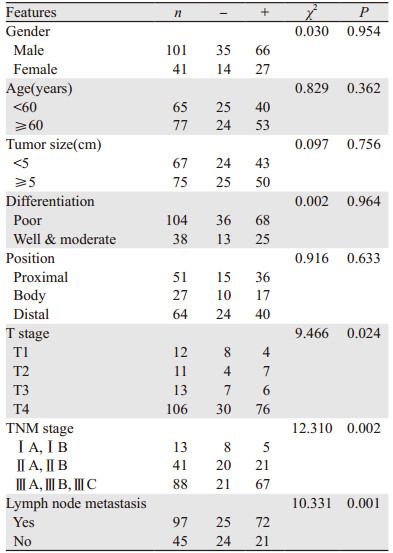
胃腺癌患者UCP2的蛋白表达与T分期、TNM分期及有无淋巴结转移有关,与患者的性别、年龄、肿瘤大小、肿瘤部位及分化状态无关(P=0.954, P=0.362, P=0.756, P=0.964, P=0.633)。侵及全层及浆膜外的胃腺癌组织中UCP2的蛋白表达明显高于侵及黏膜或肌层的胃腺癌组织(P=0.024);TNM分期中Ⅲ期患者的胃腺癌组织中UCP2的阳性表达率显著高于Ⅰ或Ⅱ期的胃腺癌组织(P=0.002);有淋巴结转移的胃腺癌组织UCP2阳性表达率明显高于无淋巴结转移的胃腺癌组织(P=0.001),见表 1。
|
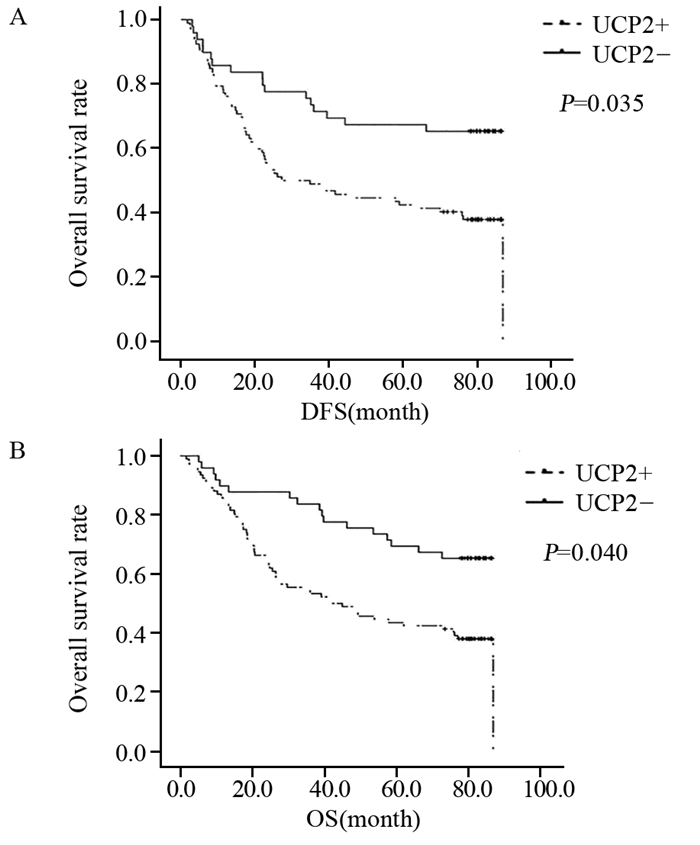
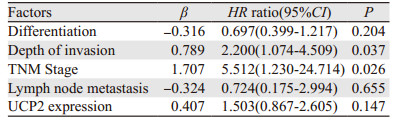
在142例胃腺癌组织中UCP2蛋白的表达与患者的OS(overall survival)和DFS(disease-free survival)差异有统计学意义。UCP2阳性患者和阴性患者中位DFS分别为27.1月和79.9月,差异有统计学意义(P=0.035),见图 2。而UCP2阳性患者中位OS为41.9月,阴性患者中位OS为79.9月,差异有统计学意义(P=0.040)。见表 2,单因素分析表明肿瘤分化程度、浸润深度、TNM分期、有无淋巴转移及UCP2的表达状态为预后影响因素。多因素分析表明,肿瘤浸润深度、TNM分期为独立预后因素,见表 3。
|
| 图 2 不同UCP2表达的胃癌患者的生存曲线 Figure 2 Survival curves of gastric adenocarcinoma patients with different UCP2 expressions |
|
|
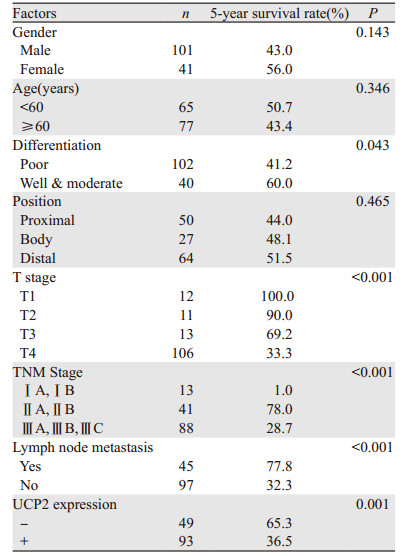
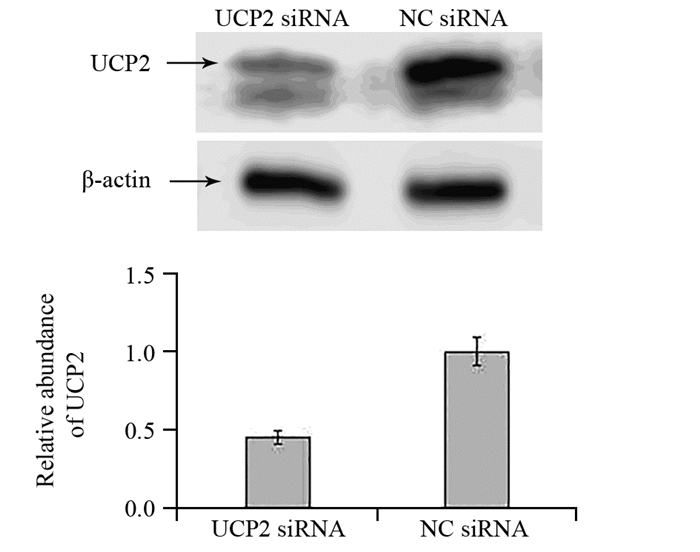
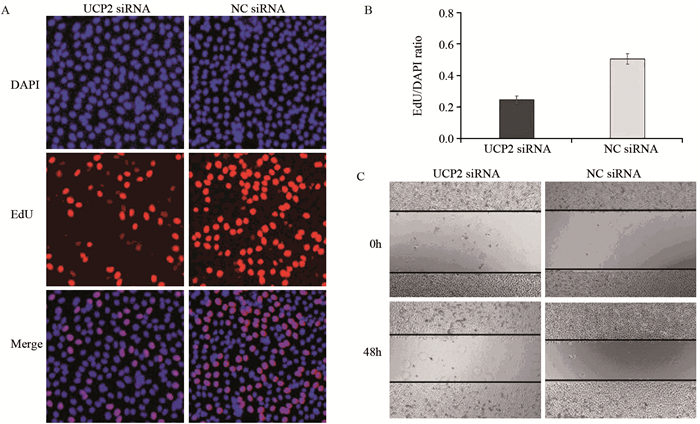
在胃腺癌SGC7901细胞系中,UCP2蛋白高表达,用UCP2 siRNA转染SGC7901细胞系能下调UCP2蛋白的表达(P=0.025),见图 3。通过EdU细胞增殖实验可知,下调UCP2蛋白表达后能显著抑制胃腺癌细胞的增殖能力(P=0.039),见图 4A、4B。转染UCP2 siRNA后也能抑制胃腺癌细胞的迁移能力,见图 4C。
|
| 图 3 转染UCP2 siRNA及NC siRNA后SGC7901细胞系中UCP2的蛋白表达情况 Figure 3 UCP2 expression in SGC7901 cell lines after UCP2 siRNA and NC siRNA transfection |
|
| A, B: EdU assay indicated that the silence of UCP2 inhibited the proliferation of SGC7901 cells; C: wound healing test revealed that the silence of UCP2 inhibited the migration of SGC7901 cells 图 4 沉默UCP2对胃腺癌SGC7901细胞的增殖和迁移的影响 Figure 4 Silence of UCP2 inhibited proliferation and migration of SGC7901 cell lines |
线粒体是真核细胞的主要能量来源,发生于线粒体中的氧化磷酸化是其产生能量的主要方式,产生于细胞内的烟酰胺腺嘌呤二核苷酸(NADH)及还原型二核苷酸(FADH2)所携带的高能电子通过线粒体呼吸链释放能量,并与ADP磷酸化生成ATP的过程相偶联,这种产能方式约占线粒体产生总能量的95%。然而,该电子传递链和ATP的生成并不能高效的偶联,主要是由于线粒体内膜上存在一种转运蛋白具有解偶联作用,称之为解偶联蛋白(UCPs)[7]。
UCP2为解偶联蛋白家族的一员,近年来发现它与肿瘤的发生有着密切的关系[8-9],氧化磷酸化过程的发生主要依靠位于线粒体内膜上的ATP合酶,而UCP2是一种跨线粒体内膜的阴离子转运体,它能介导质子通过旁路回流,而不是通过ATP合酶的途径回流,形成质子漏,使ATP的生成与氧化磷酸化过程解偶联,产生的能量没有用于合成ATP而是以热量的形式散失[10]。而UCP2介导的质子渗漏另一方面降低线粒体内膜电势,减少中间产物处于还原态的时间,减少超氧阴离子的产生,进而负性调控ROS的生成,减轻氧化应激,使肿瘤细胞对缺氧或化疗药物的耐受性增强,从而保护肿瘤细胞[11-13]。本研究通过免疫组织化学法检测发现,在胃腺癌组织中UCP2的阳性表达率为65.5%,而在癌旁正常胃黏膜组织阳性表达率为36%,差异有统计学意义。以往也有报道表明UCP2在头颈部肿瘤、胰腺、前列腺等肿瘤中均有高表达[9],Kuai等也发现UCP2在结肠癌组织中明显升高并且可能对肿瘤转移有促进作用[14-15],这都提示UCP2蛋白表达可能在肿瘤的进程中发挥了重要作用。另外我们发现UCP2蛋白阳性表达的患者通常肿瘤浸润深度更深,临床分期更晚,淋巴结转移阳性的可能性更大;并且,UCP2阳性的患者5年生存率更低,这都提示UCP2表达阳性可能是胃腺癌患者预后较差的危险因素。Pons等在乳腺癌中也发现UCP2的高表达往往与预后更差相关[16]。通过Cox多因素回归分析也发现UCP2阳性不是一个独立的预后因子,但是一个预后危险因素。Imai等发现对顺铂化疗耐药组宫颈癌患者的UCP2表达水平明显高于化疗敏感组,并且抑制肿瘤细胞的UCP2表达能提高其对顺铂的敏感度[17],说明UCP2可能介导肿瘤组织对化疗药物耐药性的产生,UCP2有望成为预测患者生存预后的重要标志物。
此外,我们通过在胃腺癌SGC7901细胞系中转染UCP2的siRNA以沉默UCP2蛋白表达的方法,发现癌细胞的增殖和迁移能力明显降低。这可能因为UCP2参与了肿瘤细胞的能量代谢,UCP2能抑制线粒体氧化磷酸化的过程,促进Warburg效应,使糖酵解反应产生的能量增多,从而促进肿瘤细胞的增殖和迁移[5, 18-19]。这都说明UCP2在肿瘤的发生发展中发挥了重要作用,从另一方面猜测抑制UCP2的表达可能会对提高肿瘤患者的生存预后有一定的作用,但这仍需要大规模多中心的临床试验进一步验证。
本研究着重于探索UCP2在胃腺癌组织中的表达与预后的关系,且从细胞水平研究了其对胃腺癌细胞生物学功能的影响,但是我们仍需要进一步扩大样本量探讨UCP2对胃癌的预后影响及进一步从分子机制上探索UCP2的靶基因或信号通路在肿瘤发生中的作用。
总之,UCP2在胃腺癌患者中表达增高,且与肿瘤的浸润深度、TNM分期及有无淋巴结转移等密切相关,其高表达预示着胃腺癌患者不良的预后,且在胃腺癌细胞中下调UCP2的表达能显著抑制其增殖和迁移的能力,表明针对UCP2的抑制剂有望成为胃癌治疗的新靶点。
| [1] | Rahman R, Asombang AW, Ibdah JA. Characteristics of gastric cancer in Asia[J]. World J Gastroenterol, 2014, 20(16): 4483–90. DOI:10.3748/wjg.v20.i16.4483 |
| [2] | Greenlee RT, Murray T, Bolden S, et al. Cancer statistics, 2000[J]. CA Cancer J Clin, 2000, 50(1): 7–33. DOI:10.3322/canjclin.50.1.7 |
| [3] | Ferro A, Peleteiro B, Malvezzi M, et al. Worldwide trends in gastric cancer mortality (1980-2011), with predictions to 2015, and incidence by subtype[J]. Eur J Cancer, 2014, 50(7): 1330–44. DOI:10.1016/j.ejca.2014.01.029 |
| [4] | Donadelli M, Dando I, Fiorini C, et al. UCP2, a mitochondrial protein regulated at multiple levels[J]. Cell Mol Life Sci, 2014, 71(7): 1171–90. DOI:10.1007/s00018-013-1407-0 |
| [5] | Pitt MA. Overexpression of uncoupling protein-2 in cancer: metabolic and heat changes, inhibition and effects on drug resistance[J]. Inflammopharmacology, 2015, 23(6): 365–9. DOI:10.1007/s10787-015-0250-3 |
| [6] | 许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996, 6(4): 229–31. [ Xu LZ, Yang WT. The standard of the results of immunochemistry[J]. Zhongguo Ai Zheng Za Zhi, 1996, 6(4): 229–31. ] |
| [7] | Vyas S, Zaganjor E, Haigis MC. Mitochondria and Cancer[J]. Cell, 2016, 166(3): 555–66. DOI:10.1016/j.cell.2016.07.002 |
| [8] | Robbins D, Zhao Y. New aspects of mitochondrial Uncoupling Proteins (UCPs) and their roles in tumorigenesis[J]. Int J Mol Sci, 2011, 12(8): 5285–93. DOI:10.3390/ijms12085285 |
| [9] | Li W, Nichols K, Nathan CA, et al. Mitochondrial uncoupling protein 2 is up-regulated in human head and neck, skin, pancreatic, and prostate tumors[J]. Cancer Biomark, 2013, 13(5): 377–83. DOI:10.3233/CBM-130369 |
| [10] | Hoshovs'ka Iu V. The role of uncoupling proteins in mechanisms of protection from oxidative stress[J]. Fiziol Zh, 2015, 61(1): 91–101. DOI:10.15407/fz |
| [11] | Boss O, Hagen T, Lowell BB. Uncoupling proteins 2 and 3: potential regulators of mitochondrial energy metabolism[J]. Diabetes, 2000, 49(2): 143–56. DOI:10.2337/diabetes.49.2.143 |
| [12] | Toda C, Diano S. Mitochondrial UCP2 in the central regulation of metabolism[J]. Best Pract Res Clin Endocrinol Metab, 2014, 28(5): 757–64. DOI:10.1016/j.beem.2014.02.006 |
| [13] | Derdak Z, Mark NM, Beldi G, et al. The mitochondrial uncoupling protein-2 promotes chemoresistance in cancer cells[J]. Cancer Res, 2008, 68(8): 2813–9. DOI:10.1158/0008-5472.CAN-08-0053 |
| [14] | Kuai XY, Ji ZY, Zhang HJ. Mitochondrial uncoupling protein 2 expression in colon cancer and its clinical significance[J]. World J Gastroenterol, 2010, 16(45): 5773–8. DOI:10.3748/wjg.v16.i45.5773 |
| [15] | Donadelli M, Dando I, Dalla Pozza E, et al. Mitochondrial uncoupling protein 2 and pancreatic cancer: a new potential target therapy[J]. World J Gastroenterol, 2015, 21(11): 3232–8. DOI:10.3748/wjg.v21.i11.3232 |
| [16] | Pons DG, Nadal-Serrano M, Torrens-Mas M, et al. UCP2 inhibition sensitizes breast cancer cells to therapeutic agents by increasing oxidative stress[J]. Free Radic Biol Med, 2015, 86: 67–77. DOI:10.1016/j.freeradbiomed.2015.04.032 |
| [17] | Imai K, Fukuda T, Wada T, et al. UCP2 expression may represent a predictive marker of neoadjuvant chemotherapy effectiveness for locally advanced uterine cervical cancer[J]. Oncol Lett, 2017, 14(1): 951–7. DOI:10.3892/ol.2017.6212 |
| [18] | Baffy G. Uncoupling protein-2 and cancer[J]. Mitochondrion, 2010, 10(3): 243–52. DOI:10.1016/j.mito.2009.12.143 |
| [19] | Otto AM. Warburg effect(s)-a biographical sketch of Otto Warburg and his impacts on tumor metabolism[J]. Cancer Metab, 2016, 4: 5. DOI:10.1186/s40170-016-0145-9 |
 2018, Vol. 45
2018, Vol. 45


