文章信息
- 不同时机营养干预在化疗后Ⅳ度骨髓抑制肿瘤患者中的疗效比较
- Comparison of Different Time Nutritional Intervention on Chemotherapy-induced Ⅳ Degree Myelosuppression in Cancer Patients
- 肿瘤防治研究, 2018, 45(1): 29-31
- Cancer Research on Prevention and Treatment, 2018, 45(1): 29-31
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0715
- 收稿日期: 2017-06-21
- 修回日期: 2017-08-29
2. 100853 北京,解放军总医院国宾一科
2. Department of Special Ward, Chinese PLA General Hospital, Beijing 100853, China
近年来,对于化疗后Ⅳ度骨髓抑制的临床治疗策略,随着粒细胞集落刺激因子(G-CSF)等生物制剂的应用,对于预防及改善化疗后骨髓抑制的发生起到了积极的作用,但随着化疗周期的增加及联合给药方案的实施等,化疗后Ⅳ度骨髓抑制的发生率仍较高,往往成为临床工作棘手的问题之一,值得深入研究、探讨其预防及治疗策略。早期已有研究证实[1-2],对于肿瘤患者,营养支持治疗作为肿瘤综合治疗一部分,能够明显改善患者生活质量评分等,那么早期营养支持能否改善化疗后Ⅳ度骨髓抑制肿瘤患者预后等,尚未见报道,本研究正是基于此出发点,探讨并比较不同时机营养治疗在化疗后Ⅳ度骨髓抑制肿瘤患者中的优劣性,从而优化临床诊治策略。
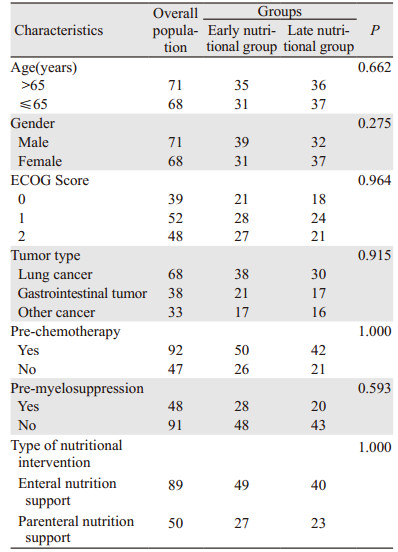
1 资料与方法 1.1 临床资料及入组标准 1.1.1 临床资料及分组回顾分析解放军总医院2010年8月至2017年2月化疗后Ⅳ度骨髓抑制的186例实体肿瘤患者,经筛选选取给予营养干预治疗患者,共139例,其中男71例,女68例,平均年龄(58.2±7.5)岁,患者基线特征见表 1。
所纳入患者其肿瘤的诊断符合2017年NCCN相关诊断标准。纳入标准:实体肿瘤诊断符合病理学诊断;化疗后Ⅳ度骨髓抑制;给予营养支持治疗(肠内/肠外营养);年龄 > 18岁;化疗前患者PS评分0~1;排除标准:确诊化疗后Ⅳ度骨髓抑制未给予营养支持治疗;放化疗同步治疗;肿瘤侵犯骨髓所致白细胞或血小板低下;合并骨髓增生异常综合征(MDS)等血液病。
1.2 研究方法营养支持方案实施,热卡:视应激程度一般每天25~35 kcal/kg;若患者化疗后胃肠道有一定功能即采用肠内营养,根据个体化能量需求目标值,给予补充性口服肠内营养剂为主,部分患者或联合肠外营养;若患者化疗后合并严重呕吐、腹泻、黏膜炎等部分或完全性肠功能障碍,或其他情况无法实现肠内营养支持者,给予肠外营养支持(含卡文、个体化营养配方三升袋等);具体实施方案,根据个体化临床病情、肠功能评估等综合考虑;肿瘤患者化疗后,常规出院随访按照每3日左右复查一次血常规等,或出现发热等复查血常规等,当复查血常规,出现Ⅳ度骨髓抑制,中性粒细胞数降至500/mm3(白细胞计数1 000/mm3)以下者,给予重组人粒细胞刺激因子注射液治疗,剂量按照2~5 μg/kg,每日一次皮下给药,当中性粒细胞数回升至5 000/mm3(白细胞计数10 000/mm3)以上时,停止给药。同时给予房间紫外线消毒、呋喃西林漱口、莫西沙星等预防性抗感染等支持治疗;对于出现发热者,给予三代头孢或碳青霉烯类等抗生素或根据药物结果应用抗生素。出现血小板低于25×109/L以下者,给予重组人血小板生成素治疗,每日1.5万单位,每日一次,用药过程中待血小板计数恢复至100×109/L以上,或血小板计数绝对值升高≥50×109/L时应停用,对于伴有黏膜出血或出血倾向者,给予输注血小板治疗。指标监测,每日复查血常规,当白细胞、血小板等出现上升时,可每3日复查一次或根据临床情况而定。
将确诊Ⅳ度骨髓抑制72 h内给予营养支持治疗组设定为积极营养干预组(76例);对于确诊Ⅳ度骨髓抑制超过72 h后给予营养支持的患者设定为晚期营养干预组(63例);回顾性分析,探讨不同营养干预时机在粒细胞上升时间,合并细菌、真菌感染的比例、住院时间、死亡率等的差异。
感染并发症监测:主要指肺部感染;肺部感染判定:结合肺部听诊、胸片、痰培养、血培养等可临床诊断或病原学诊断。且判定结果须由两名副主任医师以上职称医生同时认定。
1.3 统计学方法使用SPSS13.0统计软件处理。计数资料分析用χ2检验。计量资料用均数±标准差(x± s)表示,计量资料先行方差齐性检验,再行t检验,计数资料采用卡方检验;P < 0.05为差异有统计学意义。
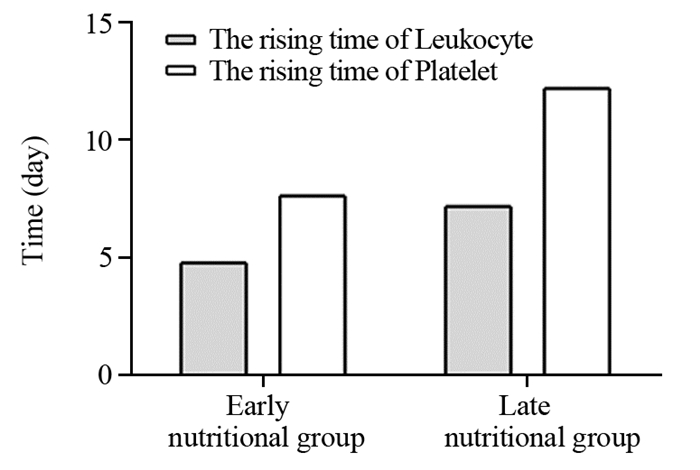
2 结果结果显示,相对于晚期营养干预组,早期积极营养干预不仅有利于缩短Ⅳ度骨髓抑制肿瘤患者白细胞、血小板等的恢复,且两组之间相比,差异有统计学意义(P=0.012, P=0.003),见图 1。
|
| 图 1 两组Ⅳ度骨髓抑制肿瘤患者白细胞/血小板开始上升时间比较 Figure 1 Rising time of leukocyte/platelet in two groups of cancer patients with Ⅳ degree myelosuppression |
结果显示,对于化疗后Ⅳ度骨髓抑制的肿瘤患者,与晚期营养干预相比,早期积极营养干预可明显减少合并细菌、真菌等感染发生率,从而降低死亡率,差异具有统计学意义(P=0.031, P=0.028, P=0.006),见图 2。

|
| 图 2 两组Ⅳ度骨髓抑制肿瘤患者肺部感染和死亡率比较 Figure 2 Incidence of lung infection and mortality in two groups of cancer patients with Ⅳ degree myelosuppression |
结果显示,与晚期营养干预组相比,早期积极营养干预组,可明显减少骨髓抑制相关第2、3周住院率,差异具有统计学意义(P < 0.05),见表 2。
 |
近年来,随着化疗剂量强度概念的提出及新一代化疗药物的应用,化疗在延长患者生存时间及提高生存率等方面发挥了举足轻重的作用,但其相关不良风险,比如肝肾功能损害、消化道黏膜损伤、骨髓抑制等亦不容忽视;尤其对于化疗后Ⅳ度骨髓抑制肿瘤患者,因其亦并发感染、治疗不及时死亡风险高等,在临床工作中值得进一步优化该方面的治疗。
对于化疗后Ⅳ度骨髓抑制的临床治疗策略,除了定期复查血常规等早期识别及预防之外,近些年来来,随着粒细胞集落刺激因子(G-CSF)等生物制剂及营养支持的应用,在一定程度上预防及改善了化疗后骨髓抑制的发生率,但随着化疗周期的增加及联合给药方案的实施等,化疗后Ⅳ度骨髓抑制的发生率仍较高,往往成为临床工作棘手的问题之一,值得深入研究及探讨其预防及治疗策略,早期研究证实[1-2],对于肿瘤患者,营养支持治疗作为肿瘤综合治疗一部分,能够明显改善患者生活质量评分等。
本研究提示,对于化疗后Ⅳ度骨髓抑制的肿瘤患者给予积极早期营养干预,不仅仅改善了患者的白细胞、血小板等的恢复时间,更重要的是减少了粒细胞缺乏合并感染的发生率及相关死亡风险,值得在临床工作中进一步研究探讨。Lis等[3-4]研究提示,恶性肿瘤患者营养不良风险比例高达近50%,对于化疗后Ⅳ度骨髓抑制的患者营养不良风险更高,积极营养干预可改善肿瘤患者预后等;同时研究提示,有效的营养治疗是肿瘤综合治疗手段中极为重要的内容。Mak等[5]亦研究探讨了营养干预在肿瘤患者手术、化疗等相关中的作用,结果提示,营养干预不仅有利于减轻化疗相关毒性,而且可以提高肿瘤化疗患者生活质量、改善总生存等,与我们研究结果一致。
总之,本临床研究提示,对于化疗后Ⅳ骨髓抑制的肿瘤患者应更加重视其营养风险评估,对于存在营养风险的患者,早期积极营养干预,可改善患者预后、减少粒细胞缺乏相关感染等风险,早期营养治疗应作为肿瘤综合治疗的重要组成部分,值得在临床实践中进一步探讨及研究证实。
| [1] | Paccagnella A, Morassutti I, Rosti G. Nutritional intervention for improving treatment tolerance in cancer patients[J]. Curr Opin Oncol, 2011, 23(4): 322–30. DOI:10.1097/CCO.0b013e3283479c66 |
| [2] | Bossola M. Nutritional interventions in head and neck cancer patients undergoing chemoradiotherapy: a narrative review[J]. Nutrients, 2015, 7(1): 265–76. |
| [3] | Lis CG, Gupta D, Lammersfeld CA, et al. Role of nutritional status in predicting quality of life outcomes in cancer-a systematic review of the epidemiological literature[J]. Nutr J, 2012, 11: 27. DOI:10.1186/1475-2891-11-27 |
| [4] | Shim H, Cheong JH, Lee KY, et al. Perioperative Nutritional Status Changes in Gastrointestinal Cancer Patients[J]. Yonsei Med J, 2013, 54(6): 1370–6. DOI:10.3349/ymj.2013.54.6.1370 |
| [5] | Mak M, Bell K, Ng W, et al. Nutritional status, management and clinical outcomes in patients with esophageal and gastro-oesophageal cancers: A descriptive study[J]. Nutr Diet, 2017, 74(3): 229–35. DOI:10.1111/ndi.2017.74.issue-3 |
 2018, Vol. 45
2018, Vol. 45