文章信息
- 抑酸药物对小分子靶向药物吸收的影响
- Effect of Antiacid Drugs on Absorption of Small Molecular Targeted Drugs
- 肿瘤防治研究, 2018, 45(2): 119-122
- Cancer Research on Prevention and Treatment, 2018, 45(2): 119-122
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0700
- 收稿日期: 2017-06-14
- 修回日期: 2017-09-25
2. 400037 重庆,第三军医大学第二附属医院临床药学科
2. Department of Clinical Pharmacy, The Second Affiliated Hospital of Third Military Medical University, Chongqing 400037, China
分子靶向药物因其疗效确切,不良反应轻,已成为全球研究的热点。目前,已有多种分子靶向药物成功应用于临床[1],提高了肿瘤患者的无疾病进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)。分子靶向药物主要分为单克隆抗体和小分子靶向药物(small molecular targeted drugs, SMTD)两大类,其中,单克隆抗体多为注射制剂,而SMTD多为口服固体制剂[2]。口服固体制剂在体内吸收的前提是先在胃肠道内溶解,对于非肠溶固体制剂而言,胃内pH是影响药物溶解的一个重要因素[3]。而影响胃内pH的主要药物是质子泵抑制剂(proton pump inhibitor, PPI)和组胺受体-2拮抗剂(H2-receptor antagonists, H2RT)。为探讨抑酸药物(antiacid drugs, AD)对SMTD溶解与吸收的影响,该文对相关文献进行检索并整理,以期为临床提供参考,促进合理用药。
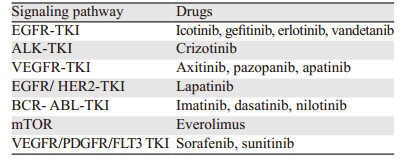
1 小分子靶向药物分类SMTD多为酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI),作用信号通路大致可分为7类[1-2],见表 1,分别为表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)、血管内皮细胞生长因子受体(vascular endothelial growth factor receptor, VEGFR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)、染色体易位形成的断裂点簇集区(breakpoint cluster region, BCR)-艾贝尔逊白血病病毒(abelson leukemia virus, ABL)融合基因(BCR-ABL)、哺乳类动物雷帕霉素(mammalian target of rapamycin, mTOR)激酶抑制剂以及多靶点的TKI。
|
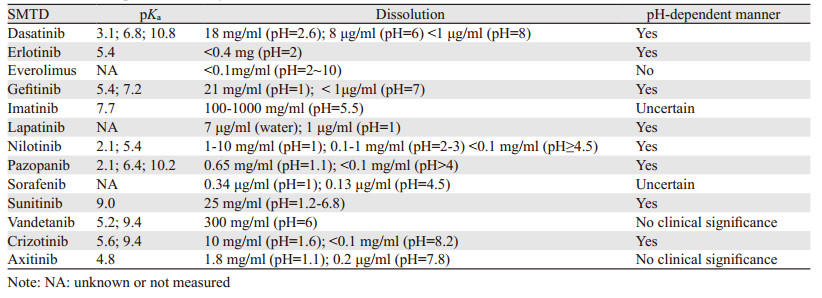
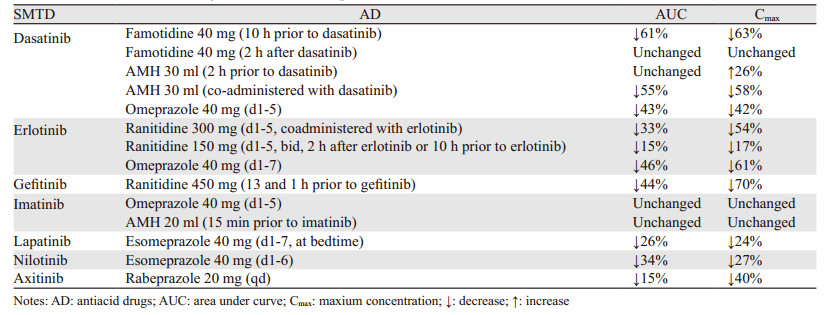
据相关文献报道,在所有肿瘤患者中,有20%~55%的患者在使用AD来改善胃酸过多分泌的相关临床症状[4]。由于部分SMTD的溶解度受胃内pH的影响,见表 2,故AD可通过升高胃内pH来影响SMTD的溶解和吸收,进而影响药物生物利用度和疗效[5],见表 3。
达沙替尼有3个酸碱度(pKa)值,分别是3.1, 6.8和10.8,当pH分别为2.6,6和8时,其溶解度依次为18 mg/ml,8 μg/ml和 < 1 μg/ml[5],有研究表明AD可通过升高胃内pH来降低达沙替尼的溶解与吸收[6]。一项针对健康受试者的单次给药研究中[7],在单次给予达沙替尼(50 mg)前10 h给予法莫替丁(40 mg)可使达沙替尼的暴露降低61%,而在达沙替尼给药后2 h给予法莫替丁,达沙替尼的AUC和Cmax变化差异无统计学意义。此外,奥美拉唑(40 mg)可使达沙替尼的AUC和Cmax分别降低43%和42%,提示应避免将达沙替尼与AD联用,若需要行抑酸治疗,可在达沙替尼给药后2 h给予法莫替丁。而该研究的另一项研究结果表明氢氧化铝/氢氧化铝混合溶液(aluminum/magnesium hydroxides, AMH)与达沙替尼同时使用时,达沙替尼的AUC和Cmax分别降低了55%和58%。而在给予达沙替尼前2 h使用AMH,达沙替尼的暴露量变化差异无统计学意义,提示可在给予达沙替尼前2 h服用AMH。Pang等[8]采用比格犬作为实验对象来研究胃内pH对达沙替尼吸收的影响,结果显示喂食后比格犬的平均胃内pH为1.45~3.03,口服法莫替丁后,比格犬胃内pH升至7,并持续5 h,且显著降低达沙替尼的AUC和Cmax。而盐酸甜菜碱与法莫替丁合用却可恢复达沙替尼的暴露量。提示长期服用AD的患者,当需要使用达沙替尼时,可以服用盐酸甜菜碱来降低胃内pH,以提高达沙替尼的吸收和生物利用度[8]。
2.2 厄洛替尼厄洛替尼的pKa为5.4,其溶解度随pH升高而降低。相关研究表明[9-10],厄洛替尼与奥美拉唑(40 mg)合用时,其AUC和Cmax分别降低了46%和61%;与雷尼替丁(300 mg)合用时,其AUC和Cmax分别降低了33%和54%;而当厄洛替尼与雷尼替丁间隔给药(在给予雷尼替丁前2 h或给药后10 h给予厄洛替尼)时,其AUC和Cmax分别只降低了15%和17%。研究结果提示应当避免厄洛替尼与AD合用,若患者需要行抑酸治疗,应当采取间隔给予雷尼替丁的方法。Chu等[11]进行了一项回顾性分析,研究AD对厄洛替尼疗效的影响,共有507例非小细胞肺癌患者被纳入该项研究。研究结果显示联合组(抑酸药物+厄洛替尼)和单药组(厄洛替尼)的PFS分别为1.4和2.3月(P < 0.001),OS分别为12.9和16.8月(P=0.003),差异均有统计学意义,表明AD可降低厄洛替尼的疗效。
2.3 吉非替尼吉非替尼的pKa为5.4和7.2,当溶媒的pH为5时,其溶解度迅速下降[12]。Tang等[13]进行了一项Ⅰ期临床试验来评估胃内pH对吉非替尼生物利用度的影响。26名健康者被纳入该项研究,研究发现雷尼替丁(450 mg)可使吉非替尼的AUC和Cmax分别降低47%和71%,提示应避免将吉非替尼与AD联用。
2.4 伊马替尼当pH > 5.5时,伊马替尼的溶解度随着pH的增高而降低,最低值为1 mg/ml。Egorin等[14]进行了一项临床研究。研究对象为12例健康受试者,实验分为两个阶段,第一阶段,受试者只口服400 mg的伊马替尼,第二阶段,受试者在服用伊马替尼(400 mg)前口服奥美拉唑(40 mg),连续服用5 d。结果显示单药组与联合组中伊马替尼的AUC分别为34.1 μg/(ml.h)和33.1 μg/(ml.h),Cmax分别为2.04和2.02 μg/ml,差异均无统计学意义,提示奥美拉唑虽然提高了胃内pH,但并无影响伊马替尼的生物利用度。另外一项研究来自Sparano[15],主要研究AMH对伊马替尼吸收的影响。该研究方法与Egorin等[14]研究方法相似,第一阶段,受试者只口服400 mg的伊马替尼,第二阶段,受试者在服用伊马替尼前15 min口服20 ml的AMH(含氢氧化铝和氢氧化镁各1.6 g)。结果显示单药组与联合组中伊马替尼的AUC分别为32.6和31.7 μg/(ml. h),Cmax均为2.06 μg/ml,差异均无统计学意义,提示AMH不影响伊马替尼的吸收。
2.5 克唑替尼克唑替尼的溶解度依赖于胃内pH值,胃内pH值越高,其溶解度越低。提高胃内pH值的药物(如PPI和H2RT)可能会降低克唑替尼的溶解度,从而降低其生物利用度[16]。但是,目前并无关于克唑替尼与AD之间的相关临床研究,为避免AD可能会对克唑替尼吸收产生的不利影响,临床应尽量避免将两者合用。
2.6 拉帕替尼拉帕替尼在水中的溶解度极低,且受易到pH变化的影响,当pH > 4时,拉帕替尼的溶解度随pH的升高而显著下降。Koch等[17]将肿瘤患者作为受试者进行了一项临床研究,研究共纳入了16例女性乳腺癌患者。研究方法为:在第一阶段,患者只服用1 250 mg的拉帕替尼,持续服用7 d。经洗脱后,在第二阶段,患者分别于早晨口服1 250 mg的拉帕替尼,晚上睡前口服40 mg的艾司奥美拉唑,连续服用7 d。结果示:联合组相比于单药组,AUC和Cmax分别下降了26%和24%,差异有统计学意义。提示艾司奥美拉唑能降低拉帕替尼的生物利用度。
2.7 尼洛替尼尼洛替尼在pH较高(≥4.5)的环境中溶解度很低。Yin等[18]进行了一项关于埃索奥美拉唑影响尼洛替尼吸收与代谢的临床研究,共有22例健康受试者被纳入该项研究。实验分两个阶段,在第一阶段中,受试者只服用尼洛替尼,在第二阶段中,受试者于第1天和第8天单次口服400 mg的尼洛替尼,再于第8天到第13天连续口服40 mg的艾司奥美拉唑。结果显示,与埃索奥美拉唑联用时,尼洛替尼的AUC和Cmax分别降低了34%和27%,提示应尽量避免将尼洛替尼与艾司奥美拉唑联合使用。
2.8 阿昔替尼药物相互作用实验结果表明20 mg的雷贝拉唑可以使阿昔替尼的AUC和Cmax分别降低15%和42%,但却无临床意义[19],即虽然雷贝拉唑通过升高胃内pH来影响阿昔替尼的溶解与吸收,但是并不影响阿昔替尼的临床疗效。
2.9 舒尼替尼舒尼替尼的pKa为9.0,在pH为1.2~6.8范围内,其溶解度为25 mg/ml。因其最大给药剂量为50 mg,故意味着舒尼替尼应该不存在溶解问题,但当pH大于6.8时,其溶解度迅速下降,导致其在体内难以吸收[3]。故胃内pH同样能显著影响舒尼替尼的溶解与吸。Ha等[20]进行了一项回顾性分析,研究样本量为231例,研究结果显示联合组(质子泵抑制剂PPI+舒尼替尼)与单药组(舒尼替尼)的PFS分别为18.9和23.6周(P=0.04),OS分别为40.9和62.4周(P=0.02),差异均有统计学意义。表明PPI与舒尼替尼联用可降低舒尼替尼的疗效。
3 总结根据溶解原理,酸性药物易溶于碱性溶媒,而难溶于酸性溶媒;碱性药物易溶于酸性溶媒,而难溶于碱性溶媒[21]。不同药物因具有不同的pKa[5],即使在相同的环境中(胃液)也有着不同的溶解度,也就意味着AD可通过改变胃内pH来影响一部分SMTD在体内的溶解度,但影响程度不尽相同,部分药物受到的影响较为轻微,而部分药物受到的影响较为显著。
口服固体药物需要先在体内溶解,然后以分子的形式透过细胞膜进入细胞,再经血液分布于全身[22-23]。若药物溶解度低,则药物难以穿过细胞膜,最终随粪便排出体外。故溶解度高的药物一般易于吸收,而溶解度低的药物一般难于吸收[23]。由于缺乏相关的临床研究,因此并无关于AD对埃克替尼,阿法替尼以及阿帕替尼溶解度影响的相关文献。由上述的研究结果可知,受到AD影响较为显著的药物是达沙替尼、厄洛替尼、吉非替尼、拉帕替尼以及尼洛替尼,若患者使用这些药物的同时须进行抑酸治疗,则可采取间隔给予雷尼替丁的方法,即在雷尼替丁给药前2 h或给药后10 h给予SMTD,这样可降低AD对SMTD在体内吸收的影响,从而保障SMTD的疗效。
此外,AD除了影响上述SMTD的溶解与吸收,有研究[24-25]也提出AD会降低卡培他滨的溶解与吸收,进而降低其疗效。因此,当AD与口服固体药物联合使用时,应注意AD是否会影响口服固体药物的溶解和吸收,以避免降低药物的吸收和疗效。
| [1] | 张伯阳, 许重远. 肿瘤分子靶向治疗药物的研究与应用进展[J]. 中国临床药理学杂志, 2015, 31(12): 1213–7. [ Zhang BY, Xu ZY. Research and application progress on the molecular targeted drugs for cancer[J]. Zhongguo Lin Chuang Yao Li Xue Za Zhi, 2015, 31(12): 1213–7. ] |
| [2] | 陈晓媛, 张虹, 高晨燕, 等. 小分子靶向抗肿瘤药物临床研究策略探讨及案例分析[J]. 中国新药杂志, 2013, 22(3): 269–73. [ Chen Xiaoyuan, Zhang Hong, Gao Chenyan, et al. Discussion and case analysis of clinical development strategy of small-molecule targeted anti-cancer drugs[J]. Zhongguo Xin Yao Za Zhi, 2013, 22(3): 269–73. ] |
| [3] | Di Gion P, Kanefendt F, Lindauer A, et al. Clinical pharmacokinetics of tyrosine kinase inhibitors: focus on pyrimidines, pyridines and pyrroles[J]. Clin Pharmacokinet, 2011, 50(9): 551–603. DOI:10.2165/11593320-000000000-00000 |
| [4] | Smelick GS, Heffron TP, Chu L, et al. Prevalence of acid-reducing agents(ARA) in cancer populations and ARA drug-drug interaction potential for molecular targeted agents in clinical development[J]. Mol Pharm, 2013, 10(11): 4055–62. DOI:10.1021/mp400403s |
| [5] | Budha NR, Frymoyer A, Smelick GS, et al. Drug Absorption Interactions between Oral Targeted Anticancer Agents and PPIs: Is pH-Dependent Solubility the Achilles Heel of Targeted Therapy?[J]. Clin Pharmacol Ther, 2012, 92(2): 203–13. DOI:10.1038/clpt.2012.73 |
| [6] | Takahashi N, Miura M, Niioka T, et al. Influence of H2-receptor antagonists and proton pump inhibitors on dasatinib pharmacokinetics in Japanese leukemia patients[J]. Cancer Chemother Pharmacol, 2012, 69(4): 999–1004. DOI:10.1007/s00280-011-1797-3 |
| [7] | Eley T, Luo FR, Agrawal S, et al. PhaseⅠstudy of the effect of gastric acid pH modulators on the bioavailability of oral dasatinib in healthy subjects[J]. J Clin Pharmacol, 2009, 49(6): 700–9. DOI:10.1177/0091270009333854 |
| [8] | Pang J, Dalziel G, Dean B, et al. Pharmacokinetics and absorption of the anticancer agents dasatinib and GDC-0941 under various gastric conditions in dogs-reversing the effect of elevated gastric pH with betaine HCl[J]. Mol Pharm, 2013, 10(11): 4024–31. DOI:10.1021/mp400356m |
| [9] | Kletzl H, Giraudon M, Ducray PS, et al. Effect of gastric pH on erlotinib pharmacokinetics in healthy individuals: omeprazole and ranitidine[J]. Anticancer Drugs, 2015, 5(26): 565–72. |
| [10] | van Leeuwen RW, Peric R, Hussaarts KG, et al. Influence of the Acidic Beverage Cola on the Absorption of Erlotinib in Patients With Non-small cell Lung Cancer[J]. J Clin Oncol, 2016, 34(12): 1309–14. DOI:10.1200/JCO.2015.65.2560 |
| [11] | Chu MP, Ghosh S, Chambers CR, et al. Gastric Acid Suppression Is Associated With Decreased Erlotinib Efficacy in Non-Small-Cell Lung Cancer[J]. Clin Lung Cancer, 2015, 16(1): 33–9. DOI:10.1016/j.cllc.2014.07.005 |
| [12] | Cohen MH, Williams GA, Sridhara R, et al. United States Food and Drug Administration Drug Approval summary: Gefitinib (ZD1839; Iressa) tablets[J]. Clin Cancer Res, 2004, 10(4): 1212–8. DOI:10.1158/1078-0432.CCR-03-0564 |
| [13] | Tang W, Tomkinson H, Masson E. Effect of Sustained Elevated Gastric pH Levels on Gefitinib Exposure[J]. Clin Pharmacol Drug Dev, 2017, 6(5): 517–23. DOI:10.1002/cpdd.337 |
| [14] | Egorin MJ, Shah DD, Christner SM, et al. Effect of a proton pump inhibitor on the pharmacokinetics of imatinib[J]. Br J Clin Pharmacol, 2009, 68(3): 370–4. DOI:10.1111/bcp.2009.68.issue-3 |
| [15] | Sparano BA, Egorin MJ, Parise RA, et al. Effect of antacid on imatinib absorption[J]. Cancer Chemother Pharmacol, 2009, 63(3): 525–8. DOI:10.1007/s00280-008-0778-7 |
| [16] | Hamilton G, Rath B, Burghuber O. Pharmacokinetics of crizotinib in NSCLC patients[J]. Expert Opin Drug Metab Toxicol, 2015, 11(5): 835–42. DOI:10.1517/17425255.2015.1021685 |
| [17] | Koch KM, Im YH, Kim SB, et al. Effects of Esomeprazole on the Pharmacokinetics of Lapatinib in Breast Cancer Patients[J]. Clin Pharmacol Drug Dev, 2013, 2(4): 336–41. DOI:10.1002/cpdd.45 |
| [18] | Yin OQ, Gallagher N, Fischer D, et al. Effect of the proton pump inhibitor esomeprazole on the oral absorption and pharmacokinetics of nilotinib[J]. J Clin Pharmacol, 2010, 50(8): 960–7. DOI:10.1177/0091270009346061 |
| [19] | US Food and Drug Administration (2012) Axitinib (Inlyta). Clinical Pharmacology and Biopharmaceutics Review. Available at: http://www.accessdata.fda.gov/drugsatfda_docs/nda/2012/202324Orig1s000TOC.cfm. |
| [20] | Ha VH, Ngo M, Chu MP, et al. Does gastric acid suppression affect sunitinib efficacy in patients with advanced or metastatic renal cell cancer?[J]. J Oncol Pharm Pract, 2015, 21(3): 194–200. DOI:10.1177/1078155214527145 |
| [21] | 郑斯骥, 谭波, 刘潇怡, 等. 溶解-析出原理在减小固体制剂中难溶性药物粒径的应用[J]. 中国医药工业杂志, 2012, 43(3): 186–90. [ Zheng SJ, Tan B, Liu XY, et al. Application of Dissolution-precipitation to Reduction in the Diameter of Slightly Soluble Drugs in Solid Preparation[J]. Zhongguo Yi Yao Gong Ye Za Zhi, 2012, 43(3): 186–90. ] |
| [22] | 李光华. 口服药物吸收的研究进展[J]. 天津药学, 2014, 26(2): 69–71. [ Li GH. Research progress of oral drug absorption[J]. Tianjin Yao Xue, 2014, 26(2): 69–71. ] |
| [23] | 罗轶凡, 任利翔, 李晓红, 等. 药物肠道吸收研究方法概述[J]. 药物评价研究, 2017, 40(5): 706–10. [ Luo YF, Ren LX, Li XH, et al. Summary of research methods for drug intestinal absorption[J]. Yao Wu Ping Jia Yan Jiu, 2017, 40(5): 706–10. ] |
| [24] | Sun J, Ilich AI, Kim CA, et al. Concomitant Administration of Proton Pump Inhibitors and Capecitabine is Associated With Increased Recurrence Risk in Early Stage Colorectal Cancer Patients[J]. Clinl Colorectal Cancer, 2016, 15(3): 257–63. DOI:10.1016/j.clcc.2015.12.008 |
| [25] | Chu MP, Hecht JR, Slamon D, et al. Association of Proton Pump Inhibitors and Capecitabine Efficacy in Advanced Gastroesophageal Cancer: Secondary Analysis of the TRIO-013/LOGiC Randomized Clinical Trial[J]. JAMA Oncol, 2017, 3(6): 767–73. DOI:10.1001/jamaoncol.2016.3358 |
 2018, Vol. 45
2018, Vol. 45