文章信息
- BCYRN1对乳腺癌细胞MCF7和小鼠移植瘤增殖和转移的影响
- Influence of BCYRN1 on Proliferation and Migration of Breast Cancer Cell Line MCF7 and Tumor-bearing Mice
- 肿瘤防治研究, 2018, 45(4): 205-209
- Cancer Research on Prevention and Treatment, 2018, 45(4): 205-209
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0691
- 收稿日期: 2017-09-11
- 修回日期: 2017-11-20
2. 436000 鄂州,鄂州市中心医院普外科
2. Department of General Surgery, Ezhou Central Hospital, Ezhou 436000, China
长链非编码RNA(lncRNAs)的发现拓展了靶向治疗的范围,已报道多种lncRNAs在乳腺癌的发展过程中起着重要作用,这些lncRNAs具有成为乳腺癌治疗靶点的潜能[1]。BCYRN1已报道在多种癌症中表达异常,这种异常表达可能与癌症的发生发展存在着一定关系[2]。有研究报道BCYRN1在浸润性乳腺癌和正常组织的表达存在很大差异[3]。为了进一步探索BCYRN1在乳腺癌中的作用,本研究采用siRNA技术干扰BCYRN1基因,在乳腺癌细胞MCF7和荷瘤小鼠上进行了体内外研究,现报道如下。
1 材料与方法 1.1 细胞系与主要试剂乳腺癌细胞系MCF7购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。RPMI 1640培养液和胎牛血清以及转染试剂TurboFect Transfection Regent购自赛默飞世尔科技公司(Grand Island, US)。Cell Counting Kit-8(CCK-8)购自日本同仁化学公司。Transwell小室及人工基底膜均购自美国BD公司。细胞增殖核抗原-67(antigen identified by monoclonal antibody, Ki-67)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)和基质金属蛋白酶9(matrix metalloprotein 9, MMP-9)抗体购自美国NEB公司。
1.2 细胞培养与转染乳腺癌细胞培养于10%胎牛血清和1%的青-链霉素的RPMI 1640培养液中,并置于37℃、5% CO2的恒温培养箱中培养。当细胞增殖到80%时进行传代培养。依照转染试剂TurboFect Transfection Regent说明书将BCYRN1 siRNA和siRNA scramble分别转染乳腺癌细胞MCF7,未转染的MCF7为阴性对照组,siRNA scramble为对照组。
1.3 CCK-8检测细胞增殖用CCK-8试剂分别检测三组细胞在转染后0、24、48、72和96 h的增殖状况,首先将CCK-8溶液用培养液稀释到10%,然后将待测细胞悬浮于上述稀释液中,在37℃恒温培养箱中培养4 h,检测450 nm处吸光度值,计算细胞增殖倍数。
1.4 蛋白印迹检测细胞中的蛋白表达收集三组细胞,PBS清洗三次,用添加蛋白酶抑制剂的细胞裂解液进行裂解,提取总蛋白。SDS-PAGE凝胶电泳分离并转至PVDF膜,经5%的BSA封闭后依次孵育相应的一抗和二抗。显色并统计灰度值计算相对表达量。
1.5 划痕实验分析细胞运动能力将细胞密度为1×106/ml的细胞悬液加入到6孔板中,过夜培养至形成单层细胞。在单层细胞上用10 μl的枪头划横线,PBS洗3次,洗去因划痕而脱落的细胞。此时显微镜下拍照为0 h的样,继续培养24 h后再取出拍照为24 h的样。
1.6 MCF7荷瘤小鼠模型建立5周龄的雌性小鼠购自四川大学华西医院基因工程小鼠中心。BCYRN1 siRNA和siRNA scramble分别对乳腺癌细胞MCF7进行转染,将上述细胞悬液分别感染小鼠,建立MCF7荷瘤小鼠模型。每5 d测量一次肿瘤体积,Ⅴ=长×宽2/2。
1.7 免疫组织化学法分析组织中蛋白表达取出肿瘤组织后用PBS清洗8次,去掉坏死组织及血凝块。用4%的多聚甲醛在4℃下固定24 h。PBS清洗3次,再用30%、50%和70%的酒精依次清洗。脱水、石蜡包埋,1% triton-100处理15 min,3%的H2O2处理15 min,5%的羊血清封闭30 min后依次孵育一抗和二抗。染色封片。
1.8 统计学方法用SPSS 16.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 siRNA干扰BCYRN1表达对MCF7细胞增殖的影响利用CCK-8检测转染不同时间的细胞增殖能力。转染72 h后BCYRN1 siRNA干扰组的细胞增殖倍数明显低于对照组,转染96 h的细胞增殖倍数远远低于对照组(P < 0.05),见图 1。可见,siRNA干扰BCYRN1后可抑制乳腺癌细胞MCF7的增殖能力。
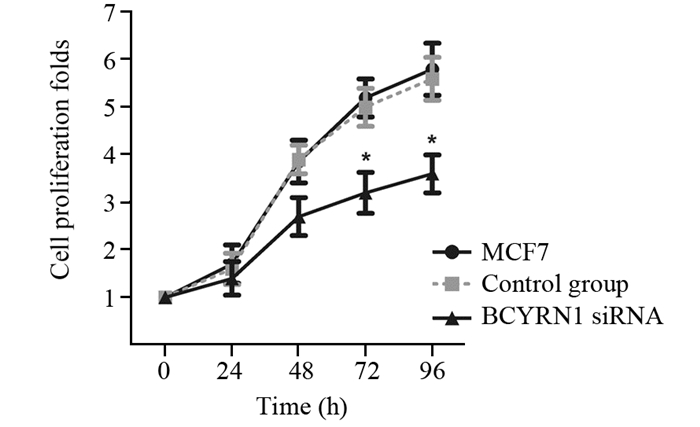
|
| *: P < 0.05, compared with control group, siRNA scramble was control group 图 1 CCK-8法检测MCF7细胞增殖 Figure 1 Proliferation of MCF7 cells detected by CCK-8 |
BCYRN1 siRNA处理乳腺癌细胞MCF7后,增殖标记蛋白Ki-67和PCNA的表达受到抑制,见图 2A。BCYRN1 siRNA干扰组中Ki-67和PCNA的相对表达量明显低于对照组,约减少2倍(P < 0.05),见图 2B~2C。
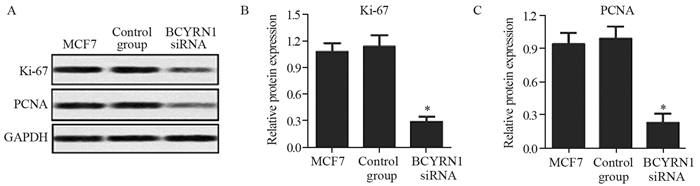
|
| *: P < 0.05, compared with control group 图 2 蛋白印记法检测细胞增殖标记蛋白表达 Figure 2 Cell proliferation marker protein expression tested by Western blot |
利用划痕实验分析BCYRN1 siRNA对乳腺癌细胞MCF7运动能力的影响。结果显示,划线24 h后,BCYRN1 siRNA干扰组的缝隙间距明显大于对照组,这说明抑制BCYRN1的表达可减弱乳腺癌细胞MCF7迁移能力,见图 3。

|
| Healing crack was observed by inverted microscope (×40) 图 3 划痕实验检测细胞迁移能力 Figure 3 Cell migration detected by wound healing assay |
为了进一步证实BCYRN1对细胞迁移的影响,通过蛋白印迹检测迁移标记蛋白VEGF和MMP-9的表达。结果表明,BCYRN1 siRNA干扰组迁移标记蛋白VEGF和MMP-9的表达低于对照组,见图 4A。统计结果显示,BCYRN1的抑制会导致迁移标记蛋白VEGF和MMP-9表达下调(P=0.04),见图 4B~4C。
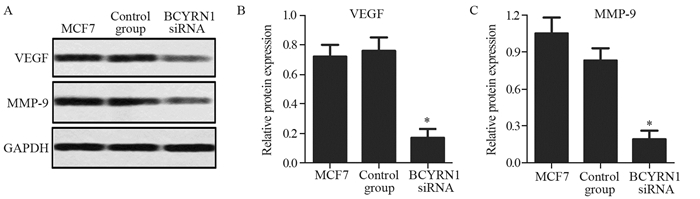
|
| *: P < 0.05, compared with control group 图 4 蛋白印记检测迁移标记蛋白表达 Figure 4 Migration marker protein expression tested by Western blot |
用转染BCYRN1 siRNA或对照组的乳腺癌细胞MCF7感染小鼠,每5天测量一次肿瘤的体积。感染小鼠30天后,实验组小鼠BCYRN1 siRNA的肿瘤明显小于对照组,见图 5A。每5天一次统计肿瘤体积,结果显示,BCYRN1 siRNA组的肿瘤体积明显小于对照组(P=0.03),见图 5B。由此可见,siRNA干扰BCYRN1后可以抑制乳腺肿瘤的生长。
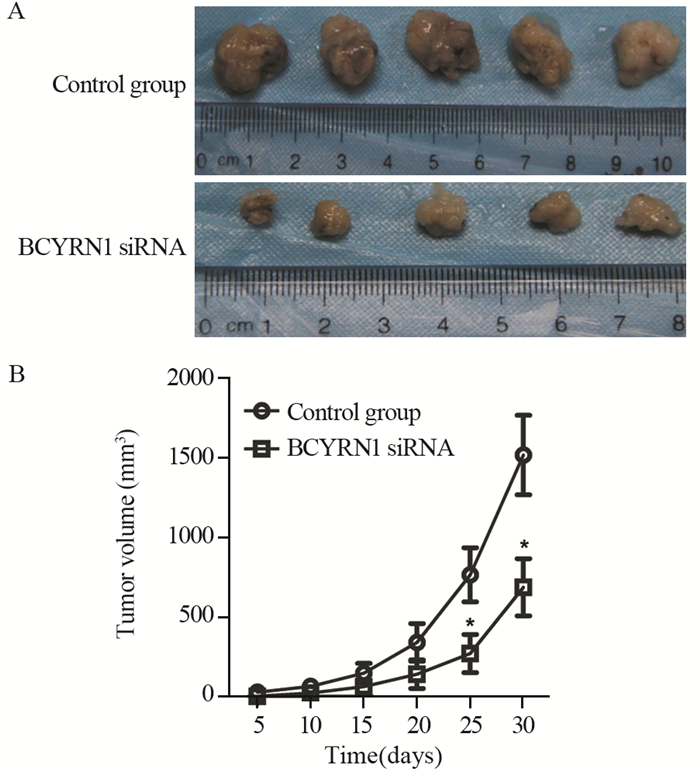
|
| A: the tumor tissues of MCF7 tumor-bearing mice; B: tumor volume (5-30 days); *: P < 0.05, compared with control group 图 5 BCYRN1 siRNA抑制荷瘤小鼠肿瘤的生长 Figure 5 Tumor growth was inhibited by BCYRN1 siRNA |
免疫组织化学进一步检测BCYRN1对乳腺肿瘤增殖和迁移的影响。BCYRN1 siRNA组荷瘤小鼠的肿瘤组织中,增殖标记蛋白Ki-67和迁移标记蛋白MMP-9的表达都低于对照组,见图 6。上述结果表明,siRNA干扰BCYRN1可抑制乳腺癌荷瘤小鼠肿瘤组织增殖标记蛋白Ki-67和迁移标记蛋白MMP-9的表达。
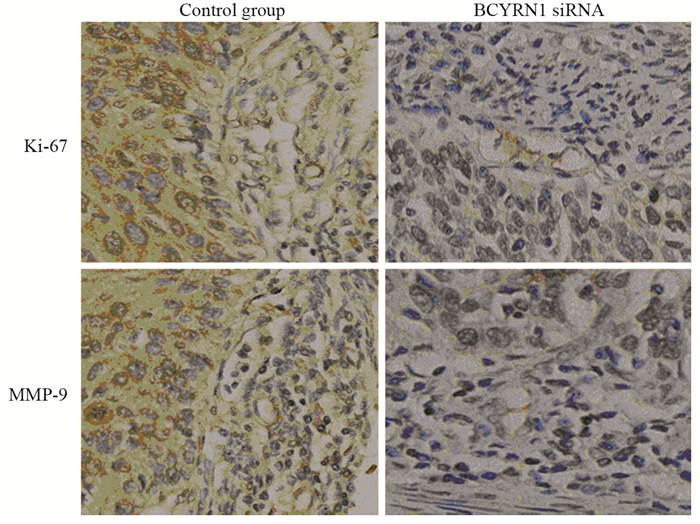
|
| 图 6 肿瘤组织增殖标记蛋白和迁移标记蛋白表达(免疫组织化学×100) Figure 6 Expression of cell proliferation and migration marker proteins (Immunohistochemical staining ×100) |
中国新诊断乳腺癌病例占全球的12.2%,乳腺癌死亡率占世界的9.6%[4]。中国乳腺癌发病率和死亡率都呈现上升趋势,中国乳腺癌发病率的增长速度是世界乳腺癌增长率的2倍[5-6]。另外中国庞大的人口基数使得中国乳腺癌患者的人数众多,2013年,中国新发病例27.9万,死亡病例约6.5万[7]。乳腺癌治疗对医疗健康事业是一个重大考验。
前列腺癌、膀胱癌、肾癌和肺癌等多种癌症的形成及迁移都会受长链非编码RNA的调控[8-10]。Su等发现了1 623种与乳腺癌相关的lncRNAs,其中部分lncRNAs与多种癌症都存在一定关系[11]。进一步分析发现,与癌旁组织相比,乳腺癌组织中存在790种高表达和637种低表达lncRNAs[12]。目前有文献报道乳腺癌异常表达的lncRNAs主要有HOTAIR、MALAT-1、UCA1、GAS5、NBAT1、XIST、H19和BCYRN1等[13-14]。
多项研究表明肿瘤细胞的增殖会受到lncRNAs的调节。lncRNA SPRY-IT1对乳腺癌细胞MDA-MB-231和MDA-MB-435S都具有促进细胞增殖的作用[15]。lncRNA H19则可以促进乳腺癌细胞MCF7的增殖[16]。沉默lncRNA MVIH和lncRNA UCA1会抑制乳腺癌细胞MDA-MB-231的增殖[17-18]。本研究发现siRNA BCYRN1转染72 h后,乳腺癌细胞MCF7的增殖倍数明显减少,且增殖标记蛋白Ki-67和PCNA的表达也受到了抑制。这些结果说明siRNA干扰BCYRN1可以抑制乳腺癌细胞MCF7的增殖。
lncRNAs不仅可以影响细胞增殖,还会对细胞迁移进行调控。Hu等通过划痕实验发现lncRNA NBAT1会降低乳腺癌细胞MCF7的迁移能力[19]。lncRNA BCYRN1除影响卵巢癌细胞增殖外,还可以促进支气管哮喘大鼠模型中平滑肌细胞的迁移[20]。另外,在肺癌中,lncRNA BCYRN1的表达下调会导致迁移标记蛋白MMP-9表达的降低[21]。本研究结果亦显示,沉默BCYRN1可以减弱乳腺癌细胞MCF7的运动能力并抑制迁移标记蛋白VEGF和MMP-9的表达。由此可见,siRNA BCYRN1会抑制乳腺癌细胞MCF7的迁移能力。
lncRNAs在肿瘤生长和迁移方面也发挥着重要作用。有研究表明干扰乳腺癌细胞MDA-MB-231的长链非编码RNA linc-ROR的表达并建立乳腺癌小鼠模型,8周后发现肿瘤的形成和转移受到明显抑制[22]。本研究通过转染BCYRN1 siRNA和对照组的乳腺癌细胞MCF7建立乳腺癌荷瘤小鼠模型,BCYRN1 siRNA小鼠的肿瘤明显变小,且肿瘤组织增殖标记蛋白Ki-67和迁移标记蛋白MMP-9的表达也受到了抑制,BCYRN1下调表达可抑制MCF7荷瘤小鼠肿瘤的生长和迁移。
本研究表明siRNA干扰BCYRN1可减弱乳腺癌细胞MCF7增殖能力、抑制增殖标记蛋白Ki-67和PCNA表达、降低乳腺癌MCF7细胞迁移、下调迁移标记蛋白VEGF和MMP-9的表达。进一步研究发现干扰BCYRN1还会抑制MCF7荷瘤小鼠肿瘤的生长,降低肿瘤组织增殖标记蛋白Ki-67和迁移标记蛋白MMP-9表达。综上所述,RNA干扰BCYRN1对乳腺癌细胞MCF7和荷瘤小鼠具有抗增殖和转移的作用,下一步,我们计划通过生物信息学手段预测BCYRN1的下游靶基因,探索相应的信号通路以提高乳腺癌治疗的精准性。
| [1] | Nagini S. Breast Cancer: Current Molecular Therapeutic Targets and New Players[J]. Anticancer Agents Med Chem, 2017, 17(2): 152–163. DOI:10.2174/1871520616666160502122724 |
| [2] | Sosinska P, Mikula-Pietrasik J, Ksiazek K. The double-edged sword of long non-coding RNA: The role of human brain-specific BC200 RNA in translational control, neurodegenerative diseases, and cancer[J]. Mutat Res Rev Mutat Res, 2015, 766: 58–67. DOI:10.1016/j.mrrev.2015.08.002 |
| [3] | Iacoangeli A, Lin Y, Morley EJ, et al. BC200 RNA in invasive and preinvasive breast cancer[J]. Carcinogenesis, 2004, 25(11): 2125–33. DOI:10.1093/carcin/bgh228 |
| [4] | Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279–89. DOI:10.1016/S1470-2045(13)70567-9 |
| [5] | Li T, Mello-Thoms C, Brennan PC. Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence[J]. Breast Cancer Res Treat, 2016, 159(3): 395–406. DOI:10.1007/s10549-016-3947-0 |
| [6] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893–917. DOI:10.1002/ijc.v127:12 |
| [7] | Zuo TT, Zheng RS, Zeng HM, et al. Female breast cancer incidence and mortality in China, 2013[J]. Thoracic Cancer, 2017, 8(3): 214–8. DOI:10.1111/tca.2017.8.issue-3 |
| [8] | Martens-Uzunova ES, Bottcher R, Croce CM, et al. Long noncoding RNA in prostate, bladder, and kidney cancer[J]. Eur Urol, 2014, 65(6): 1140–51. DOI:10.1016/j.eururo.2013.12.003 |
| [9] | Maruyama R, Suzuki H. Long noncoding RNA involvement in cancer[J]. BMB Rep, 2012, 45(11): 604–11. DOI:10.5483/BMBRep.2012.45.11.227 |
| [10] | 赵冲, 汪强, 武奋萍, 等. LncRNA AC0l0145.4与小细胞肺癌预后及化疗耐药的关系[J]. 肿瘤防治研究, 2017, 44(10): 677–81. [ Zhao C, Wang Q, Wu FP, et al. Relationship of LncRNA AC0l0145.4 expression with prognosis and chemoresistance of small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(10): 677–81. DOI:10.3971/j.issn.1000-8578.2017.17.0504 ] |
| [11] | Su X, Malouf GG, Chen Y, et al. Comprehensive analysis of long non-coding RNAs in human breast cancer clinical subtypes[J]. Oncotarget, 2014, 5(20): 9864–76. |
| [12] | Xu N, Wang F, Lv M, et al. Microarray expression profile analysis of long non-coding RNAs in human breast cancer: a study of Chinese women[J]. Biomed Pharmacother, 2015, 69: 221–7. DOI:10.1016/j.biopha.2014.12.002 |
| [13] | Malih S, Saidijam M, Malih N. A brief review on long noncoding RNAs: a new paradigm in breast cancer pathogenesis, diagnosis and therapy[J]. Tumour Biol, 2016, 37(2): 1479–85. DOI:10.1007/s13277-015-4572-y |
| [14] | Cerk S, Schwarzenbacher D, Adiprasito JB, et al. Current Status of Long Non-Coding RNAs in Human Breast Cancer[J]. Int J Mol Sci, 2016, 17(9): pii:E1485. DOI:10.3390/ijms17091485 |
| [15] | Shi Y, Li J, Liu Y, et al. The long noncoding RNA SPRY4-IT1 increases the proliferation of human breast cancer cells by upregulating ZNF703 expression[J]. Mol Cancer, 2015, 14: 51. DOI:10.1186/s12943-015-0318-0 |
| [16] | Sun H, Wang G, Peng Y, et al. H19 lncRNA mediates 17beta-estradiol-induced cell proliferation in MCF-7 breast cancer cells[J]. Oncol Rep, 2015, 33(6): 3045–52. DOI:10.3892/or.2015.3899 |
| [17] | Lei B, Xu SP, Liang XS, et al. Long non-coding RNA MVIH is associated with poor prognosis and malignant biological behavior in breast cancer[J]. Tumor Biol, 2016, 37(4): 5257–64. DOI:10.1007/s13277-015-4360-8 |
| [18] | Su X, Malouf GG, Chen Y, et al. Comprehensive analysis of long non-coding RNAs in human breast cancer clinical subtypes[J]. Oncotarget, 2014, 5(20): 9864–76. |
| [19] | Hu P, Chu J, Wu Y, et al. NBAT1 suppresses breast cancer metastasis by regulating DKK1 via PPC2[J]. Oncotarget, 2015, 6(32): 32410–25. |
| [20] | Zhang XY, Zhang LX, Tian CJ, et al. LncRNAs BCYRN1 promoted the proliferation and migration of rat airway smooth muscle cells in asthma via upregulating the expression of transient receptor potential 1[J]. Am J Transl Res, 2016, 8(8): 3409–18. |
| [21] | Hu T, Lu YR. BCYRN1, a c-MYC-activated long non-coding RNA, regulates cell metastasis of non-small-cell lung cancer[J]. Cancer Cell Int, 2015, 15: 36. DOI:10.1186/s12935-015-0183-3 |
| [22] | Hou P, Zhao Y, Li Z, et al. LincRNA-ROR induces epithelial-to-mesenchymal transition and contributes to breast cancer tumorigenesis and metastasis[J]. Cell Death Dis, 2014, 5: e1287. DOI:10.1038/cddis.2014.249 |
 2018, Vol. 45
2018, Vol. 45


