文章信息
- NTSR1基因对胃腺癌细胞增殖和侵袭的影响及机制
- Effect of NTSR1 Gene on Proliferation and Invasion of Gastric Adenocarcinoma and Its Mechanism
- 肿瘤防治研究, 2018, 45(1): 9-14
- Cancer Research on Prevention and Treatment, 2018, 45(1): 9-14
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0658
- 收稿日期: 2017-06-12
- 修回日期: 2017-09-04
2. 215004 苏州,苏州大学附属第二医院普外科
2. Department of General Surgery, The Second Affiliated Hospital of Soochow University, Suzhou 215004, China
神经降压素(neurotensin, NT)是一种人体广泛分布的神经内分泌肽,NTSR1(neurotensin receptors 1, NTSR1)为NT的特异性高度亲和受体。近来研究发现,NT/NTSR1在多种恶性肿瘤中高表达,我们的前期研究也显示:胃癌组织中NTSR1表达明显高于癌旁正常胃组织;NTR1过表达与胃癌的组织分级、T分期、TNM分期及淋巴结转移呈密切正相关性;NTSR1高表达是独立的预后性指标[1]。在肠癌、肺癌、前列腺癌中,NTS/NTSR1可诱导介导EGFR信号的激活,从而促进癌细胞分裂、增殖及生长[2]。人类表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)也是表皮生长因子受体(epidermal growth factor receptor, EGFR)家族的重要成员之一,有研究发现,在肺癌中,持续性刺激NTSR1可导致EGFR及HER2过表达与活化[3]。
本研究旨在探讨NTSR1基因对胃癌的增殖侵袭的影响,并初步探讨19种Cancer Phenotype信号通路中相关基因(包括EGFR、HER2)在其中的作用,为NTSR1在胃癌发生发展中的作用机制研究进一步提供理论基础。
1 资料与方法 1.1 临床资料收集无锡市人民医院病理科2011年1月—2012年2月233例经手术切除的侵犯黏膜下层或更深层次胃腺癌的标本。采用10%福尔马林固定标本,常规石蜡包埋,切片,并HE染色。
1.2 方法 1.2.1 免疫组织化学染色免疫组织化学染色采用Envision二步法,DAB显色。NTSR1及EGFR定位于细胞质,HER2定位于细胞膜。NTSR1按瘤细胞阳性率计分:阳性细胞 < 10%为阴性(-),10%~50%为阳性(+),≥50%为强阳性(++)[4]。参考文献,将EGFR染色半定量评分分为:0、+、++和+++,+~+++视为阳性[5]。HER2染色半定量评分分为:0、+为阴性,++为弱阳性,+++为强阳性[6]。
1.2.2 细胞培养将人胃癌细胞株(AGS、MGC-803、SGC-7901、MKN-45及MKN-74)在含10%胎牛血清的DMEM完全培养液中常规培养,培养条件为湿润状态下37℃、5%CO2。
1.2.3 NTSR1shRNA慢病毒载体的构建和转染慢病毒载体介导的靶向NTSR1的shRNA和对照control-shRNA由上海吉凯基因化学技术有限公司合成,针对3条NTSR1 Target序列,最终选用Target序列为CACCGTCAAGGTCGTCATA,以无靶点的基因序列为阴性慢病毒对照,载体框架结构为hU6-MCS-Ubiquitin-EGFP-IRES-puromycin,构建和包装慢病毒。处于对数生长期的细胞胰酶消化,完全培养液制成每毫升(3~5)×104个细胞悬液,继续培养保证感染时铺板量达到15%~30%左右。感染后10 h更换为常规培养液继续培养。病毒滴度为1E+9 TU/ml,病毒用量4 μl,感染MOI=20,感染时细胞密度/孔为20%,保证感染效率达到80%左右,用于检测下游癌细胞的增殖及侵袭等细胞功能实验。实验分为三组:正常目的细胞(MOCK组)、加阴性对照病毒感染的细胞组(NC组)及加NTSR1基因shRNA病毒感染的细胞组(KD组)。
1.2.4 实时荧光定量PCR技术NTSR1上游引物序列:GTCAAGGTCGTCATACAG;下游引物序列:GATGATGGTGTTCAGGAC(产物片段为81 bp),以GAPDH作参照。扩增体系12 μl:SYBR premix ex taq 6.0 μl,引物mix(5 μmol/L)0.3 μl,模板(反转录产物)0.6 μl,RNase-Free H2O 5.1 μl。反应条件:95℃ 30 s(1个循环)。95℃ 5 s,60℃ 30 s(40个循环)。95℃ 15 s,60℃ 30 s,95℃ 15 s(1个循环)。结果判定:相对定量,F=2-∆∆Ct,ΔCt=Ct目的基因-Ct内参基因;-ΔΔCt=ΔCtNC组平均值-ΔCt各样品;2-ΔΔCt反映各样品相对对照组样品目的基因的相对表达水平,当ΔCt值≤12时,该细胞中基因表达丰度为高;当1ΔCt值为12~16时,该细胞中基因表达丰度为中;当ΔCt值≥16时,该细胞中基因表达丰度为低。
1.2.5 噻唑蓝(MTT)法取对数生长期的癌细胞常规消化,接种于96孔板,接种量为每孔2 500个细胞(100 μl)。每24 h检测1次肿瘤细胞的相对生存力,酶标仪490/570 nm检测OD值,连续检测5 d。(OD490反映具有活力的细胞的数量,OD490/fold为各实验组d1~d5相对d1的OD490倍数,表示各天的增殖倍数)。
1.2.6 细胞侵袭实验(使用Corning侵袭试剂盒)本试剂盒嵌入物含有8 µm孔径大小的聚碳酸酯膜,其上方是Matrigel基质的薄层,与体内侵袭转移能力有较好的相关性。收集对数生长期的各组细胞,用无血清培养液将细胞密度调整成1×105个/孔(24孔板),接种于小室上部,在下面小室中加入750 µl 30%FBS培养液。37℃培养24 h。待培养时间结束后将上室的附着细胞用棉拭子擦去,滴2~3滴Giemsa染色液到膜的下表面染色转移细胞3~5 min后,将小室浸泡冲洗数次,空气晾干。显微镜拍照:每个小室,随机选取视野(×200),拍照计数。
1.2.7 PathScan组织芯片检测Cancer Phenotype信号通路中相关基因按照说明书,安装检测装置,每个孔先加入100 μl封闭液,移除后,加入细胞裂解样品50 μl,4℃过夜。移除细胞裂解样品后清洗。加入75 μl的1×抗体检测混合液,孵育1 h。移除后清洗。加入75 μl的1×HRP-链接的链霉亲和素,孵育0.5 h。移除后清洗。拆解装置,将玻片浸入1×清洗液中。化学发光成像系统(CLINX ChemiScope 5300)曝光1~2 s。阵列靶标分布、基因及调节位点说明,见图 1。
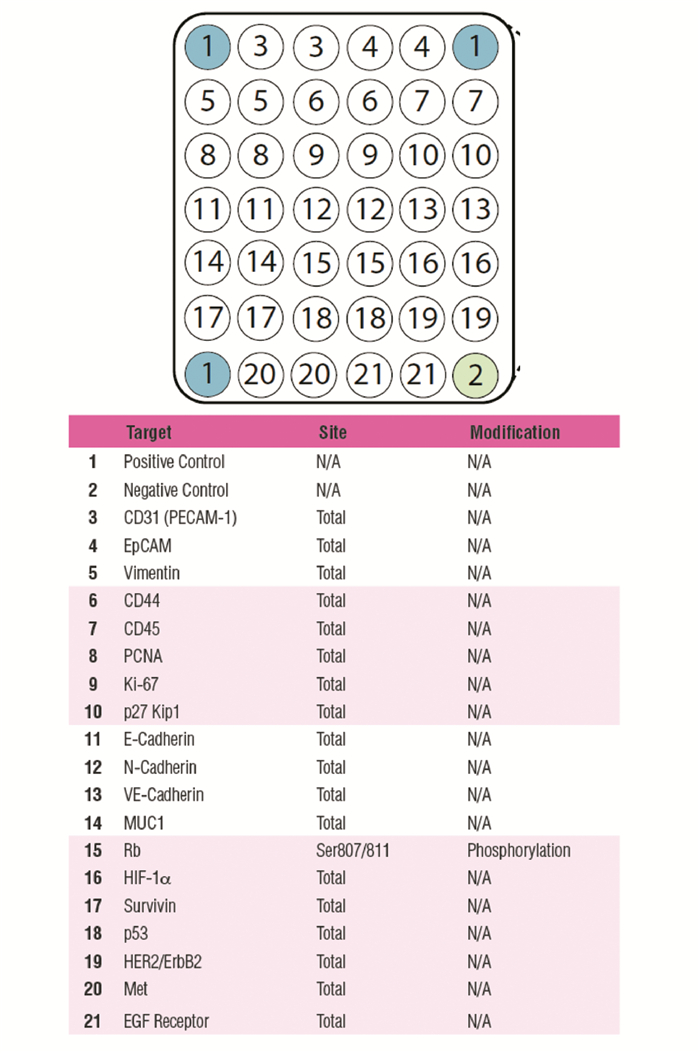
|
| 图 1 阵列靶标分布、基因及调节位点说明 Figure 1 Array target distribution illustration, gene and regulatory site description |
本研究应用SPSS 18.0软件包进行统计学分析,相关性检测采用Spearman分析。计算均数和标准差,以均数±标准差(x± s)表示,量的比较采用T-Test法检验,概率P < 0.05为差异有统计学意义。
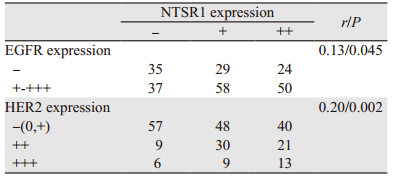
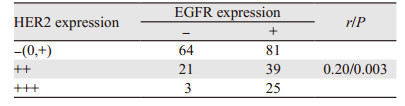
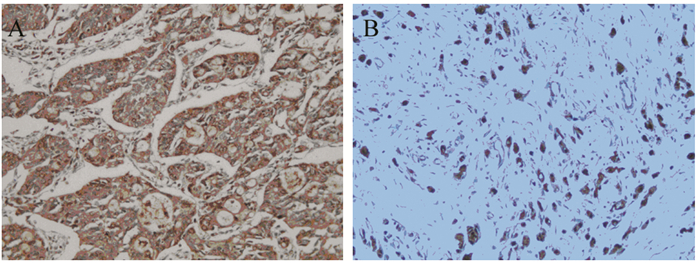
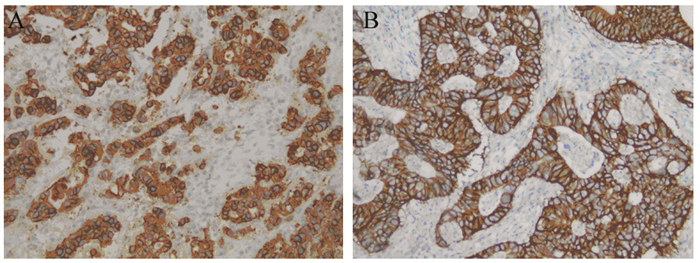
2 结果 2.1 NTSR1与EGFR及HER2的关系经免疫组织化学检测,233例胃癌组织中NTSR1阳性表达与EGFR及HER2表达均存在显著正相关性(均P < 0.05),见表 1,NTSR1阳性表达情况,见图 2。同时EGFR与HER2两者表达亦存在显著正相关性(P < 0.05),见图 3、表 2。
 |
 |
|
| A: NTSR1 was positively expressed in intestinal-type gastric cancer tissues; B: NTSR1 was strongly positive expressed in diffuse-type gastric cancer tissues 图 2 胃癌组织中NTSR1的表达(Envision ×200) Figure 2 NTSR1 expression in gastric cancer tissues (Envision ×200) |
|
| 图 3 胃癌组织EGFR(A)及HER2(B)的表达(Envision ×200) Figure 3 EGFR(A) and HER2(B) expression in gastric cancer tissues (Envision ×200) |
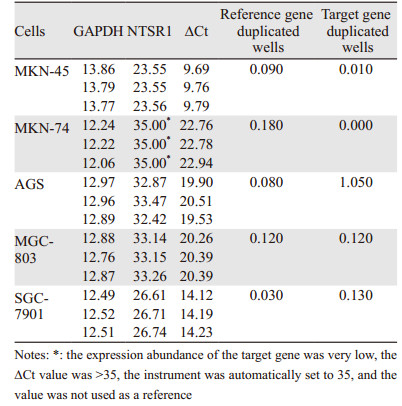
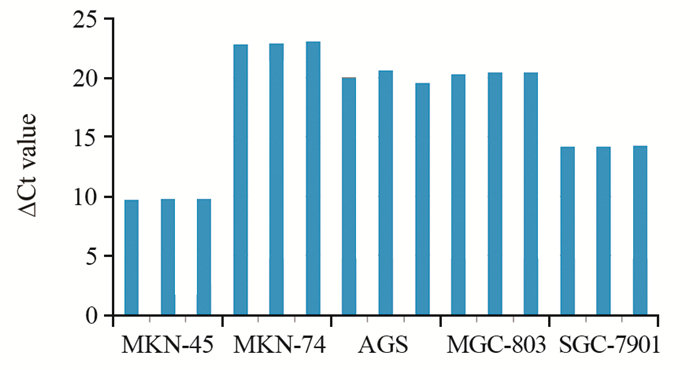
结果显示NTSR1在MKN-45中的表达丰度为高,在SGC-7901中的表达丰度为中,在MKN-74、AGS、MGC-803中的表达丰度为低,故以MKN-45作为研究对象,见表 3、图 4。
 |
|
| 图 4 NTSR1在胃癌细胞系中表达qPCR结果(∆Ct值) Figure 4 qPCR results of NTSR1 expression in gastric cancer cell lines (ΔCt value) |
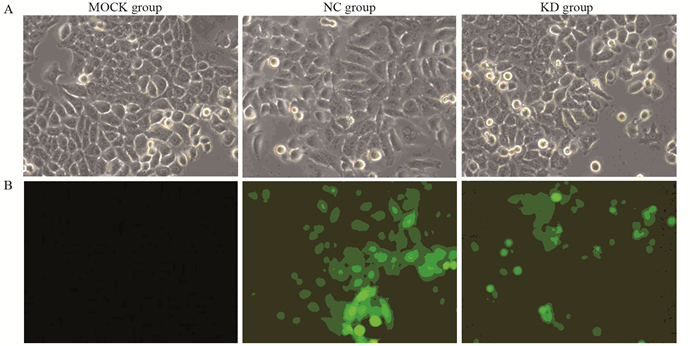
于转染96 h后开始荧光显微镜观察,MKN-45细胞的转染效率为80%以上,见图 5。
|
| NC: negative control; KD: knocked down 图 5 普通显微镜下(A)和荧光显微镜下(B)观察转染96h后MKN-45细胞的转染率(×200) Figure 5 MKN-45 cells were observed under normal microscope(A) and fluorescence microscope(B) after 96h transfection (×200) |
MTT检测结果表明:转染后第1~5天,转染shNTSR1的MKN-45细胞增殖速度比对照组明显减慢,经T-Test分析其差异具有统计学意义(P=0.000),见图 6。证明NTSR1能显著促进MKN-45细胞的增殖。
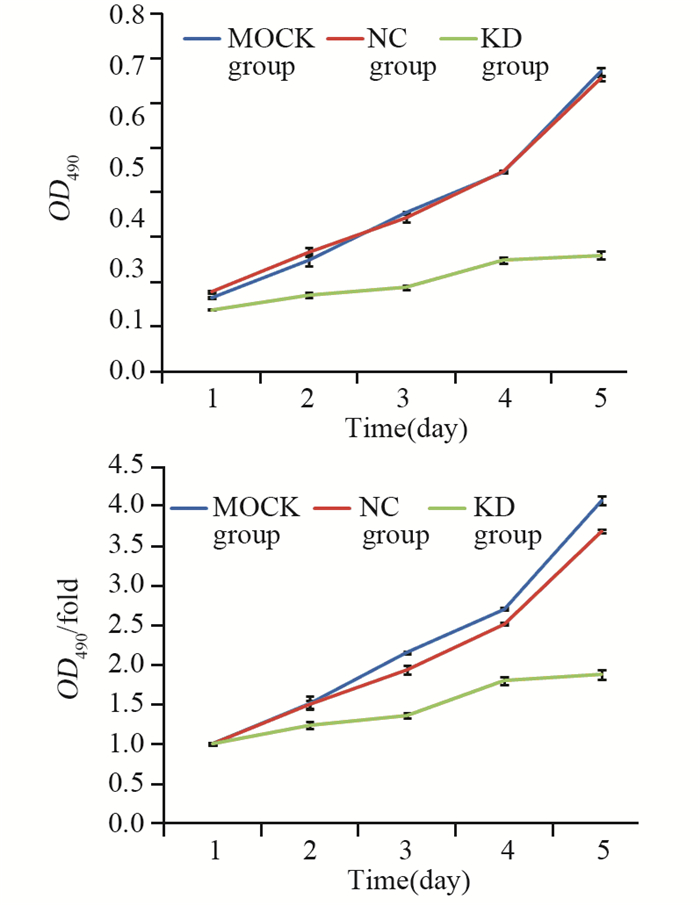
|
| OD490/fold was the relative multiple of d1-d5 OD490 to d1 OD490 in each experimental group 图 6 NTSR1对胃癌细胞增殖能力的影响 Figure 6 Effect of NTSR1 on proliferation of gastric cancer cells |
通过计算侵袭转移细胞数,转染shNTSR1的MKN-45细胞实验组孵育48 h后侵袭小室内的转移细胞数与对照组相比明显减少,差异具有统计学意义(P=0.0035),见图 7。证明NTSR1能促进MKN-45细胞的侵袭转移。
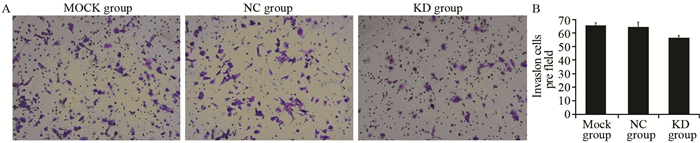
|
| 图 7 MKN-45细胞在各实验组中孵育48h后的转移细胞数(A)及柱形图(B) Figure 7 Comparison of metastatic MKN-45 cells number (A) and histogram (B) after incubation for 48h in each experimental group |
在MKN-45细胞中,RNA干扰NTSR1基因后,检测Cancer Phenotype信号通路中相关基因,其通路中p27Kip1蛋白的表达水平显著上调,同时,EGFR、HER2、EpCAM及Met也有较明显的下调趋势,见图 8。
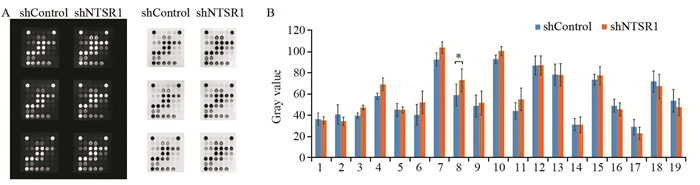
|
|
1. CD31(PECAM-1); 2: EpCAM; 3: Vimentin; 4: CD44; 5: CD45; 6: PCNA; 7: Ki-67; 8: p27Kip1; 9: E-Cadherin; 10: N-Cadherin; 11: VE-Cadherin; 12: MUC1; 13: Rb; 14: HIF-1a; 15: Survivin; 16: p53; 17: HER2/ErbB2; 18: Met; 19: EGF Receptor *: the expression of p27Kip1 in shNTSR1 group was significantly higher than that in shCtrl group (P=0.0399) 图 8 垫片的化学发光原始结果及灰度分析结果(A)及其统计图(B) Figure 8 Chemiluminescence and grayscale analysis results of gasket(A) and related statistical chart(B) |
本研究为明确NTSR1是否作用于胃癌细胞增殖及侵袭转移和可能的机制,选择高表达NTSR1胃癌细胞系MKN-45细胞,并建立稳定的NTSR1 shRNA胃癌细胞株,当NTSR1表达下调后,胃癌细胞的增殖倍数明显减慢,侵袭转移能力亦显著减弱,表明NTSR1能促进胃癌细胞的增殖及侵袭转移;进一步检测Cancer Phenotype信号通路中的19种相关基因(包括EGFR及HER2)表达发现,NTSR1表达下调后,p27Kip1蛋白表达显著上调,同时,EGFR、HER2、EpCAM及Met也有较明显的下调趋势,提示NTSR1可能是通过调控这几个基因的表达,以实现其在胃癌发生发展中的作用。
研究发现,NT/NTSR1可激活EGFR促进癌细胞分裂及生长。在结肠癌细胞系中,NT激活MAPK、Akt磷酸化及EGFR-MMPs活化[2]。NT可引发释放EGF样配体,与EGFR结合,激活下游MAPKs或PI3K/Akt介导信号通路,进一步磷酸化ERK1/2和Akt,从而作用于各种生长转录因子,调节细胞周期或增殖[7],或依赖PLC/PKC途径,使EGFR蛋白的Tyr845磷酸化,导致Stat5b转录或MAPKs通路的持续激活。NTSR1和EGFR系统之间通过放大一个共同的下游信号通路或者通过EGFR直接活化实现[8]。Younes等[3]研究肺癌发现,持续性刺激NTSR1使EGF样配体激活,导致自分泌或旁分泌性EGFR家族的结构激活,从而使EGFR、HER2与HER3过表达与活化。但三者的转录水平并没有改变,表明三者的合成-降解体系循环平衡在NT的作用下发生了变化,过表达的HER2胞内区域阻碍了活化的EGFR进入笼形蛋白包裹的小泡,并限制磷酸酶活性,使EGFR/HER2胞吞作用受损,溶酶体靶向作用也显著减弱,活化EGFR返回细胞表面的循环加快,EGF配体离解减少,使EGFR信号得以持续维持。本研究的免疫组织化学检测发现,NTSR1与EGFR/HER2之间存在显著正相关性,EGFR与HER2之间亦存在显著正相关性,干扰NTSR1基因表达后,EGFR及HER2蛋白表达均较明显减弱,说明NTSR1基因可能作用于后两者的表达,HER2和EGFR共表达形成异源性二聚体时,具有更高的再利用率、稳定性和转导信号的能力,本研究显示,EGFR和HER2可能共同参与了NTSR1对胃癌增殖侵袭的作用。
NTSR1基因与p27Kip1、EpCAM、Met的相关性还未见报道。在本研究中,p27Kip1表达显著受控于NTSR1表达。p27Kip1(p27或kip1)是细胞周期蛋白依赖性激酶抑制蛋白(CKI)家族成员之一,主要抑制细胞周期蛋白E(Cyclin E)-周期蛋白依赖性蛋白激酶2(CDK2)激酶复合物的生物活性,使细胞不能通过G1/S调控点,停滞于G1期,从而抑制细胞增殖[9-10]。p27阳性率降低与胃癌的进展期、浸润深度以及淋巴结转移有显著相关性[11]。EpCAM是一个细胞黏附分子,还参与细胞信号转导、细胞迁移、增殖和分化[12],也是一个肿瘤干细胞标志物,EpCAM蛋白的表达强度与胃癌的肿瘤部位、肿瘤大小、Lauren分型、浸润深度、淋巴结分期、TNM分期、淋巴结转移和远处转移密切相关,并与胃癌的生存率呈负相关性,siRNA下调EpCAM表达将显著抑制体外胃癌细胞的黏附、侵袭和迁移能力及体内胃癌细胞的转移能力[13-14]。c-Met为肝细胞生长因子受体,具有酪氨酸激酶活性,具有很强的促细胞增殖,诱导上皮细胞和成纤维细胞离散和运动的作用。它参与细胞信号转导、细胞骨架重建等,是调节细胞增殖、分化和修复过程的一个重要因子。胃癌组织中c-Met表达率较高,和胃癌侵袭、转移及预后差有关,c-Met信号活化主要是通过基因扩增导致过表达及激酶活化。约4%~10%的胃癌存在c-Met基因扩增,约50%的进展期胃癌存在c-Met过表达,而活化性c-Met基因突变很少见,其激活机制较复杂。c-Met信号激活与HER2靶向治疗的耐药也存在关联[15-16]。事实上,p27Kip1、EGFR、HER2、EpCAM及Met之间也存在着千丝万缕的联系[17-18],NTSR1基因可能是通过多维度作用于多种信号因子影响胃癌的增殖侵袭,但仍需要进行深入细致的进一步研究。
综上所述,NTSR1与胃癌的发生及侵袭转移密切相关,其可能是通过多维度调控下游信号因子(如EGFR/HER2、p27Kip1、EpCAM及Met)来参与胃癌的发生、增殖、侵袭、转移等过程。NTSR1可能是一个有效的靶向位点,NTSR1在肿瘤中过表达,靶向抑制可能主要抑制其有害的功能,从而有效减轻靶向治疗的不良反应,有可能为胃癌治疗开辟一条新途径。
| [1] | Zhou Z, Xie J, Cai Y, et al. The significance of NTR1 expression and its correlation with β-catenin and EGFR in gastric cancer[J]. Diagn Pathol, 2015, 10: 128. DOI:10.1186/s13000-015-0356-3 |
| [2] | Müller KM, Tveteraas IH, Aasrum M, et al. Role of protein kinase C and epidermal growth factor receptor signalling in growth stimulation by neurotensin in colon carcinoma cells[J]. BMC Cancer, 2011, 11: 421. DOI:10.1186/1471-2407-11-421 |
| [3] | Younes M, Wu Z, Dupouy S, et al. Neurotensin (NTS) and its receptor (NTSR1) causes EGFR, HER2 and HER3 over-expression and their autocrine/paracrine activation in lung tumors, confirming responsiveness to erlotinib[J]. Oncotarget, 2014, 5(18): 8252–69. |
| [4] | Alifano M, Souazé F, Dupouy S, et al. Neurotensin receptor 1 determines the outcome of non-small cell lung cancer[J]. Clin Cancer Res, 2010, 16(17): 4401–10. DOI:10.1158/1078-0432.CCR-10-0659 |
| [5] | Atmaca A, Werner D, Pauligk C, et al. The prognostic impact of epidermal growth factor receptor in patients with metastatic gastric cancer[J]. BMC Cancer, 2012, 12: 524. DOI:10.1186/1471-2407-12-524 |
| [6] | Yk W, Cf G, T Y, et al. Assessment of ERBB2 and EGFR gene amplification and protein expression in gastric carcinoma by immunohistochemistry and fluorescence in situ hybridization[J]. Mol Cytogenet, 2011, 4(1): 14. DOI:10.1186/1755-8166-4-14 |
| [7] | Amorino GP, Deeble PD, Parsons SJ. Neurotensin stimulates mitogenesis of prostate cancer cells through a novel c-Src/Stat5b pathway[J]. Oncogene, 2007, 26(5): 745–56. DOI:10.1038/sj.onc.1209814 |
| [8] | Moody TW, Chan DC, Mantey SA, et al. SR48692 inhibits non-small cell lung cancer proliferation in an EGF receptor-dependent manner[J]. Life Sci, 2014, 100(1): 25–34. DOI:10.1016/j.lfs.2014.01.072 |
| [9] | Hnit SS, Xie C, Yao M, et al. p27(Kip1) signaling: Transcriptional and post-translational regulation[J]. Int J Biochem Cell Biol, 2015, 68: 9–14. DOI:10.1016/j.biocel.2015.08.005 |
| [10] | Sharma SS, Pledger WJ. The non-canonical functions of p27(Kip1) in normal and tumor biology[J]. Cell Cycle, 2016, 15(9): 1189–201. DOI:10.1080/15384101.2016.1157238 |
| [11] | 吴梦莞, 郭丽红, 左强. p27kipl蛋白与胃癌曲妥珠单抗耐药的相关性[J]. 中南大学学报(医学版), 2016, 41(5): 471–6. [ Wu M, Guo L, Zuo Q. Correlation between cyclin-dependent kinase inhibitor p27kip1 and trastuzumab-resistance in gastric cancer[J]. Zhong Nan Da Xue Xue Bao (Yi Xue Ban), 2016, 41(5): 471–6. DOI:10.11817/j.issn.1672-7347.2016.05.004 ] |
| [12] | Martowicz A, Seeber A, Untergasser G. The role of EpCAM in physiology and pathology of the epithelium[J]. Histol Histopathol, 2016, 31(4): 349–55. |
| [13] | Toyoshima K, Hayashi A, Kashiwagi M, et al. Analysis of circulating tumor cells derived from advanced gastric cancer[J]. Int J Cancer, 2015, 137(4): 991–8. DOI:10.1002/ijc.v137.4 |
| [14] | Du W, Ji H, Cao S, et al. EpCAM: a potential antimetastatic target for gastric cancer[J]. Dig Dis Sci, 2010, 55(8): 2165–71. DOI:10.1007/s10620-009-1033-8 |
| [15] | Inokuchi M, Otsuki S, Fujimori Y, et al. Clinical significance of MET in gastric cancer[J]. World J Gastrointest Oncol, 2015, 7(11): 317–27. DOI:10.4251/wjgo.v7.i11.317 |
| [16] | Marano L, Chiari R, Fabozzi A, et al. c-Met targeting in advanced gastric cancer: An open challenge[J]. Cancer Lett, 2015, 365(1): 30–6. DOI:10.1016/j.canlet.2015.05.028 |
| [17] | Guan X. Cancer metastases: challenges and opportunities[J]. Acta Pharm Sin B, 2015, 5(5): 402–18. DOI:10.1016/j.apsb.2015.07.005 |
| [18] | Humphrey ES, Su SP, Nagrial AM, et al. Resolution of Novel Pancreatic Ductal Adenocarcinoma Subtypes by Global Phosphotyrosine Profiling[J]. Mol Cell Proteomics, 2016, 15(8): 2671–85. DOI:10.1074/mcp.M116.058313 |
 2018, Vol. 45
2018, Vol. 45


