文章信息
- NEK2在肿瘤治疗中的潜在作用
- Potential Therapeutic Uses of NEK2 in Cancers
- 肿瘤防治研究, 2018, 45(1): 37-40
- Cancer Research on Prevention and Treatment, 2018, 45(1): 37-40
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0628
- 收稿日期: 2017-06-05
- 修回日期: 2017-07-17
2. 215000 苏州,苏州大学公共卫生学院
2. School of Public Health, Soochow University, Suzhou 215000, China
NIMA激酶[1],是在丝状真菌-构巢曲霉中发现的一种苏氨酸/丝氨酸激酶,通过对纺锤体极的作用调节细胞周期。NEK(NIMA-related kinase)家族是在高等真核生物中发现的类似NIMA激酶的蛋白激酶家族,共有11个(NEK1~11)成员,其中NEK2是和NIMA同源性最高的一个成员[2]。NEK2在有丝分裂过程中也发挥重要的作用,具有调控中心体、纺锤体、染色体等功能,能推动细胞周期的正常进行。
NEK2的功能异常会造成中心体过度复制,纺锤体形成异常,染色体分离失误等有丝分裂障碍,从而产生非整倍体性或染色体不稳定性细胞,这些都是恶性肿瘤中最常见的现象,因此认为NEK2的功能异常可能与肿瘤的发生发展之间有一定的关系。本文拟对目前NEK2与肿瘤发生,以及NEK2在肿瘤治疗中的潜在作用作一综述。
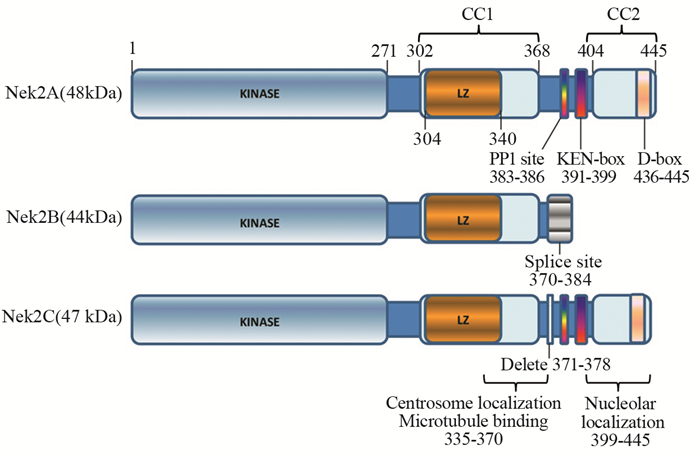
1 NEK2结构、定位及表达情况NEK2蛋白有3个剪接异构体,三者在结构上具有较高的同源性,氨基末端都是典型的丝氨酸/苏氨酸激酶区域,只在羧基末端存在一定的差异,见图 1。NEK2A在细胞核和细胞质中均有分布,NEK2B主要聚集在细胞质,而NEK2C只存在于细胞核[3]。研究发现NEK2在整个细胞周期中的表达量是不断变化的,在G1期不活跃,在S期和G2期增长,G2期达到高峰,主要在S期和G2期发挥作用[4]。
|
| Three splice variants of NEK2 had been described: NEK2A, NEK2B and NEK2C. The domain structures of these three proteins were shown relatively high homology, mainly including the relative positions of catalytic domain(KINASE), leucine zipper(LZ), coiled coil(CC), splice site, protein phosphatase-1(PP1) binding site, KEN-box, D-box, centrosome and microtubule localization, nucleolar localization. Numbers above and below the structures indicated amino acid positions 图 1 NEK2蛋白分子结构 Figure 1 NEK2 protein structure |
NEK2在细胞周期的调控过程中起着重要的作用,首先NEK2可以促进微管成核,形成正确的中心体,并维持中心体的稳定性。该功能主要通过与有丝分裂激酶(polo-like kinase 1,PLK1)的协同作用,加速γ-微管蛋白聚集,促进微管晶核的形成。研究发现在NEK2缺失的果蝇S2细胞内,中心粒极失去与γ-微管蛋白的结合能力,微管成核受到抑制,不能形成功能正常的中心体[5]。NEK2还可以通过作用于其互作蛋白(NEK2-interacting protein, NIP2)来调控微管的形态和功能,维持中心体的稳定性,避免中心体破裂[6]。
随着分裂的进行,在G2/M期NEK2可以作用于跨膜受体蛋白(dishevelled, DVL)促进Wnt/β-catenin信号通路的活化,继而调节中心体链接蛋白(centrosome-associated protein 1, C-Nap1)和小根蛋白的降解来调节亲代和子代中心粒之间的内聚力,启动中心粒的分离形成两级纺锤体,牵引染色体移向两极,使染色体均匀分布到两个子细胞中[7]。为使染色体精确分离,NEK2和癌症高表达蛋白1(high expression in cancer 1, Hec1)相互作用,召集有丝分裂阻滞缺陷蛋白1、2(mitotic arrest deficient 1, 2,Mad1, 2)复合物结合到动粒上,激活纺锤体检查点的APC-Cdc20途径调控染色体的精准分离,促进有丝分裂的精确进行[8]。
3 NEK2在人类肿瘤中的表达与作用 3.1 NEK2可能参与人类肿瘤发生发展过程肿瘤的形成是遗传和环境等因素共同作用的结果,是一个涉及到多基因、多通路和多分子作用的过程。现代分子生物学的不断发展使肿瘤的研究已经深入到基因和分子水平,很多研究发现染色体的非整倍性和不稳定性是肿瘤细胞中最常见的特征。
NEK2可以通过调控中心体的分离和纺锤体的形成使染色体精确的分离到两个子细胞中。因此,NEK2的异常表达将会对该过程造成损害,导致细胞分裂异常,在细胞中表现为不成熟的中心体过早分离,纺锤体形成异常,中心体过度复制及染色体分离异常等,这些异常都可以导致染色体的非整倍性和不稳定性。因此,有学者提出NEK2的异常表达可能是细胞恶化形成肿瘤细胞的重要推动力,与肿瘤的发生发展之间存在着一定的联系[9]。
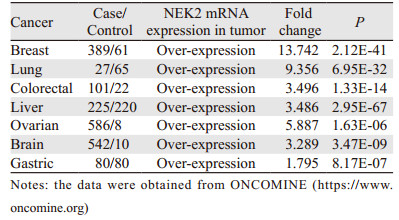
恶性肿瘤中NEK2表达增高的现象最早是在尤文氏瘤衍生细胞系中进行mRNA微点阵分析时发现的[10]。随后的研究发现,NEK2 mRNA和蛋白表达水平在人类多数癌症中都存在增高的现象。对Oncomine癌基因芯片数据库中几种人类常见的癌症进行分析,发现肿瘤组织较正常组织的NEK2 mRNA表达均明显增高,且两者之间的差异有统计学意义,见表 1。蛋白免疫印迹结果也显示在三种前列腺癌细胞中NEK2表达远远高于前列腺正常细胞[11];免疫组织化学结果显示40例肝癌患者的肿瘤组织中NEK2蛋白表达水平明显高于癌旁组织[12];有更多的研究显示,NEK2在人类多种癌症,包括非小细胞型肺癌[13-14]、骨髓瘤[9]、卵巢癌[15]、乳腺癌[16-17]、前列腺癌[11]、结肠直肠癌[18]、恶性外周神经鞘瘤[19]、肾细胞癌[16]、胰腺导管腺癌[20]等组织或细胞中的表达量比正常的组织或细胞的表达量增高。因此可以认为,NEK2在人类多数肿瘤中表达增高是一种普遍存在的现象。结合NEK2的异常表达会造成染色体不稳定性和非整倍体性这些在肿瘤细胞中最常见的现象,我们初步认为,NEK2高表达可能是促使肿瘤发生发展的一个重要因素。
肺癌是世界范围内死亡率很高的癌症,5年生存率只有16%,严重威胁人类的健康,寻找一种特异性强的肿瘤标志物是提高患者生存率的有效措施。Zhong等[13]对270份非小细胞型肺癌组织进行分析发现,NEK2的表达情况和已知的两种细胞增殖标志物MCM7和Ki67相类似,能够指示肿瘤细胞的增殖程度。统计学分析显示,NEK2表达量可以预示非小细胞型肺癌的分期程度、淋巴结转移能力,表达量越高则恶性程度越高。同时NEK2还可以作为一个预后标志,预测患者的5年生存率,两者间呈负相关,表达量高的患者总生存时间明显降低。另有研究得到了类似的结果,NEK2表达量高的前列腺癌患者肿瘤格里森分级高、侵袭转移能力强;在前列腺癌患者中,NEK2表达量升高的患者前列腺特异性抗原PSA(PSA是前列腺癌复发的一个标志)表达量越高,则患者复发的时间越短,两者间的关系存在统计学意义[11]。因此,NEK2可能是一个重要的肿瘤标志物,其表达量可以预示肿瘤增殖和预后情况,并指导医生做出更合适的临床决策,进而提高肿瘤的治疗效果。
3.3 NEK2可能是一个未来肿瘤治疗的靶点NEK2在人类多种癌症中的高表达现象,提示NEK2可以作为靶标对肿瘤进行分子治疗的可能性。Zeng等[11]通过在裸小鼠皮下注射前列腺癌细胞团建立的肿瘤模型发现,NEK2失活组裸小鼠形成的肿瘤尺寸明显小于对照组;Kokuryo等[21]也发现,抑制NEK2的表达可以抑制裸鼠皮下异种移植胰腺癌肿瘤模型的生长,延长腹膜内胰腺癌肿瘤异种移植模型裸鼠的生存时间,通过门静脉系统注射NEK2 siRNA可以有效阻止胰腺癌细胞的肝转移。细胞水平实验进一步验证了这一猜想,与正常的肝癌细胞HepG2相比,通过siRNA转染技术沉默NEK2表达的HepG2细胞有丝分裂周期受到影响,G1期发生了明显的阻滞,细胞周期不能正常进行,肿瘤细胞的生长受抑制,迁移能力和侵袭能力也受到抑制;在诱导凋亡实验中发现,消耗内生性的NEK2可以显著提高细胞凋亡的基础水平[9, 22]。在更多人类肿瘤的相关实验中也发现了下调NEK2的表达能够抑制肿瘤增殖,促进凋亡的现象。
NEK2在分子水平调控肿瘤细胞凋亡水平的有力证据是由Naro等[3]给出的,他们提出,NEK2是丝氨酸/精氨酸蛋白特异性激酶1(serine/arginine protein-specific kinase 1, SRPK1)的剪接因子激酶,能够激活丝氨酸/精氨酸富集剪接因子1(serine/arginine-rich splicing factor 1, SRSF1),SRSF1是位于细胞核内的一种原癌蛋白,通过影响PI3K-Akt-mTOR、Ras-MNK-MAPK及Wnt-β-catenin信号通路中相关基因的剪接方式发挥致癌作用。例如激活的SRSF1能够选择性剪接B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)基因家族的Bcl-x,提高抑制细胞凋亡剪接变体Bcl-xL的表达,抑制促进细胞凋亡的剪接变体Bcl-xS的表达,从而下调细胞的凋亡水平。在肿瘤细胞中高表达的NEK2会过量激活SRSF1,从而抑制细胞的凋亡能力,促进肿瘤细胞的生长。这些体内外实验的结果均证明了NEK2可能是今后肿瘤治疗的潜在作用靶点。
Oncotarget杂志报道的一种新型分子复合物MBM-5,可以干扰NEK2对细胞周期的调控作用,造成染色体分离失误,使细胞阻滞于G2期,从而引发细胞的凋亡。MBM-5通过干扰NEK2功能能够抑制白血病、胃癌、结肠癌、前列腺癌、乳腺癌、肝癌等多种肿瘤细胞的增殖能力,对胃肠道肿瘤细胞的抑制作用更明显,并能够高效地抑制胃肠道癌细胞的异种移植瘤生长[23]。该研究显示了以NEK2为分子靶标进行肿瘤治疗的可能性。
美国加利福尼亚大学的医学研究室发现的一种小分子抑制剂INH(inhibitor for NEK2 and hec1 binding)可以直接和癌症高表达蛋白1(highly expressed in cancer 1, Hec1)结合,阻止NEK2对Hec1 S165位点的磷酸化,诱导NEK2降解和Hec1失活,造成染色体分离失误,从而引起有丝分裂障碍,最终导致细胞死亡。在小鼠乳腺癌移植瘤模型部位注射INHs,能显著地抑制肿瘤生长并且没有明显的细胞毒副作用。因此这种INH的派生复合物有可能在今后被应用于肿瘤的临床治疗。
4 小结从目前的研究看来,NEK2作为一种重要的细胞周期蛋白,具有调控中心体的组装与分离、纺锤体的形成,染色体的精确分离等功能。因其在人类多种肿瘤中高表达的现象,引起了越来越多的关注,NEK2功能异常造成的染色体不稳定性可能是肿瘤发生发展的重要驱动力。同时,NEK2还可能成为肿瘤分化程度和预后检测的重要标志物,并且是癌症治疗的一个重要的潜在靶目标。对NEK2功能和机制的继续深入研究,将为NEK2在肿瘤临床的应用提供重要的依据。
| [1] | Moniz L, Dutt P, Haider N, et al. Nek family of kinases in cell cycle, checkpoint control and cancer[J]. Cell Div, 2011, 6: 18. DOI:10.1186/1747-1028-6-18 |
| [2] | Xia J, Franqui Machin R, Gu Z, et al. Role of NEK2A in Human Cancer and Its Therapeutic Potentials[J]. Biomed Res Int, 2015, 2015: 862461. |
| [3] | Naro C, Barbagallo F, Chieffi P, et al. The centrosomal kinase NEK2 is a novel splicing factor kinase involved in cell survival[J]. Nucleic Acids Res, 2014, 42(5): 3218–27. DOI:10.1093/nar/gkt1307 |
| [4] | Sedgwick GG, Hayward DG, Di Fiore B, et al. Mechanisms controlling the temporal degradation of NEK2A and Kif18A by the APC/C–Cdc20 complex[J]. EMBO J, 2013, 32(2): 303–14. DOI:10.1038/emboj.2012.335 |
| [5] | Prigent C, Glover DM, Giet R. Drosophila NEK2 protein kinase knockdown leads to centrosome maturation defects while overexpression causes centrosome fragmentation and cytokinesis failure[J]. Exp Cell Res, 2005, 303(1): 1–13. |
| [6] | Jeong Y, Lee J, Kim K, et al. Characterization of NIP2/centrobin, a novel substrate of NEK2, and its potential role in microtubule stabilization[J]. J Cell Sci, 2007, 120(Pt12): 2106–16. |
| [7] | Cervenka I, Valnohova J, Bernatik O, et al. Dishevelled is a NEK2 kinase substrate controlling dynamics of centrosomal linker proteins[J]. Proc Natl Acad Sci U S A, 2016, 113(33): 9304–9. DOI:10.1073/pnas.1608783113 |
| [8] | Hu CM, Zhu J, Guo XE, et al. Novel small molecules disrupting Hec1/NEK2 interaction ablate tumor progression by triggering NEK2 degradation through a death-trap mechanism[J]. Oncogene, 2015, 34(10): 1220–30. DOI:10.1038/onc.2014.67 |
| [9] | Zhou W, Yang Y, Xia J, et al. NEK2 induces drug resistance mainly through activation of efflux drug pumps and is associated with poor prognosis in myeloma and other cancers[J]. Cancer Cell, 2013, 23(1): 48–62. DOI:10.1016/j.ccr.2012.12.001 |
| [10] | Burger PE, Xiong X, Coetzee S, et al. Sca-1 expression identifies stem cells in the proximal region of prostatic ducts with high capacity to reconstitute prostatic tissue[J]. Proc Natl Acad Sci U S A, 2005, 102(20): 7180–5. DOI:10.1073/pnas.0502761102 |
| [11] | Zeng YR, Han ZD, Wang C, et al. Overexpression of NIMA-related kinase 2 is associated with progression and poor prognosis of prostate cancer[J]. BMC Urol, 2015, 15(1): 90. DOI:10.1186/s12894-015-0085-7 |
| [12] | Zhang MX, Xu XM, Zhang P, et al. Effect of silencing NEK2 on biological behaviors of HepG2 in human hepatoma cells and MAPK signal pathway[J]. Tumor Biol, 2016, 37(2): 2023–35. DOI:10.1007/s13277-015-3993-y |
| [13] | Zhong X, Guan X, Liu W, et al. Aberrant expression of NEK2 and its clinical significance in non-small cell lung cancer[J]. Oncol Lett, 2014, 8(4): 1470–76. DOI:10.3892/ol.2014.2396 |
| [14] | Zhong X, Guan X, Dong Q, et al. Examining NEK2 as a better proliferation marker in non-small cell lung cancer prognosis[J]. Tumour Biol, 2014, 35(7): 7155–62. DOI:10.1007/s13277-014-1935-8 |
| [15] | Liu X, Gao Y, Lu Y, et al. Upregulation of NEK2 is associated with drug resistance in ovarian cancer[J]. Oncol Rep, 2014, 31(2): 745–54. DOI:10.3892/or.2013.2910 |
| [16] | Lee J, Gollahon L. NEK2-targeted ASO or siRNA pretreatment enhances anticancer drug sensitivity in triplenegative breast cancer cells[J]. Int J Oncol, 2013, 42(3): 839–47. DOI:10.3892/ijo.2013.1788 |
| [17] | Lee J, Gollahon L. Mitotic perturbations induced by NEK2 overexpression require interaction with TRF1 in breast cancer cells[J]. Cell Cycle, 2013, 12(23): 3599–614. DOI:10.4161/cc.26589 |
| [18] | Neal CP, Fry AM, Catherine M, et al. Overexpression of the NEK2 kinase in colorectal cancer correlates with beta-catenin relocalization and shortened cancer-specific survival[J]. J Surg Oncol, 2014, 110(7): 828–38. DOI:10.1002/jso.v110.7 |
| [19] | Stricker TP, Henriksen KJ, Tonsgard JH, et al. Expression profiling of 519 kinase genes in matched malignant peripheral nerve sheath tumor/plexiform neurofibroma samples is discriminatory and identifies mitotic regulators BUB1B, PBK and NEK2 as overexpressed with transformation[J]. Mod Pathol, 2013, 26(7): 930–43. DOI:10.1038/modpathol.2012.242 |
| [20] | Ning Z, Wang A, Liang J, et al. Abnormal expression of NEK2 in pancreatic ductal adenocarcinoma: a novel marker for prognosis[J]. Int J Clin Exp Pathol, 2014, 7(5): 2462–9. |
| [21] | Kokuryo T, Hibino S, Suzuki K, et al. NEK2 siRNA therapy using a portal venous port-catheter system for liver metastasis in pancreatic cancer[J]. Cancer Sci, 2016, 107(9): 1315–20. DOI:10.1111/cas.12993 |
| [22] | Wang S, Li W, Liu N, et al. NEK2A contributes to tumorigenic growth and possibly functions as potential therapeutic target for human breast cancer[J]. J Cell Biochem, 2012, 113(6): 1904–14. DOI:10.1002/jcb.v113.6 |
| [23] | Fang Y, Kong Y, Xi J, et al. Preclinical activity of MBM-5 in gastrointestinal cancer by inhibiting NEK2 kinase activity[J]. Oncotarget, 2016, 7(48): 79327–41. |
 2018, Vol. 45
2018, Vol. 45