文章信息
- 35例食管腺样囊性癌的临床特征及预后分析
- Clinical Characteristics and Prognostic Factors of 35 Patients with Esophagus Adenoid Cystic Carcinoma Patients
- 肿瘤防治研究, 2018, 45(4): 237-241
- Cancer Research on Prevention and Treatment, 2018, 45(4): 237-241
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0627
- 收稿日期: 2017-10-05
- 修回日期: 2018-02-02
腺样囊性癌(adenoid cystic carcinoma, ACC)是唾腺肿瘤常见的组织学类型,最常见于涎腺,其次是气管、支气管、鼻咽等处[1]。食管来源的腺样囊性癌十分罕见,1954年Gregg等首次报道[2],国外文献报告食管腺样囊性癌(esophagus adenoid cystic carcinoma, EACC)约占食管肿瘤0.04%~0.16%[3]。目前国内报道寥寥,检索到的文献中多为个案报道或小样本病例。本研究回顾性分析35例EACC的临床病理资料,并结合文献分析其临床特征、诊断治疗以及预后影响因素,以提高对EACC的认识,现报道如下。
1 资料与方法 1.1 临床资料收集1991年1月—2015年12月在河北医科大学第四医院行根治性手术切除并经病理确诊的原发性EACC病例,入组总病例数为35例,占我院同期食管癌手术患者的0.22%,占同期食管腺癌手术患者的9.84%。本研究通过我院医学伦理委员会批准,且术前均已签署知情同意书。
1.2 方法完整记录所有入组患者的基本信息、治疗手段及生存时间等临床资料。肿瘤分级、TNM分期按照国际抗癌联盟(UICC)2009年第七版食管腺癌分期标准。统计分析35例EACC患者的年龄、性别、症状、术前诊断、手术方式及临床病理特征,术后以电话或复诊的方式随访,每6月进行1次,随访终点为死亡、失访或生存至截止日期,随访期间的失访者算作删失值。观察EACC患者术后复发、转移及生存情况,并探究各临床病理因素与预后的关系。
1.3 统计学方法所有数据采用SPSS21.0统计学软件进行分析。计量资料以(x±s)表示,采用t检验。Kaplan-Meier法计算生存率,并绘制生存曲线,差异比较使用Log rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 EACC的临床资料本组患者男性28例,女性7例,男女比例为4:1;发病年龄41~71岁,平均年龄(60.6±6.39)岁;病程1~6月不等,患者起始症状常与食管鳞状细胞癌相似,其中48.6%(17/35)的患者出现吞咽困难,5例出现呕吐或恶心,4例出现胸骨后或上腹部疼痛,3例出现上腹饱胀不适,1例出现黑便,5例无明显临床症状,体检行胃镜发现。42.9%(15/35)患者有10年以上烟和(或)酒嗜好,28.6%(10/35)亲属中有肿瘤家族史,其中食管癌或贲门癌占60%(6/10),见表 1。
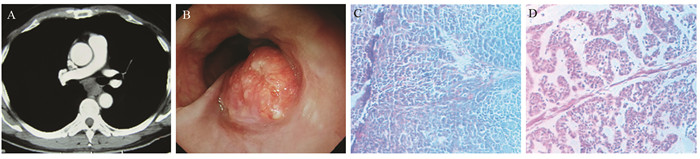
EACC病变部位以食管中段最多见,占60.0%(21/35),胸上段4例,胸下段10例,无颈部食管发病病例。本组采用胸腔镜食管癌切除6例,经左胸后外侧切口食管癌切除22例(62.9%)(其中主动脉弓上吻合17例),经胸、腹二切口食管癌切除4例,经颈、胸、腹三切口食管癌切除、食管胃颈部吻合3例。EACC术前通过X线造影、CT及胃镜诊断,其中11例(31.4%)确诊腺样囊性癌,6例诊断为腺癌,8例误诊为鳞状细胞癌,2例误诊为小细胞癌,3例误诊为食管黏液表皮样癌,5例可见癌细胞,类型未确定,见表 1、图 1。35例EACC肿瘤标志物CEA血清浓度术后1周(2.25±1.65)较术前(3.6±5.40)降低,但两组间差异无统计学意义(t=1.573, P=0.172),SCC-Ag血清浓度手术前后无明显变化(0.88±0.54)vs.(0.92±0.39),t=0.379, P=0.586。
|
| C: HE ×100; D: HE ×400 图 1 食管腺样囊性癌的CT(A)、电子胃镜(B)及组织病理学表现(C, D) Figure 1 Image of CT(A), electronic endoscopy(B) and histopathological performance(C, D) of EACC |
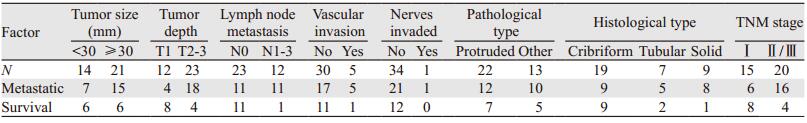
本研究35例患者术后均经病理确诊为EACC。肉眼病理形态以蕈伞型多见,12例,其次为息肉型10例,髓质型7例,溃疡型4例,缩窄型2例。肿瘤组织学分型以筛状型为主,19例,其次为实性型9例,腺管状型7例;肿瘤长度1.0~7.2 cm,其中 < 3 cm 14例,3~5 cm 14例,> 5 cm 7例;肿瘤侵犯黏膜及黏膜下层12例、浅肌层5例、深肌层7例、纤维膜11例;35例EACC患者均同期行淋巴清扫,淋巴结切除8~15枚,平均10.2枚,12例患者淋巴结病理组织切片为阳性,淋巴结转移率为34.3%(12/35),4例N1,6例N2,2例N3,转移部位以食管旁、隆突下区域多见,其中1例上段EACC患者仅伴有胃左区域的淋巴结转移。1例晚期EACC患者可见神经受侵;脉管瘤栓患者5例,占总例数14.3%,见表 1。
2.3 EACC的预后本研究25年间断随访,截至2016年7月随访全部结束,观察患者术后生存情况,见表 2。结果示:22例(62.9%)EACC患者术后复发转移,其中局部复发5例(14.3%),远处转移17例(48.6%),其中肺部及肝转移共11例(占总例数的31.4%、远处转移的64.7%)、骨转移l例、淋巴结转移5例。最短复发时间为手术后5月,最长的为术后随访9年无复发转移。35例EACC患者的中位生存期为38月,1、3、5年生存率分别为88.1%、46.6%和27.1%,35例患者存活12例,死亡23例,其中因肿瘤复发或转移而死亡的有19例(占总例数的54.3%),3例死于心脑血管疾病,1例死于肺部疾病。
|
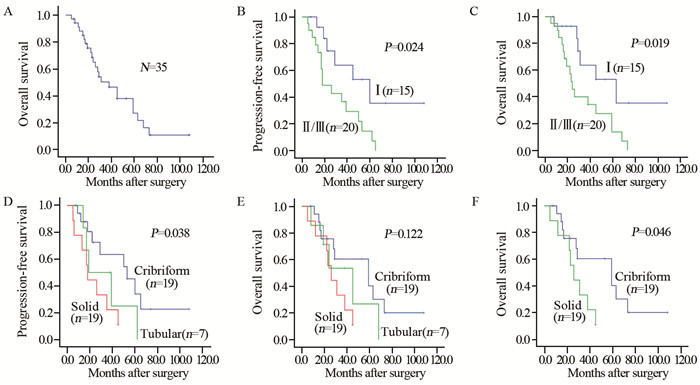
Kaplan-Meier单因素生存分析显示:肿瘤位置、肿瘤大小、浸润深度、淋巴结转移、TNM临床分期与EACC患者的总生存率显著相关(P < 0.05);组织类型,脉管瘤栓、肿瘤大小、浸润深度、淋巴结转移、TNM临床分期与EACC患者的无进展生存率显著相关(P < 0.05),见表 3。其中Ⅰ期患者预后显著好于Ⅱ/Ⅲ期患者,组织病理实性型的预后明显低于经典筛状型,差异均有统计学意义(P < 0.05),见图 2。
|
| 图 2 35例食管腺样囊性癌患者的总生存曲线(A)、不同分期生存曲线(B, C)及不同组织病理类型生存曲线(D, E, F) (n=35) Figure 2 OS curve(A), survival curves for TNM stage(B, C) and histological type(D, E, F) in EACC patients (n=35) |
本研究分析了我院近25年间行手术治疗食管癌患者,发现35例EACC,占同期食管腺癌患者的9.84%,同期食管癌患者的0.22%,发病率与国内文献报道一致[4-5],但高于国外文献报告,可能与太行山区食管癌发病率高、饮食种类及习惯有别于西方人有关。本组资料显示EACC以老年男性多见,平均年龄60.6岁,与Petnrsson[6]报道一致。其中42.9%的患者有10年以上烟和(或)酒嗜好,肿瘤家族史高达28.6%(10/35),食管癌或贲门癌占60%,可能与本地区肿瘤家族聚集以及男性患者烟、酒嗜好者多于女性有关。
EACC临床表现及影像学检查常缺乏特异性,起始症状常与食管鳞癌相似[7],病变早期患者多无明显临床症状。本组资料显示腺样囊性癌好发于食管中段,下段亦较多,病理形态以蕈伞型和息肉型最常见,与文献报道[8]一致。EACC术前确诊较困难,多误诊为食管平滑肌瘤、基底细胞样鳞癌、腺癌等[9],误诊率高达78.4%[10]。随着免疫组织化学技术发展,EACC确诊率不断提高,Sawada等[10]报道的26例EACC患者,确诊11例(42.3%)。本组35例EACC患者术前确诊11例,确诊率为31.4%。EACC误诊率高与其病理特征有关,有学者[11]认为EACC起源于食管黏膜下的腺体,瘤组织沿食管黏膜上皮下延伸生长,并向食管腔内隆起,但不侵犯鳞状上皮层,内镜下肿瘤组织活检困难,难以反映肿瘤组织的特征性结构,只有当肿瘤组织细胞分化好,形态学典型时才易确诊。肿瘤标志物CEA和SCC-Ag检测已被广泛的应用于临床,对于食管鳞癌、腺癌的诊断和治疗均有一定的指导意义,但本文检测的几项指标尚不能反映EACC的临床情况,还需进一步研究。
目前尚没有详细的EACC治疗路径及规范,文献报道[12]EACC的治疗方式以手术切除为主,对于选择何种手术方式,目前无明确定论,多采取常规开胸切除。本文35例EACC患者行不同路径开胸切除29例,取得良好的临床疗效,其中左开胸食管胃主动脉弓上吻合术占48.6%(17/35),与我院多采用经左胸单切口手术方式有关。随着腔镜诊疗技术的发展,EACC手术方式变得多样化,对于早期EACC内镜下切除可作为一种简便有效的治疗方法[13-14]。Sawada等[10]报道胸腔镜治疗高龄EACC患者,取得了较好临床效果。本研究显示肿瘤位于食管黏膜或黏膜下层的EACC早期患者,腔镜手术在肿瘤切除、淋巴结清扫及预后同样达到开胸手术的效果。目前放化疗对于EACC的治疗作用仍存在争议[15],随着生物分子靶向药物治疗的研究进展,Jensen和De Dosso等[16-17]报道EACC应用西妥昔单抗联合放化疗治疗肿瘤获得客观缓解。我们认为EACC治疗以根治性的外科手术切除为主,并综合考虑肿瘤的分期及患者的全身情况选择适宜治疗方式[18]。
原发性EACC在组织病理学上与涎腺的腺样囊性癌相似,分为三种类型:筛状、腺管状或实性巢状。本研究结果显示,实性型腺样囊性癌与经典筛状型相比,更具侵袭性,易发生复发转移,两者复发转移率分别为88.9%和47.4%(P < 0.05),提示EACC组织学类型与肿瘤复发转移密切相关,与李兆丽[19]报道一致。但是,关于EACC生物学行为国内外学者意见不一[1, 9, 20],本组资料显示35例患者的淋巴结转移率为34.3%(12/35),其中1例食管上段癌患者伴有胃左区域的淋巴结转移,提示EACC淋巴结转移也可以是跳跃性的,与Epstein等[1]报道一致。本研究发现脉管瘤栓高达14.3%,多见于中晚期患者,与肿瘤复发转移密切相关。李兆丽等[19]报道EACC与涎腺腺样囊性癌常有神经侵犯不同,神经受侵率低,本研究35例中仅有1例Ⅲ期患者神经受侵,与文献报道一致。
复发转移是影响EACC患者术后存活及生活质量的主要因素,文献报道EACC比其他类型的癌症易发生淋巴结、肺、骨和肝远处转移[21],EACC临床确诊后平均生存期为7月[1],手术切除后平均生存期也仅为9月[8]。本组资料随访显示:因肿瘤复发或转移而死亡的患者占总例数的54.3%。术后中位生存期38月,1、3年生存率分别为88.1%和46.6%,患者短期生存期高于文献报道,可能与本组病例多为早期患者,而患者5年长期生存率仅为27.1%,与肿瘤生物学特征易侵袭、转移有关。本研究发现:Ⅰ期患者生存率高达53.3%,Ⅱ/Ⅲ期生存率仅为20%,二者差异有统计学意义(P < 0.05)。其中部分患者获得长期生存,最长术后随访9年无复发转移,可能原因是:患者已行根治性手术切除,筛状型肿瘤组织细胞分化好,病变较小并局限于黏膜下,无淋巴结转移及脉管侵犯。因此,早期发现、早期治疗能够提高EACC患者的生存率。
总之,EACC是一种罕见的食管恶性肿瘤,需经病理组织学确诊,临床生物学行为变异难测,易局部侵袭及远处转移,预后不良,手术切除是首选的治疗方法。
| [1] | Epstein JI, Sears DL, Tucker RA, et al. Carcinoma of the esophagus with adenoid cystic differentiation[J]. Cancer, 1984, 53(5): 1131–6. DOI:10.1002/(ISSN)1097-0142 |
| [2] | Gregg JB, Stander FW. Unusual neoplasms of the esophagus: review of literature and report of a case[J]. AMA Arch Otolaryngol, 1954, 59(2): 159–69. DOI:10.1001/archotol.1954.00710050171005 |
| [3] | Karaoglanoglu N, Eroglu A, Turkyilmaz A, et al. Oesophageal adenoid cystic carcinoma and its management options[J]. Int J Clin Pract, 2005, 59(9): 1101–3. DOI:10.1111/ijcp.2005.59.issue-9 |
| [4] | 文载律, 罗伟, 李文才, 等. 食管腺癌77例临床病理分析[J]. 诊断病理学杂志, 2002, 9(3): 173–4. [ Wen ZL, Luo W, Li WC, et al. Primary adenocarcinoma of the esophagus: a clinicopathological analysis of 77 cases[J]. Zhen Duan Bing Li Xue Za Zhi, 2002, 9(3): 173–4. ] |
| [5] | 王军, 李娜, 王雪锋, 等. 食管腺癌临床病理特征及其淋巴结转移的影响因素[J]. 中华肿瘤杂志, 2016, 38(7): 515–20. [ Wang J, Li N, Wang XF, et al. Esophageal adenocarcinoma: the clinicopathologic features, patterns of lymph node metastasis and its influencing factors[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(7): 515–20. ] |
| [6] | Petnrsson SR. Adenoid cystic carcinoma of the esophagus: Complete response to combination chemotherapy[J]. Cancer, 1986, 57(8): 1464–7. DOI:10.1002/(ISSN)1097-0142 |
| [7] | 江文洋, 付向宁, 付圣灵, 等. 食管腺样囊性癌1例报道[J]. 华中科技大学学报(医学版), 2012, 41(1): 115–6. [ Wang WY, Fu XN, Fu SL, et al. A case of adenoid cystic carcinoma of the esophagus[J]. Huazhong Ke Ji Da Xue Xue Bao(Yi Xue Ban), 2012, 41(1): 115–6. ] |
| [8] | Morisaki Y, Yoshizumi Y, Hiroyasu S, et al. Adenoid cystic carcinoma of the esophagus: report of a case and review of the Japanese literature[J]. Surg Today, 1996, 26(12): 1006–9. DOI:10.1007/BF00309962 |
| [9] | 杜艳, 赵华, 张智弘, 等. 食管腺样囊性癌临床病理学观察[J]. 中华病理学杂志, 2015, 44(1): 27–31. [ Du Y, Zhao H, Zhang ZH, et al. Clinicopathologic observation of adenoid cystic carcinoma of esophagus[J]. Zhonghua Bing Li Xue Za Zhi, 2015, 44(1): 27–31. ] |
| [10] | Sawada G, Moon J, Saito A, et al. A case of adenoid cystic carcinoma of the esophagus[J]. Surg Case Rep, 2015, 1(1): 119. DOI:10.1186/s40792-015-0122-5 |
| [11] | Sweeney EC, Cooney T. Adenoid cystic carcinoma of the esophagus: a light and electron microscopic study[J]. Cancer, 1980, 45(6): 1516–25. DOI:10.1002/(ISSN)1097-0142 |
| [12] | 孙桂娟, 廖谦和, 徐丹. 食管腺样囊性癌1例报道[J]. 诊断病理学杂志, 2017, 24(2): 134–5. [ Sun GJ, Liao QH, Xu D. A case of adenoid cystic carcinoma of the esophagus[J]. Zhen Duan Bing Li Xue Za Zhi, 2017, 24(2): 134–5. ] |
| [13] | Na YJ, Shim KN, Kang MJ, et al. Primary esophageal adenoid cystic carcinoma[J]. Gut Liver, 2007, 1(2): 178–81. DOI:10.5009/gnl.2007.1.2.178 |
| [14] | 张璐, 吕宾, 范一宏, 等. 胃镜下切除食管腺样囊性癌一例[J]. 中华消化内镜杂志, 2009, 26(5): 276–7. [ Zhang L, Lyv B, Fan YH, et al. A case of the esophagus adenoid cystic carcinoma by endoscopic resection[J]. Zhonghua Xiao Hua Nei Jing Za Zhi, 2009, 26(5): 276–7. ] |
| [15] | 何粉玲, 晏培松, 步雪, 等. 食管原发性腺样囊性癌的临床病理分析[J]. 世界肿瘤杂志, 2007, 6(2): 118–9. [ He FL, Yan PS, Bu X, et al. Clinicopathological analysis on primary adenoid cystic carcinoma of esophagus[J]. Shijie Zhong Liu Za Zhi, 2007, 6(2): 118–9. ] |
| [16] | Jensen AD, Krauss J, Weichert W, et al. RadioImmunotherapy for adenoid cystic carcinoma: a single-institution series of combined treatment with cetuximab[J]. Radiat Oncol, 2010, 5: 102. DOI:10.1186/1748-717X-5-102 |
| [17] | De Dosso S, Mazzucchelli L, Ghielmiui M, et al. Response to oxaliplatin with cetuximab in minor salivary gland adenoid cystic carcinoma[J]. Tumori, 2009, 95(3): 378–81. DOI:10.1177/030089160909500319 |
| [18] | 孙丕云, 王仁生. 腺样囊性癌的碳离子治疗[J]. 肿瘤防治研究, 2017, 44(12): 855–60. [ Sun PY, Wang RS. Carbon ion Radiotherapies for adenoid cystic carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(12): 855–60. DOI:10.3971/j.issn.1000-8578.2017.17.0265 ] |
| [19] | 李兆丽, 王辉, 谢军. 食管腺样囊性癌的临床病理学特征[J]. 诊断病理学杂志, 2016, 23(12): 953–5. [ Li ZL, Wang H, Xie J. Clinicopathological of primary adenoid cystic carcinoma of esophagus[J]. Zhen Duan Bing Li Xue Za Zhi, 2016, 23(12): 953–5. DOI:10.3969/j.issn.1007-8096.2016.12.016 ] |
| [20] | 原和平, 丁悌. 原发性食管腺癌外科治疗的远期疗效[J]. 肿瘤研究与临床, 1996, 8(1): 21–3. [ Yuan HP, Ding T. Long term outcome of surgical treatment of primary esophageal adenocarcinoma[J]. Zhong Liu Yan Jiu Yu Lin Chuang, 1996, 8(1): 21–3. ] |
| [21] | Karaoglanoglu N, Eroglu A, Turkyilmaz A, et al. Oesophageal adenoid cystic carcinoma and its management options[J]. Int J Clin Pract, 2005, 59(9): 1101–3. DOI:10.1111/ijcp.2005.59.issue-9 |
 2018, Vol. 45
2018, Vol. 45