文章信息
- 99mTc-3PRGD2分子显像在评估重组内皮抑素疗效中的价值
- Clinical Value of 99mTc-3PRGD2 Molecular Image in Evaluating Effect of Recombinant Endostatin
- 肿瘤防治研究, 2018, 45(5): 306-310
- Cancer Research on Prevention and Treatment, 2018, 45(5): 306-310
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0596
- 收稿日期: 2017-05-27
- 修回日期: 2017-09-29
放射性核素标记的肿瘤特异性高表达受体示踪剂在肿瘤的早期发现、早期诊断发挥着独特的优势。以整合素αvβ3为靶点的肿瘤新生血管显像,是当今肿瘤分子显像的热点之一。整合素(integrin)是一组跨膜糖蛋白,由一个α亚单位和β亚单位通过非共价键组成的异二聚体,其中整合素αvβ3能够高表达于新生血管内皮细胞表面以及多种恶性肿瘤细胞表面,而在正常组织细胞、成熟血管内皮细胞表面几乎不表达,并且与肿瘤血管生成、血管密度密切相关,重要的是它能与含精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)的多肽序列及其衍生物特异性结合。99mTc-HYNIC-PEG4-E[PEG4-c(RGDfk)]2(简称99mTc-3PRGD2)作为放射性核素标记RGD二聚体,结构上通过PEG4基团修饰和Hynic偶联完成99mTc的标记,动物实验显示其在脑胶质瘤、肺癌等肿瘤部位的分布显著高于RGD单体[1-2],且我们前期研究证实其可用于肺癌及其骨转移的早期发现和诊断[3]。
血管靶向联合化疗在非小细胞肺癌(non-small cell lung cancer, NSCLC)尤其是非鳞癌患者获得无进展生存期(progression-free survival, PFS)及总生存期(overall survival, OS)的改善。目前对于血管靶向治疗的疗效判断主要通过随访获得患者的OS或PFS来评价,而此时患者肿瘤已经进展甚至死亡,临床上缺乏一种可靠的评价血管靶向药物疗效的指标。本研究旨在观察99mTc-3PRGD2分子显像在评估重组人内皮抑素(恩度)抗肺癌肿瘤血管的临床疗效,同时观察该分子显像对于预测患者预后方面的作用。
1 资料与方法 1.1 研究对象 1.1.1 纳入标准(1)临床确诊为ⅢB~Ⅳ期的非鳞癌NSCLC,初治或者为术后转移,经病理或细胞学证实;(2)有客观可评价病灶,无颅内转移;(3)年龄在18~80岁之间;(4)预计生存时间 > 3月;(5)三月内无内脏活动性出血病史。
1.1.2 一般资料本研究筛选了从2012年10月至2016年5月在南京医科大学附属南京医院呼吸科住院治疗的80例肺癌患者,剔除不符合入组的8例患者后共计72例患者入组,其中单纯化疗组(对照组)有36例,恩度联合化疗组(观察组)有36例;收集两组患者入组前基线信息,年龄、性别,病理类型、PS评分等;入组的患者都曾在本院接受过每3月1次的随访,最后1例疾病进展的随访时间是2017年3月。
1.2 研究方法 1.2.1 治疗方案和SPECT-CT显像检查时间点治疗方案分为2组:对照组(单纯化疗组):培美曲塞0.5 g/m2 D1联合顺铂75 mg/m2 D1;观察组(恩度联合化疗组):培美曲塞0.5 g/m2 D1联合顺铂75 mg/m2 D1,恩度15 mg,D1~D14。在治疗前及4周期后分别进行SPECT-CT显像检查。
1.2.2 99mTc-3PRGD2的制备和SPECT-CT显像(single-photon emission computed tomography- computed tomography)显像分析:取1~1.5 ml放射性高锝酸钠溶液(Na99mTcO4, 1110 MBq/ml,南京安迪科有限公司提供),加入Hynic-3P-RGD试剂盒(法国ABX公司),振荡混匀,沸水浴加热30 min,通过无菌滤膜后用0.9%氯化钠溶液稀释备用,以上所有操作均在放射性药物四类实验室内完成,无菌无热源,通过放射性HPLC测定放射化学纯度达到99%。仪器采用西门子公司SPECT-诊断级CT(Symbia型),患者显像前排空小便,静脉注射后(555 MBq)1 h行全身平面显像和胸部融合显像。
SPECT-CT显像由至少3名有经验的核医学科医生共同阅片,观察肺部病变对99mTc-3PRGD2的摄取情况和解剖结构变化,在SPECT-CT融合图像上对病变部位逐层勾画感兴趣区((ROI),T),以对侧相同体积正常肺组织作为对照(N),计算病灶和正常肺组织对99mTc-3P-RGD2的摄取比值(T/N)。
1.3 统计学方法采用SPSS21.0进行统计学分析,两组患者基线一致性验证采用T-test或Chi-square test。采用Kaplan-Meier绘制PFS生存曲线, Log rank比较组间差异对两组患者99mTc-3PRGD2 SPECT/CT显像T/N值前后变化差值与患者PFS进行线性相关检验。P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者基线信息比较对照组和观察组的平均年龄比较差异无统计学意义(P=0.613)。统计学分析其他可能对患者接受不同治疗后的预后产生影响的因素:性别、吸烟史、病理类型、疾病分期以及PS评分,两组比较,差异均无统计学意义,提示两组患者基线信息基本一致,具有可比性,见表 1。

|
对照组和观察组在治疗前T/N值比较,差异无统计学意义(P=0.764);经过4周期治疗后:对照组T/N值与治疗前比较,差异无统计学意义(P=0.073),而观察组治疗后的T/N值为(3.84±1.14),与治疗前比较,差异有统计学意义(P < 0.001),见图 1、表 2。

|
| A: CT imaging before treatment; B: CT imaging after four cycles of endostar plus chemotherapy treatment; C: metabolic image of 99mTc-3PRGD2 before treatment; D: metabolic image of 99mTc-3PRGD2 after four cycles of endostar plus chemotherapy treatment 图 1 观察组患者治疗前及4周期恩度联合化疗后SPECT-CT显像图 Figure 1 SPECT-CT imaging of patients in observation group before treatment and after four cycles of endostar combination chemotherapy |

|
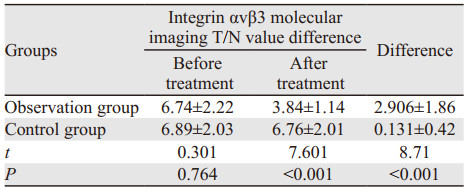
两组治疗前后T/N值的差值比较,差异具有统计学意义(P < 0.001)。观察组在接受治疗后肺部靶病灶99mTc-3PRGD2 SPECT/CT显像T/N值显著下降,见表 3。
|
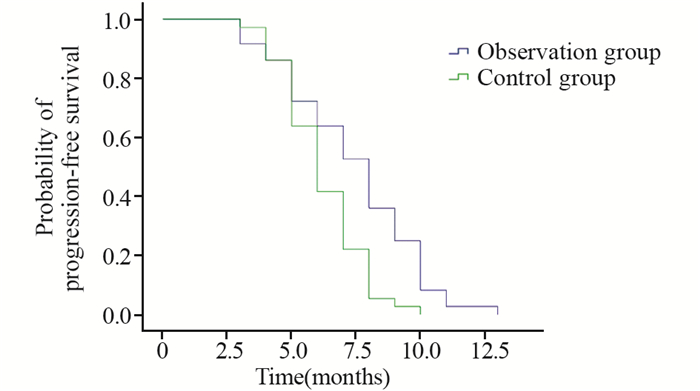
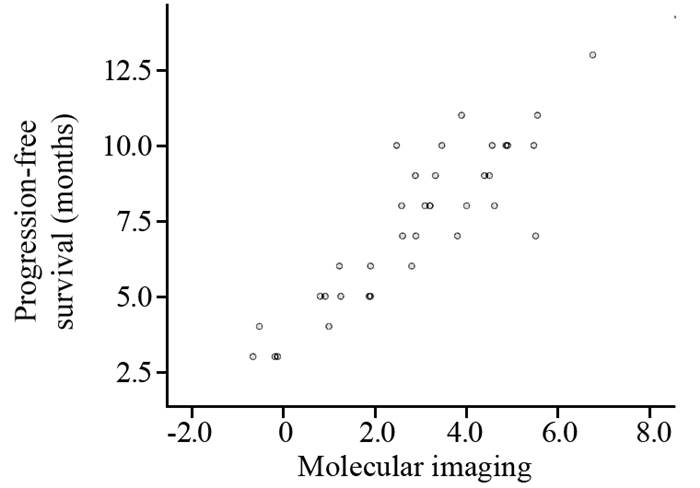
Kaplan-Meier生存分析后发现对照组的mPFS为(6.194±0.26)月,观察组的mPFS为(7.417±0.42)月,两组比较差异有统计学意义(P=0.003),接受恩度联合化疗相对于单纯化疗的患者临床获益增加,见图 2。进一步研究两组患者治疗前后T/N值的差值与患者的PFS相关性后发现:对照组在治疗前后T/N值的差值与患者的PFS无明显相关性(r=0.057, P=0.743),见图 3;而观察组治疗前后T/N值的差值与患者的PFS具有相关性(r=0.879, P < 0.001),见图 4。
|
| 图 2 观察组与对照组患者无疾病进展Kaplan-Meier生存曲线分析 Figure 2 Kaplan-Meier survival curves of progression-free survival in observation and control groups |

|
| 图 3 对照组患者治疗前后分子显像数值变化与PFS的相关性 Figure 3 Correlation of PFS with integrin αvβ3 molecular imaging T/N value difference before and after treatment in control group |
|
| 图 4 观察组患者治疗前后分子显像数值变化与PFS的相关性 Figure 4 Correlation of PFS with integrin αvβ3 molecular imaging T/N value difference before and after treatment in observation group |
肿瘤早期的生长并不伴有新生血管的生成,而是处于无血管期状态,当肿瘤生长至l~2 mm后,则依赖于新生血管供给营养和氧气[4]。由于肿瘤血管的杂乱无章,导致肿瘤组织缺乏血供,引起缺氧和酸中毒,使化疗药物在肿瘤组织区域不能达到有效浓度,是化疗疗效下降的重要机制[5-6]。
血管靶向治疗作用于肿瘤血管,动物实验研究表明内皮抑素干预后肺癌小鼠肿瘤组织内血管密度明显降低,血管生长受到抑制,血管壁的通透性恢复正常,上述作用的最终结果是恢复肿瘤组织内血管正常化,一方面抑制肿瘤的生长,同时提高化疗药物在肿瘤组织内的浓度促进药效发挥[7]。恩度是一种人源化的抗血管生成药物,它通过抑制肿瘤血管内皮细胞生长,阻断肿瘤新生血管的形成和肿瘤细胞的扩散,切断肿瘤细胞血液的供应,使肿瘤细胞营养缺失而抑制萎缩消失。临床试验显示,恩度与抗肿瘤方案联合使用,可明显提高NSCLC患者的临床缓解率,显著延长中位生存期[8]。恩度的联合应用使得患者的ORR(overall response rate)达到77%,1、2、3年生存率分别达到75%、67%及51%[9]。本研究也证实恩度联合化疗组的PFS明显优于单纯化疗组。
目前临床上用于评估抗肿瘤血管生成疗效的观测指标主要以影像学靶病灶的大小为依据,不能显示抗肿瘤血管的效能。有学者应用增强CT技术评估恩度的抗肿瘤血管的疗效,发现在2周期治疗后肺部靶病灶血管灌注时间、灌注容积等指标,恩度联合化疗组较单纯化疗组均明显下降,但该研究所所测定指标缺乏客观性,操作时间过长,临床操作性较差[10]。
整合素αvβ3是调控肿瘤血管生成的重要蛋白分子,其参与肿瘤血管生成的机制是通过特异性识别细胞外基质中含有RGD序列的蛋白和多肽, 在血管内皮细胞激活、增殖、凋亡和迁移过程中的多个环节发挥重要作用,并且能够与多种血管生成促进因子的共同作用促进血管的生成。整合素αvβ3在正常组织或血管内皮细胞低表达或不表达,而在新生血管内皮细胞表面及多种恶性肿瘤如食管癌、肺癌、乳腺癌等恶性肿瘤细胞表面均可高表达,其与肿瘤表面血管的形成、侵袭和转移密切相关[11]。3PRGD2显像较传统的影像学更好地显示肿瘤血管的生长状态,可以早期评估抗肿瘤治疗的临床效果。Zhang等在EGFR-TKI治疗42天复查3PRGD2显像,以T/N值下降23.8%为临界值,发现T/N值下降 > 23.8%患者的PFS为18月,而T/N值≤23.8%一组患者的PFS仅为7月,他们认为3PRGD2显像数值与肿瘤血管生成密切相关,而对于T/N值下降较高者提示肿瘤血管受到明显抑制,患者的预后更佳[12]。同样也有研究证实99mTc-3PRGD2显像在化疗联合贝伐单抗两个疗程后T/N值出现明显下降,并且发现T/N值下降与临床疗效呈正相关[13]。本研究也发现T/N值下降幅度与PFS正相关,提示99mTc-3PRGD2显像可以提示患者的预后。
本研究采用的99mTc-3PRGD2显像相对于传统的18F-FDG显像在显示肿瘤血运转移、纵隔淋巴结转移等方面具有更多优势,同时99mTc-3PRGD2显像的T/N值与肿瘤微血管密度正相关[14]。本研究发现经过4周期治疗后观察组与对照组99mTc-3PRGD2显像的T/N值下降分别为(2.906±1.86)与(0.131±0.42),表明恩度的联合应用明显使肿瘤组织血管密度改变,血管增生减少,从而减缓肿瘤病灶的进展;同时我们发现在观察组中T/N值下降患者的PFS明显延长并且呈正相关(r=0.879),提示肿瘤血管生长得到抑制导致临床获益,证明恩度联合化疗可以通过抗肿瘤血管生成发挥作用。
抗肿瘤血管治疗联合放化疗可以明显改善晚期肺癌患者的预后,而血管生成相关性整合素αvβ3的表达与肿瘤血管的生长密切相关,而肿瘤血管的生长与患者的预后密切相关。99mTc-3PRGD2显像作为一种新型的分子标志物能够较准确地反应肿瘤血管的生长情况。在肿瘤患者的治疗过程中99mTc-3PRGD2分子显像通过无创性检测可以较好地反应肿瘤血管生长状态,对于评估抗肿瘤血管的治疗提供相对准确的参考,同时显像T/N值的改变与患者的预后密切相关,本研究为99mTc-3PRGD2显像应用于肿瘤抗血管疗效评估提供理论支撑。
| [1] | Zhou Y, Kim YS, Chakraborty S, et al. 99mTc-labeled cyclic RGD peptides for noninvasive monitoring of tumor integrin αVβ3 expression[J]. Mol Imaging, 2011, 10(5): 386–97. |
| [2] | Wang L, Shi J, Kim YS, et al. Improving tumor-targeting capability and pharmacokinetics of (99m)Tc-labeled cyclic RGD dimers with PEG(4) linkers[J]. Mol Pharm, 2009, 6(1): 231–45. DOI:10.1021/mp800150r |
| [3] | Shao G, Gu W, Guo M, et al. Clinical study of 99mTc-3P-RGD2 peptide imaging in osteolytic bone metastasis[J]. Oncotarget, 2017, 8(43): 75587–96. |
| [4] | Khawar IA, Kim JH, Kuh HJ, et al. Improving drug delivery to solid tumors: priming the tumor microenvironment[J]. J Control Release, 2015, 201: 78–89. DOI:10.1016/j.jconrel.2014.12.018 |
| [5] | Tan Q, Saggar JK, Yu M, et al. Mechanisms of drug resistance related to the microenvironment of solid tumors and possible strategies to inhibit them[J]. Cancer J, 2015, 21(4): 254–62. DOI:10.1097/PPO.0000000000000131 |
| [6] | Jayson GC, Kerbel R, Ellis LM, et al. Antiangiogenic therapy in oncology: current status and future directions[J]. Lancet, 2016, 388(100043): 518–29. |
| [7] | Zhang ZY, Chen LL, Xu W, et al. Effects of silencing endothelin-1 on invasion and vascular formation in lung cancer[J]. Oncol Lett, 2017, 13(6): 4390–6. DOI:10.3892/ol.2017.6027 |
| [8] | Han B, Xiu Q, Wang H, et al. A multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy of paclitaxel-carboplatin alone or with endostar for advanced non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(6): 1104–9. DOI:10.1097/JTO.0b013e3182166b6b |
| [9] | Bao Y, Peng F, Zhou QC, et al. Phase Ⅱ trial of recombinant human endostatin in combination with concurrent chemoradiotherapy in patients with stage Ⅲ non-small-cell lung cancer[J]. Radiother Oncol, 2015, 114(2): 161–6. DOI:10.1016/j.radonc.2014.11.039 |
| [10] | Zhang FL, Gao EY, Shu RB, et al. Human Recombinant Endostatin Combined with Cisplatin Based Doublets in Treating Patients with Advanced NSCLC and Evaluation by CT Perfusion Imaging[J]. Asian Pac J Cancer Prev, 2015, 16(15): 6765–8. DOI:10.7314/APJCP.2015.16.15.6765 |
| [11] | Yan F, Xu X, Chen Y, et al. A Lipopeptide-Based alphavbeta(3) Integrin-Targeted Ultrasound Contrast Agent for Molecular Imaging of Tumor Angiogenesis[J]. Ultrasound Med Biol, 2015, 41(10): 2765–73. DOI:10.1016/j.ultrasmedbio.2015.05.023 |
| [12] | Zhang Z, Zhao X, Ding C, et al. (99m)Tc-3PRGD2 SPECT/CT imaging for monitoring early response of EGFR-TKIs therapy in patients with advanced-stage lung adenocarcinoma[J]. Cancer Biother Radiopharm, 2016, 31(7): 238–45. DOI:10.1089/cbr.2016.2052 |
| [13] | Ma Q, Min K, Wang T, et al. (99m)Tc-3PRGD2 SPECT/CT predicts the outcome of advanced nonsquamous non-small cell lung cancer receiving chemoradiotherapy plus bevacizumab[J]. Ann Nucl Med, 2015, 29(6): 519–27. DOI:10.1007/s12149-015-0975-5 |
| [14] | Jin X, Liang N, Wang M, et al. Integrin imaging with 99mTc-3PRGD2 SPECT/CT shows high specificity in the diagnosis of lymph node metastasis from non-small cell lung cancer[J]. Radiology, 2016, 281(3): 958–66. DOI:10.1148/radiol.2016150813 |
 2018, Vol. 45
2018, Vol. 45


