文章信息
- 组蛋白去乙酰化酶抑制剂SAHA与紫杉醇联用诱导宫颈癌HeLa细胞凋亡的实验
- Combination of SAHA and Paclitaxel Induce Apoptosis of Human Cervical Cancer HeLa Cells
- 肿瘤防治研究, 2018, 45(6): 371-375
- Cancer Research on Prevention and Treatment, 2018, 45(6): 371-375
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0562
- 收稿日期: 2017-05-22
- 修回日期: 2017-08-04
2. 518020 深圳,深圳市罗湖区人民医院妇科;
3. 518060 深圳,深圳大学生命科学与海洋学院;
4. 518060 深圳,深圳大学医学部基础医学院生理学教研室
2. Department of Gynecology, Shenzhen Luohu People's Hospital, Shenzhen 518020, China;
3. College of Life Sciences and Oceanography, Shenzhen University, Shenzhen 518060, China;
4. Department of Physiology, School of Basic Medical Sciences, Shenzhen University Health Sciences Center, Shenzhen 518060, China
辛二酸苯胺异羟肟酸(SAHA,商品名伏立诺他)属于Ⅱa型组蛋白脱乙酰基酶抑制(HDACi),是一类新的抗肿瘤药物。组蛋白去乙酰化酶(HDCA)的功能异常与肿瘤的发生、发展有直接关系,研究发现在多种肿瘤中均发现了HDAC表达的改变,如胃癌、乳腺癌、胰腺癌、直肠癌、前列腺癌和肝癌等[1]。SAHA是第一个被美国FDA批准用于治疗T细胞型淋巴瘤的组蛋白去酰化酶抑制剂。前期动物实验和早期临床试验证实SAHA能够有效抑制肿瘤新生血管生成,诱导细胞凋亡和阻滞细胞周期[2-4]。紫杉醇是目前临床上常用的肿瘤化疗药物,紫杉醇能够识别有丝分裂特定分裂周期的微管蛋白特性,并与这种微管蛋白上的特异性位点结合,抑制了微管蛋白的解聚能力和癌细胞的有丝分裂。有研究发现SAHA和紫杉醇联合使用能够增强对卵巢癌的抑制效果[5]。体外和体内实验结果表明,多西他赛能够和SAHA协同作用,诱导Bcl-2家族蛋白和微管蛋白的表达从而通过胞内和胞外的凋亡途径诱导前列腺癌细胞的死亡[6-7]。
本研究拟在体外探讨SAHA与紫杉醇联用对宫颈癌细胞凋亡和周期的影响,从而为宫颈癌临床治疗方案中SAHA与紫杉醇联合用药提供参考。
1 材料与方法 1.1 材料 1.1.1 细胞株本实验所用人宫颈癌HeLa细胞来源于深圳大学医学院王晓梅教师课题组。
1.1.2 实验材料胎牛血清、DMEM培养液购自美国康宁公司,细胞级DMSO购自美国Life公司、MTT粉末、SAHA购自美国Gibco公司、紫杉醇购自美国Selleck公司,细胞凋亡检测试剂盒购自北京全式金生物技术有限公司,细胞周期检测试剂盒购自杭州联科生物有限公司。
1.2 方法 1.2.1 细胞培养人宫颈癌细胞HeLa接种于100 ml培养瓶中,用含10%的胎牛血清、10 000 u/L的青霉素和0.1 g/L的链霉素的DMEM培养液培养,置于37℃、5%CO2的恒温培养箱培养,待细胞长满70%~80%培养瓶时,用含0.25%EDTA的胰酶进行消化、计数、传代。
1.2.2 MTT测定HeLa细胞增殖活力胰蛋白酶消化培养细胞5 min后,见细胞变圆收缩,加入含10%FBS DMEM培养液终止消化,吹打细胞至完全分散为单细胞悬液,培养液定容后计数细胞,接种于96孔培养板(1×104个/孔)。将培养板移入CO2恒温培养箱,在37℃、5%CO2及饱和湿度条件下培养12 h后弃上清液,分别加入含SAHA(10 μmol/L)、紫杉醇(10 nmol/L)和SAHA(10 μmol/L)+紫杉醇(10 nmol/L)的DMEM培养液120 μl。并设立对照组,对照组只加入120 μl的空白培养液。每个浓度设立6个复孔,继续将培养板移入培养箱中培养24、48 h后分别每孔加入5 g/L MTT 20 μl,继续培养4 h后,吸去上清液,加入150 μl的DMSO溶液,振荡培养板10 min,用酶标仪检测490 nm处吸光度,测量每孔吸光度值(OD),计算细胞抑制率。抑制率=100%-(OD实验组/OD对照组)×100%。
两种药物联合使用药效计算公式:Q=E(AB)/[(EA+EB)-EA×EB],其中EA表示药物A的抑制率,EB表示药物B的抑制率,E(AB)表示二者联合使用时的抑制率,Q > 1.5为协同作用,0.85 < Q < 1.5为相加作用,Q < 0.85拮抗作用。
1.2.3 流式细胞术检测HeLa细胞凋亡率取对数生长期的HeLa细胞,用胰蛋白酶消化培养细胞,待细胞变圆收缩,加入含10%FBS的DMEM培养液终止消化,吹打细胞至完全分散为单细胞悬液,培养液定容后计数细胞,接种于6孔板中(2×106个/孔),将6孔板移入培养箱中培养12 h。12 h后弃去上清液,分别加入含有SAHA(10 μmol/L)、紫杉醇(10 nmol/L)和SAHA(10 μmol/L)+紫杉醇(10 nmol/L)的DMEM培养液120 μl。并设立对照组,对照组只加入120 μl的空白培养液。将6孔板移入培养箱中培养24 h后进行细胞凋亡检测,采用北京全式金生物技术有限公司的细胞凋亡检测试剂盒对上机前样品处理(TransDetect Annexin V-FITC/PI Cell Apoptosis Detection Kit),具体操作步骤按照试剂盒说明书进行,完成后上机检测。
1.2.4 流式细胞术检测HeLa细胞的细胞周期收获经不同实验组处理24 h的HeLa细胞进行细胞周期检测,采用杭州联科生物的细胞周期检测试剂盒(Cell Cycle Staining Kit)对上机前样品处理,离心去除上清液,轻弹管壁,使沉淀的细胞团重新悬浮于残余液体中,分别加入1 ml常温灭菌的PBS溶液。将细胞缓慢加入至3 ml的-20℃的无水乙醇中,于4℃冰箱固定过夜。800 r/min离心5 min,弃去无水乙醇,再加入3 ml灭菌的PBS溶液,常温下放置15 min,使细胞再次水化。800 r/min离心5 min,弃去上清液。加入1 ml DNA染色液,涡旋振荡5~10 s,完全混匀。室温下避光孵育30 min后用流式细胞仪检测HeLa细胞周期。
1.3 统计学方法采用SPSS16.0软件进行统计学分析,分析值比较采用单因素方差分析,实验结果以均数±标准差表示,Student’s t检验,P < 0.05为差异有统计学意义。
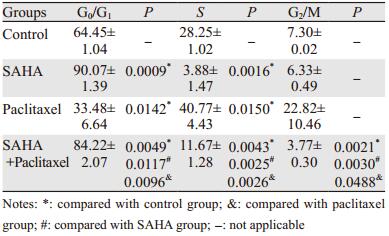
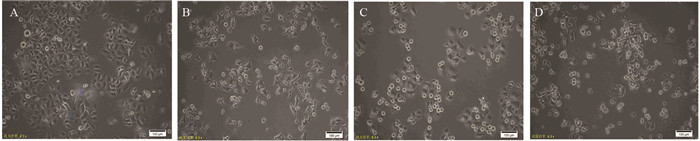
2 结果 2.1 SAHA和紫杉醇联合使用对HeLa细胞增殖的抑制作用SAHA单独作用24 h后的HeLa细胞形态呈梭形,见图 1B,紫杉醇单独作用24 h后的HeLa细胞形态呈圆皱形,见图 1C,SAHA和紫杉醇联合用药处理的HeLa细胞兼具两者单独使用的特点,见图 1D,且单独紫杉醇组和联合用药组均出现较多漂浮的HeLa细胞。HeLa细胞24 h的抑制率分别为紫杉醇组(25.14±1.83)%、SAHA组(46.19±2.13)%、SAHA+紫杉醇联合用药组(51.59±1.30)%。48 h的细胞存活率分别为紫杉醇组(29.57±1.63)%、SAHA组(65.69±1.56)%、SAHA+紫杉醇联合用药组(77.2±1.37)%。SAHA与紫杉醇联合用药组24和48 h的细胞增殖抑制率高于单独紫杉醇组(P=0.00028, P=0.00011)和SAHA组(P=0.11089, P=0.00036),差异具有统计学意义,见图 2。随着时间的延长,SAHA组和SAHA与紫杉醇联合用药组的抑制效果也逐渐增强。根据金式公式计算发现,当作用24 h时,SAHA与紫杉醇具有相加作用(Q=0.861),随着作用时间的延长,当作用48 h后(Q=1.25),两者仍为相加作用。由此可知,SAHA与紫杉醇联合使用能够更好的抑制HeLa细胞的增殖。
|
| A: control group; B: SAHA group; C: paclitaxel group; D: SAHA+paclitaxel group; bar=100 μm 图 1 不同实验作用24 h后HeLa细胞的形态 Figure 1 Morphology of HeLa cells after different experiments for 24h |
|
| ***: P < 0.001, compared with SAHA+paclitaxel group; ###: P < 0.01, compared with SAHA+paclitaxel group; n=4 图 2 SAHA与紫杉醇联合对HeLa细胞增殖抑制的作用 Figure 2 Inhibitory effect of SAHA combined with paclitaxel on proliferation of HeLa cells |
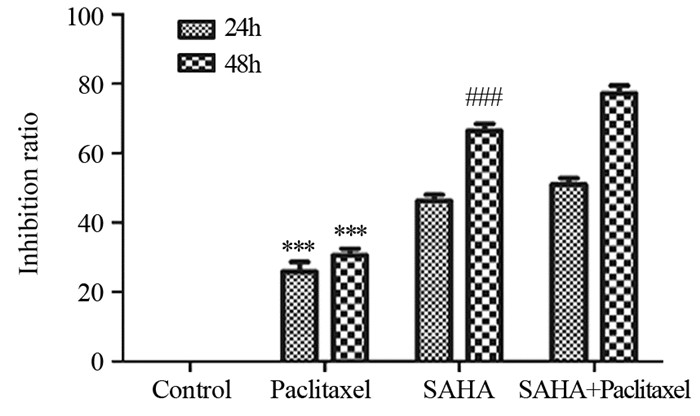
SAHA组、紫杉醇组及SAHA+紫杉醇联合用药组的HeLa细胞的凋亡率分别为(6.44±0.86)%、(7.23±1.49)%和(16.22±3.38)%,均高于对照组的(5.14±0.44)%(P=0.0333, P=0.0765, P=0.0227);且联合用药组HeLa细胞的凋亡率分别高于紫杉醇组、SAHA组(P=0.01435, P=0.0214),见图 3。表明紫杉醇和SAHA均能诱导HeLa细胞的凋亡,但两者联合可以显著增加HeLa细胞的凋亡率,从而提高诱导HeLa细胞凋亡的能力。
|
| *: compared with control group; #: compared with SAHA group; &: compared with paclitaxel group 图 3 不同实验处理后HeLa细胞的流式图(A)和凋亡率(B) Figure 3 Flow pattern of cell apoptosis(A) and apoptotic rate(B) of HeLa cells after different experimental treatments |
SAHA组作用24 h后HeLa细胞周期阻滞于G0/G1期(90.07±1.39)%、S期(3.88±1.47)%,紫杉醇组作用24 h后HeLa细胞周期阻滞于G0/G1期(33.48±6.64)%、S期(40.77±4.43)%,SAHA+紫杉醇联合用药组作用24 h后HeLa细胞周期阻滞于G0/G1期(84.22±2.07)%、S期(11.67±1.28)%,三组比较差异有统计学意义,见表 1、图 4。G0/G1期和S期均为细胞有丝分裂过程中DNA复制时期,因此,SAHA与紫杉醇联用更能抑制HeLa细胞有丝分裂过程中的DNA合成。SAHA与紫杉醇联用组的HeLa细胞中存在大量的多倍体(图 4中黄色部分),而二者单独使用组均没有出现多倍体,见图 4,说明SAHA与紫杉醇联用能够抑制HeLa细胞有丝分裂过程中的DNA复制。
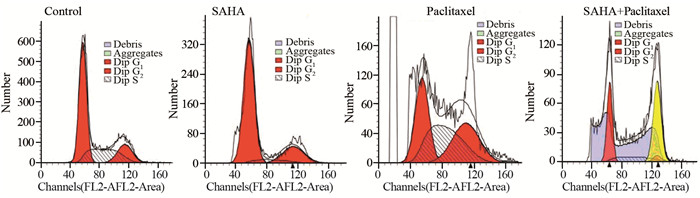
|
| 图 4 不同实验处理后HeLa细胞周期流式图 Figure 4 Flow pattern of HeLa cell cycle after different experimental treatments |
目前,随着表观遗传学在肿瘤领域研究的不断深入,组蛋白乙酰化酶抑制剂(HDACi)作为一种高效低毒的靶向性抗肿瘤药物已经引起人们的广泛关注。目前已有HDACi上市,如伏立诺他(SAHA)和曲古菌素A(TSA)作为治疗药物在临床中得到了应用。其他更多的HDACi,如MS275、LBH589和PXD101等,则正在进行相应的临床前的研发阶段[8]。
本研究结果显示,SAHA与紫杉醇联合使用能够显著抑制HeLa细胞的增殖,当处理24 h时,二者具有相加作用,随着作用时间的延长,当处理48 h后,两者虽仍为相加作用,但Q值逐渐变大,接近协同作用。HeLa细胞凋亡实验结果表明,SAHA与紫杉醇联合使用能够显著增强诱导HeLa细胞的凋亡能力。流式细胞术检测HeLa细胞周期发现SAHA与紫杉醇联合使用能够显著降低G2的细胞数量,增加G1期和S期的细胞数量。细胞在G1期合成RNA和核糖体,S期为DNA合成阶段,主要合成DNA和组蛋白,G1期和S期为细胞有丝分裂过程中DNA合成和复制时期,细胞处于G2期时DNA合成终止,但大量合成RNA及蛋白质,包括微管蛋白等。G1期和S期细胞数量增多,表明细胞DNA的合成和复制受到抑制,不足以支持向下一个周期转进。Saelen等研究发现SAHA与卡培他滨联合使用辅以放射线能够有效抑制结直肠癌细胞增殖,并在结直肠癌的移植动物模型中显著抑制体内肿瘤生长[9]。Hwang等研究发现SAHA与多西他赛协同作用,诱导前列腺癌细胞的死亡[6]。
本研究对于SAHA和紫杉醇联合诱导宫颈癌细胞HeLa凋亡的分子机制研究尚不深入,有待进一步研究。猜测可能原因是SAHA和紫杉醇的作用位点不一致,SAHA靶向作用于细胞核中染色体上的组蛋白,而紫杉醇的作用位点位于细胞质的微管和微丝,由于作用位点的不一样而具有一定的互补性,从而起到协同作用。总之,SAHA与紫杉醇联合作用于宫颈癌HeLa细胞时,通过抑制细胞增殖,诱导细胞凋亡,阻滞细胞周期,从而增强抗肿瘤的能力。
| [1] | Spiegel S, Milstien S, Grant S. Endogenous modulators and pharmacological inhibitors of histone deacetylases in cancer therapy[J]. Oncogene, 2012, 31(5): 537–51. DOI:10.1038/onc.2011.267 |
| [2] | 檀琼, 刘全海. 组蛋白去乙酰化酶抑制剂的研究进展[J]. 世界临床药物, 2010, 31(10): 616–20. [ Tan Q, Liu QH. Progress on histone deacetylase inhibitors[J]. Shi Jie Lin Chuang Yao Wu, 2010, 31(10): 616–20. ] |
| [3] | Marks PA. Discovery and development of SAHA as an anticancer agent[J]. Oncogene, 2007, 26(9): 1351–6. DOI:10.1038/sj.onc.1210204 |
| [4] | Hagelkruys A, Sawicka A, Rennmayr M, et al. The biology of HDAC in cancer: the nuclear and epigenetic components[J]. Handb Exp Pharmacol, 2011, 206: 13–37. DOI:10.1007/978-3-642-21631-2 |
| [5] | Fabregat I. Dysregulation of apoptosis in hepatocellular carcinoma cells[J]. World J Gastroenterol, 2009, 15(5): 513–20. DOI:10.3748/wjg.15.513 |
| [6] | Hwang JJ, Kim YS, Kim MJ, et al. Histone deacetylase inhibitor potentiates anticancer effect of docetaxel via modulation of Bcl-2 family proteins and tubulin in hormone refractory prostate cancer cells[J]. J Urol, 2010, 184(6): 2557–64. DOI:10.1016/j.juro.2010.07.035 |
| [7] | Fitzpatrick JM, de Wit R, et al. Taxane Mechanisms of Action: Potential Implications for Treatment Sequencing in Metastatic Castration-resistant Prostate Cancer[J]. Eur Urol, 2014, 65(6): 1198–204. DOI:10.1016/j.eururo.2013.07.022 |
| [8] | Dickinson M, Johnstone RM, Prince HM. Histone deacetylase inhibitors: potential targets responsible for their anti-cancer effect[J]. Invest New Drugs, 2010, 28(Suppl 1): S3–20. |
| [9] | Saelen MG, Ree AH, Kristian A, et al. Radiosensitization by the histone deacetylase inhibitor vorinostat under hypoxia and with capecitabine in experimental colorectal carcinoma[J]. Radiat Oncol, 2012, 7: 165. DOI:10.1186/1748-717X-7-165 |
 2018, Vol. 45
2018, Vol. 45