文章信息
- 胃肠胰神经内分泌肿瘤的最新共识
- Research Progress of Gastroenteropancreatic Neuroendocrine Neoplasm
- 肿瘤防治研究, 2018, 45(1): 41-46
- Cancer Research on Prevention and Treatment, 2018, 45(1): 41-46
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0491
- 收稿日期: 2017-05-04
- 修回日期: 2017-08-02
2. 510282 广州,南方医科大学珠江医院普外科
2. Department of General Surgery, Zhujiang Hospital, Southern Medical University , Guangzhou 510282, China
神经内分泌肿瘤(neuroendocrine tumor, NET)是起源于弥散神经内分泌系统的具有异质特性的肿瘤,进展缓慢,通常确诊时已发生转移,若能早期发现并诊断可显著改善患者预后。
NET可发生于口腔、食管、胃、胰腺、肠道等消化腺甚至整个神经内分泌系统,好发于胃、肠、胰腺,最常见累及的部位是胰腺。胃肠胰腺神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasm, GEP-NEN)从功能上可分为功能性和无功能性两大类。其中功能性肿瘤可以分泌相关物质从而表现出相应的临床症状,如胃泌素瘤、胰岛素瘤、胰高血糖素瘤、血管活性肠肽(vasoactive intestinal peptide, VIP)瘤等。无功能性肿瘤占GEP-NEN的绝大多数,以占位性病变为主。过去一直认为GEP-NEN为罕见病,但最近流行病学调查显示GEP-NEN患者人数稳定上升,有学者认为可能是胃肠镜的广泛应用提高了GEP-NEN的检出率。
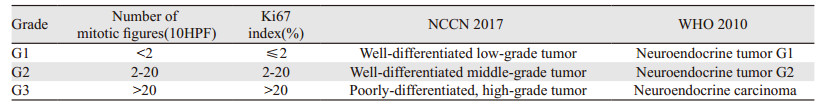
1 分型与分级进展不同时期GEP-NEN的分类有所不同,目前被广泛运用于临床的是世界卫生组织(WHO)(2010年)消化系统肿瘤分类标准,其根据分化程度将GEP-NEN分为:(1)神经内分泌肿瘤G1期(类癌);(2)神经内分泌肿瘤G2期;(3)神经内分泌癌(大细胞型或小细胞型)G3期;(4)混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC);(5)增生和瘤前病变。并根据Ki67阳性指数以及核分裂相数对NET进行分级[1-3]:(1)G1:核分裂相 < 2个/10HPF,Ki67≤2%;(2)G2:核分裂相2~20个/10HPF,Ki67:2%~20%;(3)G3:核分裂相 > 20个/10HPF,Ki67 > 20%。
美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)肿瘤学临床实践指南(2017版)中的分级标准与WHO(2010年)分级标准并无明显差异[4]:(1)G1期:分化好的低级别肿瘤;(2)G2期:分化好的中间级别肿瘤;(3)G3期:分化差的高级别肿瘤。其与核分裂相与Ki67的关系同WHO的分类标准相同,见表 1。
 |
中国最新胃肠胰神经内分泌肿瘤专家共识[4]补充了欧洲神经内分泌肿瘤协会(European Neuroendocrine Tumor Society, ENETS)设立的分级标准:(1)分化好的神经内分泌肿瘤为G1、G2期;(2)分化差的神经内分泌癌(小细胞)为G3期;(3)混合性外分泌-内分泌癌;(4)瘤样病变。其中,共识指出,组织学分化好的神经内分泌肿瘤,如果Ki67标记率高(20%~60%),建议诊断为NET G3期,该类患者的生物学行为与G2期和分化差的G3期均不尽相同。
研究表明[5],G1、G2期GEP-NEN分化程度较高,而G3期GEP-NEN分化程度较低。不同患者肿瘤细胞的分化程度不同,低分化者恶性程度高,肿瘤细胞增殖快,体积较大,容易累积周围组织,主要包括压迫和浸润,同时可伴淋巴或血行转移到机体其他地方,临床发现多为中晚期,预后不佳;中分化者,恶性程度次之,预后一般;高分化者,细胞发育较成熟,经积极治疗,预后较好。神经内分泌癌(G3期)与MANEC即使手术切除预后也并不好。
2 诊断方法进展由于GEP-NEN生长缓慢,早期发现并治疗能提高患者生存期和治愈率。确诊GEP-NEN的检测手段很多,主要通过组织病理学和免疫组织化学检测。胃肠镜检查是发现GEP-NEN的重要手段,24 h尿5-羟吲哚醋酸(5-hydroxy-indole acetic acid, 5-HLAA)测定也具有重要的诊断意义。嗜铬素A(chromogranin A, CgA)是目前最有价值的胃肠道神经内分泌肿瘤的标志物[6]。现代观点认为,CgA、突触素(synaptophysin, Syn)、神经元特异性烯醇化酶(neuron-specific enolase, NSE)、囊泡单胺转运体2(vesicular monoamine transporter 2, VMAT-2)、CD56是诊断GEP-NEN的常见免疫组织化学指标,且与肿瘤的分化程度密切相关,如在分化较好的胃NET中,CgA、VMAT-2表达阳性,而CgA、VMAT-2表达阴性时常提示肿瘤分化差,可协助肿瘤进行分级和分型[7]。
2.1 临床表现GEP-NEN的症状和体征不典型,临床表现多种多样,容易被忽略和误诊。有功能性的神经内分泌肿瘤过量分泌肿瘤相关物质并引起相应症状,称类癌综合征。如:胰岛素瘤会引起低血糖和中枢神经系统症状,胃泌素瘤会导致难治性消化道溃疡、上腹部疼痛、腹泻等。较罕见的胰高糖素瘤会出现游走性坏死性红斑、糖耐量受损的症状等,而无功能性的GEP-NEN一般没有相应典型的临床表现,仅有肿瘤压迫的表现。
2.2 病理检查由于绝大多数神经内分泌肿瘤表达CgA与Syn,且Ki67反映神经内分泌肿瘤的增殖活性,2017年中国肿瘤病理诊断规范,将免疫组织化学检测CgA与Syn以及Ki67列为神经内分泌肿瘤诊断的必测项目[8];将促泌素(secretagogin, SCGN)纳为可选检测项目,因其特异性好,敏感度高,与CgA与Syn联合检测可增加检出率。2017年中国肿瘤病理诊断规范建议检测人绒毛膜促性腺激素(human chofionic gonadotropin, HCG),主要用于鉴别神经内分泌肿瘤是否具有潜在恶性[8]。
2.3 影像学检查B型超声、计算机断层扫描(computed tomography, CT)和磁共振(magnetic resonance imaging, MRI)是临床上常用的影像学检查方法,但均难以达到满意的诊断准确性;目前越来越多的研究表明PET/CT对于胰腺NET有着非常重要的应用价值,可明确肿块与邻近脏器、血管的关系,预测手术的可行性,并可发现肿瘤的远处转移灶,对疾病的分期及预后的评定有一定意义。
中国最新共识认为,胃肠道神经内分泌肿瘤主要通过内窥镜和镜下活检诊断,超声内窥镜可以协助确定局部肿瘤的分期[9],可发现直径约2 mm的肿瘤,敏感度极高。它还能对可疑肿块引导穿刺获取病理诊断,有着重要诊断价值。
NCCN指南(2017年)建议,GEP-NEN患者需要CT和MRI对肿瘤的大小与原发部位进行评估[4]。
CT动态增强扫描病变多数胃NET均匀强化,延迟扫描多数肿瘤强化程度逐渐增加,刘恺等[10]认为出现这种强化模式可能是因为胃NET易形成广泛的纤维结缔组织结构,导致对比剂难以很快进入。大部分GEP-NEN表面都高表达生长抑素受体,所以生长抑素受体显像技术作为新的诊断技术有助于诊断GEP-NEN。将放射性核素标记的生长抑素(somatostatin, SST)类似物引入体内,与肿瘤表面的受体特异性结合使肿瘤显像,从而进行肿瘤灶和转移灶定位诊断。
如今,PET/CT可作为另一种手段。文献表明,68Ga DOTA-SSTa PET/CT对于胰腺NET有较高的诊断准确性及病灶探及率,在发现远处的转移灶、评价疗效、监测病情发展、估测预后等方面均有研究证实其实用性及对其他影像手段的相对优越性[11]。因此CT与PET相结合的显像技术充分利用两者优势,更具诊断价值[4]。
2.4 血液检查对于有功能的神经内分泌肿瘤,通过定量测定血中某一生物活性物质的值,若远超出正常范围,则高度怀疑神经内分泌肿瘤。NCCN指南(2017年)推荐,大部分的VIP瘤患者通过血液定量测定血浆VIP水平辅助诊断;胰高血糖素瘤患者可通过测定胰高血糖素水平或输入精氨酸后血浆胰高血糖素浓度异常增高进一步确诊;测定空腹血浆胰岛素水平、血糖水平、血浆胰岛素原及其裂解产物C-肽水平较灵敏地诊断胰岛素瘤[4]。
2.5 基因检测神经内分泌肿瘤形成的遗传学理论尚不清楚。典型类癌组DNA含量多为二倍体,非典型类癌、低分化神经内分泌肿瘤组多为异倍体,且多为非整倍体。有肌层浸润和淋巴结转移者大多为异倍体。因此,细胞染色体组定量分析有助于区分胃肠道神经内分泌肿瘤的恶性程度。
综上所述,胃肠镜活检仍然是诊断GEP-NEN的重要手段,但近些年来,影像学对GEP-NEN检查的发展相对较大,如68Ga DOTA-SSTa PET/CT,其对微小病灶识别更加敏感,从而推动了GEP-NEN早期诊断、早期治疗的进程。
3 治疗GEP-NEN患者的主要治疗手段是根治性手术,在靶向治疗出现之前这是唯一可能治愈的方法。通常最低的手术要求是不能有腹腔外转移以及弥漫性腹膜转移,然而大多数GEP-NEN患者在确诊时已发生了远处转移。现在GEP-NEN的治疗一般采取手术、介入治疗、放射性核素治疗以及药物治疗相结合的综合治疗模式,对于无法达到根治性切除的患者,需要综合考虑肿瘤的功能状态,采取姑息性手术或者手术切除联合局部治疗等方式[12]。
3.1 手术手术仍是唯一治愈GEP-NEN的方法[13]。早期患者肿瘤较小,在无淋巴结转移情况下行内窥镜下黏膜剥除术(endoscopic submucosal dissection, ESD),其是当前治疗早期GEP-NEN无淋巴结转移的标准疗法;对于局限于黏膜及黏膜下层的胃肠神经内分泌肿瘤治疗方式目前主要有内窥镜下黏膜切除术(endoscopic mucosal resection, EMR)和ESD,均具有良好的安全性和有效性,较高的肿瘤完整切除率[14]。内窥镜治疗的原则为无淋巴结转移或淋巴结转移风险极低,使用内窥镜技术可以完整切除。对于已经发生转移的肿瘤,通过手术切除原发灶、肝脏转移灶以及淋巴结清扫可以降低肿瘤负荷,提高患者的生存率,改善患者的生活质量。2010年北美神经内分泌肿瘤协会(North American Neuroendocrine Tumor Association, NANETs)共识建议,肿瘤≤2 cm可行内窥镜下切除或密切随诊;而 > 2 cm可手术切除,阑尾、空回肠和盲肠部位诊断时常有远处转移,应特别注意仔细检查并切除足够范围的组织[15]。2013年中国胃肠胰神经内分泌肿瘤专家共识对良性的胰腺神经内分泌肿瘤内窥镜切除条件更新:直径 < 6 cm、良性、功能性胰腺神经内分泌肿瘤可经腹腔镜手术;有恶性可能者选择开放性手术[16]。
NCCN指南(2017年)将不同手术方法的条件细化,(1)胃:局部G1期胃神经内分泌肿瘤患者应行内窥镜下切除,如果肿瘤在数量或大小上有较大的增长,则行胃窦切除术;对局限的G2期胃神经内分泌肿瘤,应手术切除,若无法完全切除,则需内窥镜下大部分切除并给予奥曲肽与兰瑞肽治疗;无转移的G3期肿瘤恶性度高,通常行彻底切除肿瘤病灶并清扫局部淋巴结。(2)十二指肠:建议行内窥镜切除术。(3)空回肠以及结肠:根治性切除加淋巴结清扫为首选,手术过程应仔细检查整个肠管,避免肠管损伤,注意保护肠系膜上动脉和肠系膜上静脉。(4)直肠:治疗方法依据原发肿瘤大小:若肿瘤≤2 cm或浸润较浅建议行内窥镜切除或经肛门切除。
ENETS最新共识[17]提出合理用药能大大减少手术引起的并发症,提高手术治疗效果:(1)促胃泌素瘤患者在术前数周内注射小剂量的质子泵抑制剂(proton pump inhibitor, PPI)可防止高促胃泌素分泌,预防胃手术后可能产生的胃肠道出血;(2)胰高血糖素瘤患者术前利用生长抑素类似物可以促进术后皮肤损伤愈合,术中抗凝药物可以预防血栓发生;(3)术中用生长抑素或生长抑素类似物能大大减少胰腺手术时胰漏的发生。如果术前高度怀疑存在异位激素分泌,需要做出准确判断并且给予合适治疗。
综上所述,治疗方案以内窥镜下治疗和根治性手术切除为主,较小(直径 < 1 cm)、无转移的早期肿瘤,行内窥镜下治疗或局部切除即可获得良好的预后,肿瘤直径 > 2 cm、侵及浆膜层的较大肿瘤则应行根治性手术切除;肿瘤浸润深度和肿瘤所在部位可能是评估预后的重要指标。现阶段对于GEP-NEN手术治疗仍是最佳选择,围手术期合理使用药物能减少并发症。因此近几年越来越多的研究以及专家共识要求通过精化手术方法、细化手术条件、充分围手术期准备以求提高生存率以及改善生活质量。
3.2 药物治疗主要用于无法手术以及非根治性手术的肝转移GEP-NEN患者,主要包括化疗、生物治疗、靶向治疗、奥曲肽受体介导的放射性核素治疗。现有研究表明,不同类型的肿瘤在药物疗效以及预后方面均有明显差别,制定治疗方案时需要综合考虑其肿瘤形态和分化程度以及Ki67指数[18]。
在GEP-NEN的化疗中,常用的药物有阿霉素、氟尿嘧啶、链脲霉素、达卡巴嗪、顺铂、紫杉醇等。细胞毒药物被认为是目前分化差、快速进展的GEP-NEN的一线治疗。但NCCN共识(2017年)认为对进展期GEP-NEN运用细胞毒化疗方法效果并不十分显著。多数受试者对各种细胞毒药物敏感度较低,治疗效果不够理想。中国共识(2016年)提出,目前可用于GEP-NEN的药物包括生长抑素、干扰素、依维莫司等;对于不同分级的患者首选的治疗方案不同。尽管近几年来抗肿瘤新药不断涌入市场,但临床疗效不够理想,化学治疗仍然不是神经内分泌肿瘤的首选,仅是不宜手术的晚期患者的主要治疗方案。
肿瘤的生物治疗是应用现代生物技术及其产品进行肿瘤防治的新疗法,它通过调动宿主的天然防卫机制或给予天然物质来抗肿瘤,目前主要包括干扰素(interferon, IFN)和SST类似物的治疗,SST类似物包括奥曲肽、奥曲肽微球及兰瑞肽等,其对SST受体阳性GEP-NEN有较好疗效,而IFN被认为是低增殖肿瘤的首选治疗药物。NCCN指南(2017年)建议,进展期类癌应使用干扰素治疗。α干扰素在进展期类癌中有抗肿瘤作用,但因其不良反应明显故不作首选,仅用于生长抑素类似物治疗失败后的辅助治疗。当出现类癌综合征时,或出现转移时,应考虑SST类似物治疗。
3.3 放射治疗GEP-NEN高表达生长抑素受体2(somatostatin receptor 2, SSTR2),成为肽受体从而为肽受体放射性核素治疗(peptide receptor radionuclide therapy, PRRP)重要靶点[19]。由于神经内分泌肿瘤最常表达的生长抑素受体是SSTR2,故PRRT常用的SST类似物为奥曲肽和兰瑞肽(主要作用于SSTR2)。这些放射性核素和SST类似物通过与螯合剂结合即形成各种放射肽,并应用于PRRP治疗GEP-NEN。目前,德国已经出台了关于PRRT治疗SSTR2过表达肿瘤的指南,以指导PRRP的临床应用[20]。
3.4 介入治疗适用于无法手术的肝转移患者。大部分GEP-NEN肝转移灶血管丰富,与肝细胞肝癌血供类似,可采用颗粒样物质或细胞毒制剂栓塞肝动脉,以使病灶全面坏死,能有效缓解症状,控制肿瘤生长,延长患者生存期。
3.5 新药及靶向治疗随着分子靶向治疗研究的不断深入,可同时作用于多个靶点、通过多种途径抑制肿瘤生长的药物如索拉菲尼、舒尼替尼、拉帕替尼目前已批准上市。有文献报道依维莫司和舒尼替尼在治疗胰腺NET时起到良好的作用[21]。胰腺NET中有很多促血管生成因子过表达,这些药物可以特异性地抑制这些因子受体,从而达到抗血管生成和抗肿瘤的疗效。
根据ENETS(2016年)指南,对于G1期或Ki67指数≤10%的G2期胰腺NET患者,首选SST类似物作为一线治疗,进展后可选用依维莫司或舒尼替尼,也可选用链脲霉素为基础的方案; 而对于肿瘤负荷较高和(或)疾病处于进展期的G2期胰腺NET患者,首选链脲霉素为基础的方案化疗,进展后可选用依维莫司或舒尼替尼; 对于G3期胰腺NET患者,首选链脲霉素为基础的方案化疗,G3期患者推荐EP方案化疗作为一线治疗。G3期患者一线方案化疗进展后可选择FOLFOX(奥沙利铂联合5-氟尿嘧啶/亚叶酸钙)或FOLFIRI(伊立替康联合5-氟尿嘧啶/亚叶酸钙)方案化疗[22]。
目前胰腺NET治疗领域最受关注的分子靶向治疗药物是哺乳动物雷帕霉素靶蛋(mammalian target of rapamycin, mTOR)抑制剂依维莫司和针对血管内皮生长因子(vascular endothelial growth factor, VEGF)受体信号通路的多靶点受体酪氨酸激酶抑制剂舒尼替尼。上述两种分子靶向药物均已在晚期胰腺NET患者中完成Ⅲ期临床试验,并被证实可延长胰腺NET患者的无进展生存期。
以往控制胃泌素瘤酸相关症状的基础药物是质子泵抑制剂(proton pump inhibitor, PPI)[23]。近来出现一种高选择性胃泌激素受体抑制剂,即Netazepide(YF476),它通过阻断由慢性萎缩性胃炎引起的高胃泌素血症对肠嗜铬细胞的生长刺激作用,从而抑制肿瘤生长,但目前仍在研究阶段。
3.6 类癌综合征与类癌危象的处理ENTES(2017年)认为有类癌综合征的患者肿瘤负荷大,在手术时更容易发生类癌危象。类癌危象是此类患者最危重的并发症。因此,不能确诊的类癌危象患者的术前需要合理的药物辅助治疗。奥曲肽在类癌危象的急性治疗中有着重要地位。如果患者已使用长效生长抑素类似物治疗,则继续服用相关药物。由于所有手术操作都可能诱发类癌危象,所以医护人员应随时准备静脉奥曲肽紧急注射,但治疗时要防止中间产物的释放。奥曲肽预防治疗类癌危象的作用已被证实[24],类癌综合征应采用SST类似物(如奥曲肽)控制症状。对于难治或耐药等情况,可以选择增加奥曲肽的给药频率,以达到增加剂量的作用。
4 展望GEP-NEN生长缓慢,高分化神经内分泌癌5年生存率可大于90%。有研究证明,CgA为监测预后及复发的敏感指标,若CgA迅速增高,则预后较差[25]。近些年GEP-NEN的治疗获得了显著的进展,但临床上的治疗效果仍待提升。由于患者的临床症状差异较大,所以对于GEP-NEN的诊治还面临很大的挑战[26]。因此,参考国外共识,进一步更新及规范临床诊疗流程,制定符合中国国情的诊疗共识是推动疾病诊疗规范化的当务之急。相信随着对GEP-NEN认识的不断深入,尤其是不同的分子靶向药物在临床治疗上的成功,未来一定会出现更有效果的诊疗方案,提高患者生活质量,延长其生存期。
| [1] | Lüttges J. What's new? The 2010 WHO classification for tumours of the pancreas[J]. Pathologe, 2011, 32(Suppl 2): 332–6. |
| [2] | Garcia-Carbonero R, Sorbye H, Baudin E, et al. ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas[J]. Neuroendocrinology, 2016, 103(2): 186–94. DOI:10.1159/000443172 |
| [3] | 中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志, 2013, 42(10): 691–4. [ Expert Group of Pathology Diagnosis of Gastrointestinal Pancreatic Neuroendocrine Tumors in China. Chinese gastrointestinal pancreatic neuroendocrine tumor pathology diagnosis consensus (2013 version)[J]. Zhonghua Bing Li Xue Za Zhi, 2013, 42(10): 691–4. DOI:10.3760/cma.j.issn.0529-5807.2013.10.011 ] |
| [4] | NCCN. NCCN clinical practice guidelines in oncology Neuroendocrine Tumors (2017. V3) [S/OL]. 2017-06-14]. http://cache1.medsci.cn/webeditor/uploadfile/201706/20170615141559643.pdf. |
| [5] | 李剑昂, 韩序, 方圆, 等. 胃神经内分泌肿瘤的临床病理特征及根治性手术后预后分析[J]. 中国实用外科杂志, 2013, 33(10): 866–70. [ Li JA, Han X, Fang Y, et al. A study of clinical characteristics and prognostic factors 49 patients with gastric neuroendocrine neoplasms treated with radical surgery[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2013, 33(10): 866–70. ] |
| [6] | 曹晖, 赵文毅. 应该重视特殊类型的胃肿瘤[J]. 中华胃肠外科杂志, 2013, 16(2): 128–31. [ Cao H, Zhao WY. Emphasis on special types of stomach tumors[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16(2): 128–31. ] |
| [7] | 刘丹, 沈琳, 陆明. 胃神经内分泌肿瘤的诊断和治疗[J]. 临床肿瘤学杂志, 2015, 20(6): 549–50. [ Liu D, Shen L, Lu M. Diagnosis and treatment for gastric neuroendocrine tumors[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2015, 20(6): 549–50. ] |
| [8] | 《肿瘤病理诊断规范》项目组. 肿瘤病理诊断规范(胃肠胰神经内分泌肿瘤)[J]. 中国病理学杂志, 2017, 46(2): 76–8. [ Panel Members of Standardization for Diagnostic Tumor Pathology. Standardization and regulations standardization for diagnostic tumor pathology: gastroenteropancreatic neuroendocrine neoplasm[J]. Zhongguo Bing Li Xue Za Zhi, 2017, 46(2): 76–8. ] |
| [9] | 中国临床肿瘤学会神经内分泌肿瘤专家委员会. 中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J]. 临床肿瘤学杂志, 2016, 21(10): 927–36. [ Chinese Society of Clinical Oncology Neuroendocrine Tumor Expert Committee. Chinese gastrointestinal pancreatic neuroendocrine tumor expert consensus (2016 version)[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2016, 21(10): 927–36. ] |
| [10] | 刘恺, 文戈, 邓燕佳, 等. 胃类癌动态增强CT表现与病理学对照研究[J]. 临床放射学杂志, 2012, 31(6): 829–32. [ Liu K, Wen G, Deng YJ, et al. Dynamic contrast CT features in gastric carcinoid: Comparative study with pathological findings[J]. Lin Chuang Fang She Xue Za Zhi, 2012, 31(6): 829–32. ] |
| [11] | Van Binnebeeket S, Vanbilloen B, Baete K, et al. Comparison of diagnostic accuracy of (111)In -pentetreotide SPECT and (68)Ga-DOTATOC PET/CT: A lesion-by-lesion analysis in patients with metastatic neuroendocrine tumours[J]. Eur Radiol, 2016, 26(3): 900–9. DOI:10.1007/s00330-015-3882-1 |
| [12] | Wang P, Sun B, Huang B, et al. Comparison between percutaneous transhepatic rigid cholangioscopic lithotripsy and conventional percutaneous transhepatic cholangioscopic surgery for hepatolithiasis treatment[J]. Surg Laparosc Endosc Percutan Tech, 2016, 26(1): 54–9. DOI:10.1097/SLE.0000000000000222 |
| [13] | Frilling A, ModlinIM, KiddM, et al. Recommendations for management of patients with neuroendocrine liver metastases[J]. Lancet Oncol, 2014, 15(1): e8–21. DOI:10.1016/S1470-2045(13)70362-0 |
| [14] | 孟曼, 令狐恩强, 卢忠生, 等. 直肠神经内分泌肿瘤内镜下诊治153例分析[J]. 解放军医学院学报, 2014, 35(6): 558–60. [ Meng M, LingHu EQ, Lu ZS, et al. Endoscopic diagnosis and treatment of rectal neuroendocrine tumor: a report of 153 cases[J]. Jie Fang Jun Yi Xue Yuan Xue Bao, 2014, 35(6): 558–60. ] |
| [15] | Anthony LB, Strosberg JR, Klimstra DS, et al. The NANETS consensus guidelines for the diagnosis and management of gastriointestinal neuroendocrine tumors(nets): well-differentiated nets of the distal colon and rectum[J]. Pancreas, 2010, 39(6): 767–74. DOI:10.1097/MPA.0b013e3181ec1261 |
| [16] | 中华医学会肿瘤学分会胰腺癌学组(筹). 胰腺神经内分泌肿瘤诊治专家共识[J]. 中华肿瘤杂志, 2014, 36(9): 717–20. [ Pancreatic Cancer Group of the Oncology Branch of Chinese Medical Association. Expert consensus of diagnosis and treatment of pancreatic neuroendocrine tumors[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(9): 717–20. ] |
| [17] | Kaltsas G, Caplin M, Davies P, et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Pre-and Perioperative Therapy in Patients with Neuroendocrine Tumors[J]. Neuroendocrinology, 2017, 105(3): 245–54. DOI:10.1159/000461583 |
| [18] | 廖彩仙, 周杰, 杨定华, 等. 肝胆管结石合并胆汁性肝硬化和门静脉高压症的外科治疗[J]. 中华肝脏外科手术学电子杂志, 2015, 4(1): 24–6. [ Liao CX, Zhou J, Yang DH, et al. Surgical treatments for hepatolithiasis complicated with biliary cirrhosis and portal hypertension[J]. Zhonghua Gan Zang Wai Ke Shou Shu Xue Dian Zi Za Zhi, 2015, 4(1): 24–6. ] |
| [19] | 王志, 黄秋林. 肽受体放射性核素治疗胃肠胰神经内分泌肿瘤[J]. 现代肿瘤医学, 2017, 25(16): 2685–8. [ Wang Z, Huang QL. Peptide receptor radionuclide therapy for gastroenteropancreatic neuroendocrine neoplasms[J]. Xian Dai Zhong Liu Yi Xue, 2017, 25(16): 2685–8. DOI:10.3969/j.issn.1672-4992.2017.16.041 ] |
| [20] | Poeppel TD, Boy C, Bockisch A, et al. Peptide receptor radionuclide therapy for patients with somatostatin receptor expressing tumours. German guideline(S1)[J]. Nuklearmedzin, 2015, 54(1): 1–11. |
| [21] | Janson ET, Sorbye H, Welin S, et al. Nordic guidelines 2014 for diagnosis and treatment of gastroenteropancreatic neuroendocrine neoplasms[J]. Acta Oncol, 2014, 53(10): 1284–97. DOI:10.3109/0284186X.2014.941999 |
| [22] | Pavel M, O'Toole D, Costa F, et al. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site[J]. Neuroendocrinology, 2016, 103(2): 172–85. DOI:10.1159/000443167 |
| [23] | Grozinsky-Glasberg S, Grossman AB, Gross DJ. Carcinoid heart disease: from pathophysiology to treatment-'something in the way it moves'[J]. Neuroendocrinology, 2015, 101(4): 263–73. DOI:10.1159/000381930 |
| [24] | Falconi M, Eriksson B, Kaltsas G, et al. ENETS Consensus Guidelines Update for the Management of Patients with Functional Pancreatic Neuroendocrine Tumors and Non-Functional Pancreatic Neuroendocrine Tumors[J]. Neuroendocrinology, 2016, 103(2): 153–71. DOI:10.1159/000443171 |
| [25] | Seregni E, Ferrai L, Bajetta E, et al. Clinical significance of blood chromogranin A measurement in neuroendocrine tumours[J]. Ann Oncol, 2001, 12(Suppl 2): S69–72. DOI:10.1093/annonc/12.suppl_2.S69 |
| [26] | Delle Fave G, O'Toole D, Sundin A, et al. ENETS Consensus Guidelines Update for Gastroduodenal Neuroendocrine Neoplasms[J]. Neuroendocrinology, 2016, 103(2): 119–24. DOI:10.1159/000443168 |
 2018, Vol. 45
2018, Vol. 45


