文章信息
- 石蒜碱诱导肺癌NCI-H460细胞凋亡作用及其机制
- Apoptosis Induction of Lycorine on Lung Cancer NCI-H460 Cells and Related Mechanism
- 肿瘤防治研究, 2018, 45(1): 5-8
- Cancer Research on Prevention and Treatment, 2018, 45(1): 5-8
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2018.17.0388
- 收稿日期: 2017-08-25
- 修回日期: 2017-10-31
2. 541004 桂林,广西肝脏损伤与修复分子医学重点实验室;
3. 541004 桂林,桂林医学院药学院
2. Guangxi Key Laboratory of Molecular Medicine in Liver Injury and Repair, Guilin 541004, China;
3. College of Pharmacy, Guilin Medical University, Guilin 541004, China
长期以来,寻找对肺癌敏感的药物都是科研工作者及医务人员感兴趣的问题。石蒜碱(Lycorine)最初由森岛于1895年从石蒜的鳞茎中分离获得[1],是存在于石蒜科植物中的一种活性异喹啉类生物碱[2],具有抗炎、抗菌、抗病毒、镇痛等作用[3]。近年来,国内外对石蒜碱抗肿瘤的作用及机制做了较多研究,并且体外研究已证实石蒜碱对乳腺癌[4-5]、食管癌[6]、卵巢癌[7]、胃癌[8]、肺癌[9]、白血病[10-14]、肾癌[15]、前列腺癌[16-17]、膀胱癌[18]和胰腺癌[19]等多种肿瘤细胞具有抑制增殖及促进凋亡的作用。
本课题组陈建荣等在前期实验中已经观察到石蒜科植物文殊兰叶氯仿提取物可抑制肺癌NCI-H460细胞的生长同时能诱导其凋亡,作用强度均与浓度呈正相关,并能于细胞周期G1/S期阻滞NCI-H460[20],而石蒜碱为此部位的活性单体。本实验在此基础上进一步研究石蒜碱在体外对NCI-H460细胞生长的影响及作用机制。
1 材料与方法 1.1 主要材料与仪器盐酸石蒜碱购自上海阿拉丁生化科技股份有限公司(纯度 > 96%);肺癌NCI-H460细胞购自中国科学院上海细胞生物学研究所;Caspase 3检测试剂盒购自上海碧云天生物技术有限公司;AnnexinV-FITC/PI凋亡检测试剂购自上海七海复泰生物科技有限公司;Bio-Tek酶标仪(ELX-800,美国);CO2恒温细胞培养箱(MCO-15AC,日本三洋公司);小型台式高速冷冻离心机(艾本德5424R,德国);恒温水浴锅(上海精宏实验设备有限公司);洁净工作台(上海智城分析仪器制造有限公司);倒置显微镜(日本OLYMPUS);流式细胞检测仪(EPICSXL,美国)。
1.2 方法 1.2.1 细胞培养用含10%胎牛血清和1%双抗(100 u/ml青霉素、100 mg/L链霉素)的DMEM培养液培养对数期的肺癌NCI-H460细胞株,在37℃、5%CO2培养箱中培养,每周传代3次。用0.25%胰蛋白酶消化贴壁细胞。
1.2.2 MTT法检测石蒜碱对肺癌NCI-H460细胞增殖的影响用含10%胎牛血清的DMEM培养液调整NCI-H460细胞数至每毫升(3~5)×105个,接种于96孔细胞培养板上,每孔0.1 ml,细胞贴壁70%~80%时,吸弃培养液后分别加入含以下5种石蒜碱浓度(1.0、2.0、4.0、8.0、16.0 μmol/L)的培养液0.1 ml,每组设10个复孔,以0.9%NaCl溶液为对照。培养24 h后,每孔加入20 μl MTT(5 g/L)溶液,继续培养4 h,吸弃培养液,每孔加入100 μl DMSO,用酶标仪在波长490 nm处测定吸光度A值,用A实验/A对照计算细胞相对活力。
1.2.3 流式细胞仪检测细胞凋亡率取对数生长期肺癌NCI-H460细胞,以每孔2×105个的密度在6孔细胞培养板上接种。细胞贴壁70%~80%时,吸弃培养液后分别加入含以下6种石蒜碱浓度(0.5、1.0、2.0、4.0、8.0、16.0 μmol/L)的培养液2 ml,以0.9%NaCl溶液为对照。处理24 h后,吸出细胞培养液置于15 ml离心管内(含悬浮凋亡坏死细胞),PBS洗涤(洗涤液置于对应的离心管内),胰酶消化,吹打均匀,转移至对应的离心管,1 000 r/min,离心5 min。弃上清液,1 ml PBS轻轻重悬细胞并计数(细胞数量不少于105),1 000 r/min,离心5 min,收集细胞。加入400 μl Binding buffer重悬细胞,加入5 μl AnnexinV-FITC,混匀,室温避光孵育15 min,加入10 μl PI染色液,混匀,冰浴避光放置5 min,于30 min内进行流式细胞检测。
1.2.4 Caspase 3活性检测细胞培养、分组与石蒜碱处理同“1.2.3”。1 500 r/min 4℃离心5 min,收集细胞,小心吸除上清液,按每2×106个细胞加入100 μl裂解液的比例加裂解液,重悬沉淀并冰浴裂解15 min。4℃ 12 000 r/min离心20 min,将上清转移到预冷的EP管中。按试剂盒说明书进行Caspase 3活性检测。另取部分上清液按Bradford试剂盒方法测定蛋白浓度。
1.3 统计学方法实验数据采用SPSS13.0统计软件,用LSD检验进行统计学处理,数据采用(x± s)表示,P < 0.05为差异有统计学意义。
2 结果 2.1 倒置显微镜下观察NCI-H460细胞形态学变化不同浓度石蒜碱作用NCI-H460细胞24 h后,显微镜下(×100)观察细胞形态变化。未经药物处理的空白对照组中NCI-H460细胞形态饱满、大小均一、细胞生长旺盛;经药物作用后,细胞外形不规则、细胞皱缩、大小不一、细胞破碎程度随给药剂量增加而加剧,细胞数量逐渐减少,见图 1。
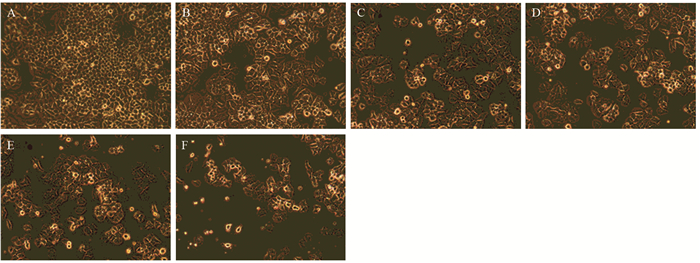
|
| A: Control group; B: 1 μmol/L lycorine group; C: 2 μmol/L lycorine group; D: 4 μmol/L lycorine group; E: 8 μmol/L lycorine group; F: 16 μmol/L lycorine group 图 1 不同浓度石蒜碱作用NCI-H460细胞24h后显微镜下细胞形态观察(×100) Figure 1 Morphology of NCI-H460 cells treated with different concentrations of lycorine for 24h (×100) |
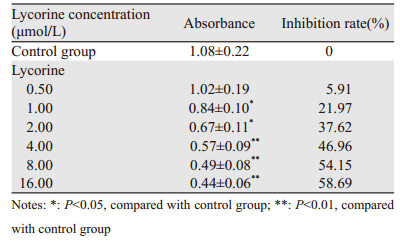
用石蒜碱处理NCI-H460细胞24 h后,NCI-H460细胞增殖受到明显的抑制,与对照组相比差异有统计学意义(P < 0.05, P < 0.01),并呈现一定的浓度相关性。IC50为(5.79±0.11)μmol/L。表明石蒜碱能够有效抑制肺癌NCI-H460细胞增殖,见表 1。
 |
当浓度分别为1、4、16 μmol/L时,NCI-H460细胞凋亡率分别为(17.9±1.71)%、(29.9±2.77)%、(46.2±3.46)%,相比对照组凋亡率为(10.7±0.88)%,当浓度为1 μmol/L时细胞凋亡率差异极显著(P < 0.05),而当浓度为4、16 μmol/L时细胞凋亡差异有统计学意义(P < 0.01),表明石蒜碱对NCI-H460细胞的凋亡具有诱导效应,其作用与剂量呈正相关。
2.4 石蒜碱对肺癌NCI-H460细胞Caspase 3活性的影响用石蒜碱处理肺癌NCI-H460细胞24 h后,随着石蒜碱浓度的增加,Caspase 3的活性逐渐增高。石蒜碱给药组与对照组比较,Caspase 3的活性显著升高(P < 0.01),见图 2。
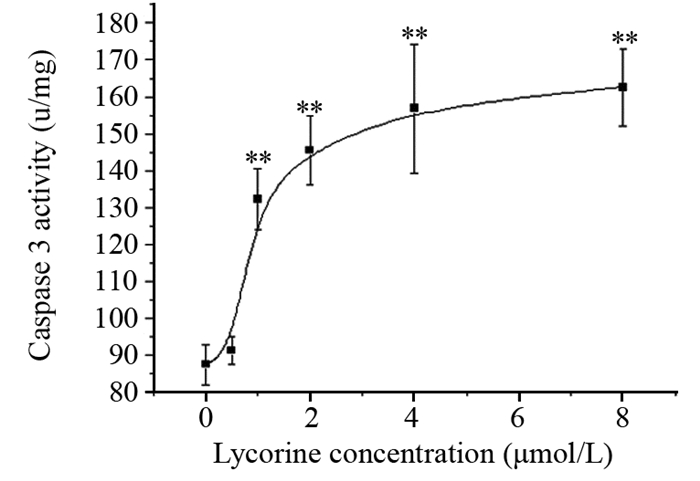
|
| **: P < 0.01, compared with control group 图 2 石蒜碱对肺癌NCI-H460细胞Caspase 3活性的影响(x± s, n=3) Figure 2 Effect of lycorine on Caspase 3 activity in lung cancer NCI-H460 cells (x± s, n=3) |
本实验中首次选用肺癌NCI-H460细胞为体外细胞实验模型,经不同浓度的石蒜碱处理NCI-H460细胞24 h后,NCI-H460细胞增殖明显受到抑制,并呈现一定的浓度相关性,IC50为(5.79±0.11)μmol/L,表明石蒜碱能有效抑制肺癌NCI-H460细胞增殖。同时采用流式细胞仪检测发现随着石蒜碱浓度的升高,细胞凋亡率亦随之逐渐升高,当为最高浓度16 µmol/L时,凋亡率达到(46.2±3.46)%,表明石蒜碱对NCI-H460细胞的凋亡具有诱导效应,且作用效果与石蒜碱的剂量成正相关性。
目前研究石蒜碱抗肿瘤作用机制主要有以下几方面:(1)影响肿瘤细胞的细胞周期调控通路,实现非p53依赖的p21表达上调并下调Cdk2、Cdc2和CyclinE的表达,从而阻断了肿瘤细胞周期;(2)上调肿瘤坏死因子a(TNF-a)的表达并促进Bid蛋白被剪切,继而激活了线粒体凋亡途径;(3)可通过下调IKKβ抑制核因子κB(NF-κB)进入细胞核行使转录调节功能,并降低了核因子κB抑制因子(IκB)磷酸化水平;(4)刺激细胞产生过量ROS(活性氧簇分子)继而氧化损伤细胞,导致细胞死亡;(5)下调Bcl-2、Mcl-1、c-myc、survivin的表达, 提高Bax和P53的表达,增强caspase-8、-9和-3的活性;(6)抑制Akt途径并激活内在的凋亡级联;(7)通过ROS介导的PI3K/Akt/mTOR信号通路诱导肿瘤细胞凋亡;(8)阻止EGF诱导的JAK/STAT信号转导;这些机制均可通过Caspase级联反应抑制肿瘤生长[9-19]。而Caspase 3是细胞凋亡过程中最主要的终末剪切酶,一旦活化即可降解Caspase的大多数底物,是细胞凋亡的关键执行者,同时也是细胞毒性T淋巴细胞杀伤的重要组成部分。主要通过两种途径激活,即位于细胞表面的死亡受体途径和线粒体依赖途径[21]。凋亡因素通过信号的级联传递、基因及蛋白表达水平的调控、细胞构架改变3个阶段激活Caspase家族成员,同时诱导其释放致使细胞凋亡。Caspase 3在凋亡程序发生时具有核心作用,以前体酶原(pro-Caspase)形式存在于正常细胞中(无活性),当早期细胞受到凋亡因子刺激时,pro-Caspase马上被“瀑布式”地层层活化,负责裂解细胞DNA的凋亡特异性核酸酶被活化的Caspase 3激活,最终促使细胞凋亡的发生[22]。有研究发现,石蒜碱可以将HL-60细胞阻滞于G2/M期,其作用机制可能与Caspase 3活性被增强有关[14]。
为进一步探究石蒜碱诱导NCI-H460细胞凋亡的机制,本实验检测了凋亡相关因子Caspase 3。通过检测不同浓度石蒜碱处理细胞后表达的Caspase 3含量发现,其处理后肺癌NCI-H460细胞内Caspase 3明显升高,且Caspase 3的增量与石蒜碱浓度正相关,说明石蒜碱诱导肺癌NCI-H460凋亡可能与Caspase 3的活性增强有关。
综上所述,石蒜碱诱导肺癌NCI-H460细胞凋亡的可能机制是通过调节Caspase家族基因的表达,进而影响Caspase相关酶的活性,最终导致细胞凋亡的发生,本研究为临床肺癌的治疗寻找新的高效、低毒的化疗药物提供了实验依据。但石蒜碱在体内是否也具有抗肺癌作用,是否也通过调节Caspase家族基因表达诱导细胞凋亡将是本研究组下一步研究的重点。
| [1] | 赵明明, 熊海蓉, 李霞, 等. 石蒜属植物中石蒜碱的研究进展[J]. 河南化工, 2010, 27(19): 25–7. [ Zhao MM, Xiong HR, Li X, et al. Studies on lycorine in lycoris[J]. He'nan Hua Gong, 2010, 27(19): 25–7. DOI:10.3969/j.issn.1003-3467.2010.19.007 ] |
| [2] | 吴志平, 陈雨, 冯煦, 等. 石蒜科药用植物生物碱的药理学研究[J]. 中国野生植物资源, 2008, 27(5): 26–31. [ Wu ZP, Chen Y, Feng M, et al. Pharmacological Study on Alkaloids of Amaryllidaceae Medicinal Plants[J]. Zhongguo Ye Sheng Zhi Wu Zi Yuan, 2008, 27(5): 26–31. ] |
| [3] | 李先明, 季宇彬, 辛国松, 等. 朱顶红中石蒜碱药理作用的研究[J]. 哈尔滨商业大学学报(自然科学版), 2014, 30(5): 525–8. [ Li XM, Ji YB, Xin GS, et al. Research on pharmacological activity of Lycorine In Barbadoslily[J]. Harbin Shang Ye Da Xue Xue Bao (Zi Ran Ke Xue Ban), 2014, 30(5): 525–8. ] |
| [4] | 石碧炜. 石蒜碱对人乳腺癌细胞MCF-7存活率及线粒体膜电位的影响[J]. 医学综述, 2010, 16(16): 2524–5. [ Shi BW. The effects of lycorine on cell survival rate and mitochondrial membrane potential of MCF-7 breast cancer Cells[J]. Yi Xue Zong Shu, 2010, 16(16): 2524–5. DOI:10.3969/j.issn.1006-2084.2010.16.045 ] |
| [5] | Ying X, Huang A, Xing Y, et al. Lycorine inhibits breast cancer growth and metastasis via inducing apoptosis and blocking Src/FAK-involved pathway[J]. Sci China Life Sci, 2017, 60(4): 417–28. DOI:10.1007/s11427-016-0368-y |
| [6] | 彭聪, 徐佳, 伍春莲. 盐酸石蒜碱对人食管癌细胞Eca-109增殖及凋亡的影响[J]. 西华师范大学学报(自然科学版), 2015, 36(1): 7–11. [ Peng C, Xu J, Wu CL. Effects of Lycorine hydrochloride on Eca-109 cells via inhiting proliferation and inducing apoptosis[J]. Xi Hua Shi Fan Da Xue Xue Bao (Zi Ran Ke Xue Ban), 2015, 36(1): 7–11. ] |
| [7] | Cao Z, Yu D, Fu S, et al. Lycorine hydrochloride selectively inhibits human ovarian cancer cell proliferation and tumor neovascularization with very low toxicity[J]. Toxicol Lett, 2013, 218(2): 174–85. DOI:10.1016/j.toxlet.2013.01.018 |
| [8] | 刘希宇, 贺小英, 王凤梅, 等. 石蒜碱对人胃癌细胞体外增殖的影响[J]. 信阳师范学院学报(自然科学版), 2015, 28(2): 173–6. [ Liu XY, He XY, Wang FM, et al. The Influence of Lycorisradiata Alkali on the Proliferation of Human Gastric Cancer Cells Cultured in Vitro[J]. Xinyang Shi Fan Xue Yuan Xue Bao(Zi Ran Ke Xue Ban), 2015, 28(2): 173–6. ] |
| [9] | 张炜, 崔恩海. 石蒜碱诱导肺癌A549细胞凋亡作用研究[J]. 中国中药杂志, 2015, 40(16): 3278–82. [ Zhang W, Cui EH. Effects of lycorine on apoptosis of lung cancer A549 cells[J]. Zhongguo Zhong Yao Za Zhi, 2015, 40(16): 3278–82. ] |
| [10] | 王杨, 于淼. 石蒜碱诱导人白血病K562细胞凋亡的研究[J]. 哈尔滨商业大学学报(自然科学版), 2015, 31(2): 135–9. [ Wang Y, Yu M. Study on lycorine-induced apoptosis of human leukemia K562 Cells[J]. Harbin Shang Ye Da Xue Xue Bao (Zi Ran Ke Xue Ban), 2015, 31(2): 135–9. ] |
| [11] | 刘小珊, 蒋纪恺. 石蒜碱对人白血病U937细胞的凋亡诱导及作用机制[J]. 山东医药, 2008, 48(2): 35–7. [ Liu XS, Jiang JK. Effects of Lycorine on Apoptosis of U937 Cells in Human Leukemia and Its Mechanism[J]. Shandong Yi Yao, 2008, 48(2): 35–7. ] |
| [12] | 石碧炜. 石蒜碱通过上调p21基因表达抑制HL-60细胞增殖的分子机制初步研究[D]. 长沙: 中南大学, 2007. [ Shi Bw. Molecular mechanism of lycorine on proliferation of HL-60 Cells by up-regulating p21 gene expression[D]. Changsha: Zhongnan Da Xue, 2007. ] http://cdmd.cnki.com.cn/Article/CDMD-10533-2007171510.htm |
| [13] | 胡济梁. 石蒜碱诱导HL-60细胞凋亡的分子机制探讨[D]. 长沙: 中南大学, 2008. [ Hu JL. Molecular mechanism of lycorine-induced Apoptosis in HL-60 cells[D]. Changsha: Zhongnan Da Xue, 2008. ] http://cdmd.cnki.com.cn/Article/CDMD-10533-2008167752.htm |
| [14] | Liu J, Hu WX, He LF, et al. Effects of lycorine on HL-60 cells via arresting cell cycle and inducing apoptosis[J]. FEBS Lett, 2004, 578(3): 245–50. DOI:10.1016/j.febslet.2004.10.095 |
| [15] | 黄义强. 石蒜碱对肾癌细胞786-O、ACHN的作用及机制初探[D]. 广州: 南方医科大学, 2016. [ Huang YQ. Effect of lycorine on 786-O and ACHN in renal cell carcinoma and its mechanism[D]. Guangzhou: Nan Fang Yi Ke Da Xue, 2016. ] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3117240 |
| [16] | 周程. 基于NF-κB信号通路探索石蒜碱抗前列腺癌机理[D]. 兰州: 兰州大学, 2016. [ Zhou C. Based on NF-κB signaling pathway to explore the mechanism of lycorine against prostate cancer[D]. Lanzhou: Lanzhou Da Xue, 2016. ] http://cdmd.cnki.com.cn/Article/CDMD-10730-1016723312.htm |
| [17] | Hu M, Peng S, He Y, et al. Lycorine is a novel inhibitor of the growth and metastasis of hormone-refractory prostate cancer[J]. Oncotarget, 2015, 6(17): 15348–61. |
| [18] | Wang C, Wang Q, Li X, et al. Lycorine induces apoptosis of bladder cancer T24 cells by inhibiting phospho-Akt and activating the intrinsic apoptotic cascade[J]. Biochem Biophys Res Commun, 2017, 483(1): 197–202. DOI:10.1016/j.bbrc.2016.12.168 |
| [19] | Liu Q, Hu S, Zhang Y, et al. Lycorine induces apoptosis in human pancreatic cancer cell line PANC-1 via ROS-mediated inactivation of the PI3K/Akt/mTOR signaling pathway[J]. Int J Clin Exp Med, 2016, 9(11): 21048–56. |
| [20] | 陈建荣, 杨扬, 杨月. 文殊兰叶氯仿提取物诱导NCI-H460细胞凋亡的研究[J]. 肿瘤防治研究, 2011, 38(6): 628–31. [ Chen JR, Yang Y, Yang Y. Study on apoptosis of NCI-H460 cells induced by Crinum asiaticum leaf chloroform extract[J]. Zhong Liu Fang Zhi Yan Jiu, 2011, 38(6): 628–31. ] |
| [21] | Budihardjo I, Oliver H, Lutter M, et al. Biochemical pathways of caspase activation during apoptosis[J]. Annu Rev Cell Dev Biol, 1999, 15: 269–90. DOI:10.1146/annurev.cellbio.15.1.269 |
| [22] | 齐青. 人胃癌多药耐药细胞株SGC7901/ADM的建立及三氧化二砷对其逆转耐药作用[D]. 青岛: 青岛大学, 2014. [ Qi Q. Establishment of human gastric cancer multidrug resistance cell line SGC7901/ADM and its effect on reversal resistance of arsenic trioxide[D]. Qingdao: Qingdao Da Xue, 2014. ] http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2588817 |
 2018, Vol. 45
2018, Vol. 45


