文章信息
- 血清碱性磷酸酶及乳酸脱氢酶与Ⅰ~Ⅲ期乳腺癌患者生存的相关性
- Correlation of Serum Alkaline Phosphatase and Lactate Dehydrogenase with Survival of Stage Ⅰ-Ⅲ Breast Cancer Patients
- 肿瘤防治研究, 2017, 44(12): 816-822
- Cancer Research on Prevention and Treatment, 2017, 44(12): 816-822
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0544
- 收稿日期: 2017-05-16
- 修回日期: 2017-09-05
乳腺癌是导致全球妇女癌症死亡的主要原因[1],虽然手术方式的改变、放化疗及靶向治疗的进展明显降低了乳腺癌患者的死亡率[2],但仍有部分乳腺癌患者复发率居高及生存期仍不乐观。寻找能预测患者预后的指标,尤其是血液学指标,对指导患者治疗和改善预后不失为一种简单、便捷、经济的方法。
血清中ALP和LDH是常见的血液学检查指标,具有经济、易得的特点及优势。Pierga等[3]对有关以表阿霉素为基础一线治疗转移性乳腺癌患者的8个研究130例患者Meta分析显示血清LDH水平是影响预后的独立危险因素之一。Le等[4]对130例脑转移的乳腺癌患者进行多因素分析得出LDH水平为该组患者的独立预后因素。虽然血清中ALP和LDH在恶性肿瘤中均有报道,但尚缺乏长期生存相关性的研究,尤其是乳腺癌多为复发转移的相关研究。本研究旨在回顾性分析Ⅰ~Ⅲ期乳腺癌患者评估标准治疗(即手术后辅助化、放疗)前后血清LDH、ALP水平变化对乳腺癌预后的影响,探讨血液学检查指标ALP和LDH的预后及指导意义。
1 资料与方法 1.1 一般资料收集贵州医科大学附属肿瘤医院乳腺妇科肿瘤科2003—2012年资料完整的467例Ⅰ~Ⅲ期(AJCC分期)乳腺癌患者,所有患者接受手术(术后病理由本院病理科完成),新辅助或辅助治疗(均为一线标准治疗方案)和术后辅助放疗。治疗结束后所有患者均经门诊或电话规律随访(每3~6月一次,3~5年内每6~12月一次,5年以上每年一次),随访2~175月(中位随访时间61月)。收集的患者治疗前行心电图(ECG)、心脏B型超声、心功能测定及心肌酶谱,腹部B型超声、肝功能测定、骨扫描排除一定心脏、肝脏及骨相关疾病,其基本临床特征包括:年龄、治疗前后KPS评分、病理、激素受体状态、家族史、绝经状态以及出现复发转移时间、部位和治疗。记录辅助治疗前血清ALP(Pre-sALP)和LDH(Pre-sLDH)水平及辅助治疗后血清ALP(Post-sALP)和LDH(Post-sLDH)水平(ALP使用速率法测定,LDH使用乳酸底物法测定),设定血清ALP水平大于正常值(135 u/L,为我院实际测量指标的正常上限)定义为升高组,小于或等于正常值上限为未升高组,血清LDH水平大于正常值(250 u/L,为我院实际测量指标的正常上限)定义为升高组,小于或等于正常值上限为未升高组。分析患者治疗前、治疗后血清LDH、ALP水平与患者PFS、OS及复发转移的关系。
1.2 统计学方法本研究中ALP、LDH数值不呈现正态分布,采用中位数及四分位间距M(P25,P75)表示,两组间比较采用Mann-Whitney非参数检验,多组间比较采用非参数Kruskal-Wallis检验。探索影响OS和PFS的影响因素,单因素采用Kaplan-Meier法,生存率比较应用Long rank秩检验。采用Cox回归模型、Logistic回归进行多因素生存分析。所有数据采用SPSS22.0统计软件处理,双侧检验,α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果 2.1 血清ALP及LDH与467例患者临床病例特征的关系收集Ⅰ~Ⅲ期乳腺癌患者467例,中位年龄46岁(19~79岁)。其中Ⅰ期76例、Ⅱ期261例、Ⅲ期130例。中位随访时间61月(2~175月)。至研究截止时,24.41%(114/467)患者出现了复发转移;25.70%(120/467)患者死亡。5年生存率75%,中位OS时间104.41月,中位PFS时间106.25月。Ⅰ期有15.8%(12/76)患者出现了复发转移,17.1%(13/76)患者死亡;5年生存率86%,中位OS时间109.19月,中位PFS时间106.70月。Ⅱ期有22.2%(58/261)患者出现了复发转移,21.8%(57/261)患者死亡;5年生存率78%,中位OS时间120.98月,中位PFS时间121.17月。Ⅲ期有33.8%(44/130)患者出现了复发转移,38.5%(50/130)患者死亡;5年生存率62%,中位OS时间100.20月,中位PFS时间82.72月。
血清ALP检测结果:467例患者治疗前为77.00(61.00,93.80)(u/L),治疗后为80.57(66.54,102.00)(u/L),治疗后血清水平升高(P=0.002),差异有统计学意义。分期分层研究显示Ⅱ期患者治疗后ALP水平较治疗前升高(P=0.003),Ⅰ期、Ⅲ期患者治疗前后差异无统计学意义。
血清LDH检测结果:467例患者治疗前为173.69(153.03,203.00)(u/L),治疗后为178.55(150.00,212.00)(u/L),(P=0.115)。分期分层研究显示:三期的患者治疗前后LDH水平差异无统计学意义。
治疗前血清ALP在年龄>50岁,Ⅱ期治疗后出现复发转移的患者中升高(P<0.05)。治疗后ALP在总体年龄>50岁、总体治疗后出现复发转移的患者及Ⅱ期、Ⅲ期治疗后出现复发转移的患者中升高(P<0.05)。
治疗前血清LDH在各个分层分析中差异无统计学意义。化疗后LDH在总体年龄>50岁、病理类型为浸润性导管癌、总体治疗后复发转移的患者及Ⅱ期治疗后出现复发转移的患者中升高(P<0.05)。患者基本临床病理特征与治疗前、后ALP、LDH关系,见表 1~2。
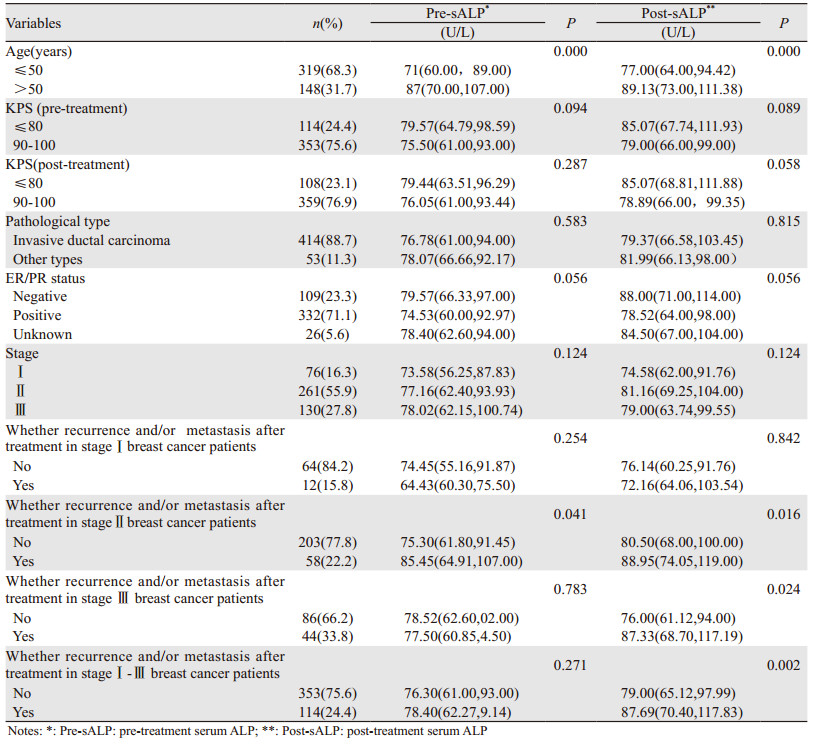
|
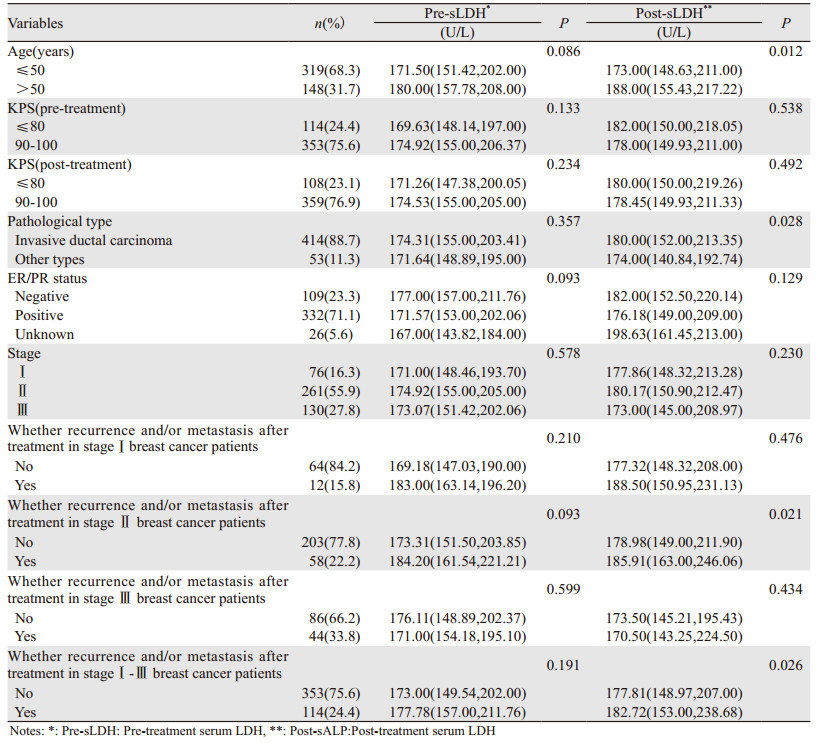
|
Ⅰ~Ⅲ期患者复发转移率为14.6%。单因素分析显示:ER/PR受体状态阴性(P=0.000),有家族遗传史(P=0.017),治疗前ALP升高组(P=0.004)、治疗后ALP升高组(P=0.000)、治疗后LDH升高组(P=0.000)的患者复发转移率升高,且结果差异有统计学意义。治疗前LDH升高组的复发转移率亦高于未升高组(33.3% vs. 23.8%),但差异无统计学意义。多因素分析结果显示:ER/PR受体状态阴性(P=0.001),家族遗传史(P=0.028),治疗后LDH升高组(P=0.008),具有以上三种因素的患者复发转移率升高,差异有统计学意义。RR值分别为1.509(0.605~3.7 61)、12.55(1.314~119.836)、2.387(1.261~4.519)。因此,治疗后LDH升高组为影响Ⅰ~Ⅲ期患者复发转移的独立预后因素,ROC曲线见图 1。
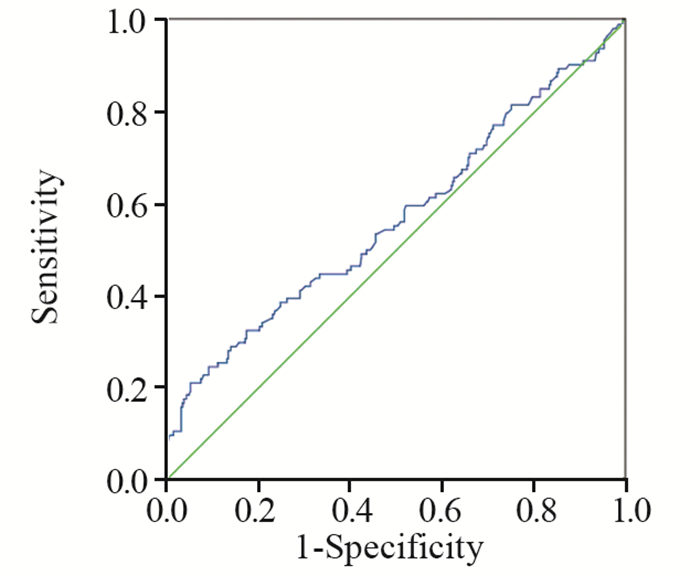
|
| 图 1 Ⅰ~Ⅲ期乳腺癌患者治疗后LDH水平与复发转移率的ROC曲线 Figure 1 ROC curves of post-treatment serum LDH levels and recurrence and metastasis rates in stageⅠ-Ⅲ breast cancer patients |
(1)Ⅰ期患者:单因素分析所有因素差异无统计学意义;(2)Ⅱ期患者:单因素分析显示ER/PR受体状态阴性(P=0.01),有家族遗传史(P=0.049),治疗前ALP升高组(P=0.011)、治疗后LDH升高组(P=0.005)的患者复发转移率升高。同时治疗后ALP升高组(40.9% vs. 20.5%)及治疗前LDH升高组(31.8% vs. 21.6%)的复发转移率均高于未升高组,但差异无统计学意义。多因素分析显示有意义的结果:ER/PR受体状态阴性(P=0.005),治疗后LDH水平(P=0.014)。(3)Ⅲ期患者:单因素分析结果显示治疗后ALP升高组(P=0.011),治疗后LDH升高组(P=0.002)的患者复发转移率升高。同时治疗前ALP升高组(75% vs. 32.5%)及治疗前LDH升高组(37.5% vs.33.6%)的复发转移率均高于未升高组,但差异无统计学意义。多因素分析有意义的结果:治疗后LDH水平(P=0.014)。
2.2.2 血清ALP及LDH与Ⅰ~Ⅲ期患者总生存时间相关性 2.2.2.1Ⅰ~Ⅲ期患者中位OS时间104.41月(95.3~112.71月),单因素分析中差异有统计学意义的因素:ER/PR受体状态阴性(P=0.000),治疗后ALP升高组(P=0.002),见图 2,治疗后LDH升高组(P=0.003),见图 3,治疗后有复发转移(P=0.000)的患者OS缩短。多因素分析结果:ER/PR受体状态(P=0.002)、治疗后复发转移(P=0.000)为影响OS的决定性因素。RR分别为:0.531(0.356~0.792)、7.596(5.04~11.447)。

|
| 图 2 467例Ⅰ~Ⅲ期乳腺癌患者治疗后血清ALP不同水平的总生存曲线 Figure 2 Overall survival curves of 467 stageⅠ-Ⅲ breast cancer patients with different post-treatment serum ALP levels |
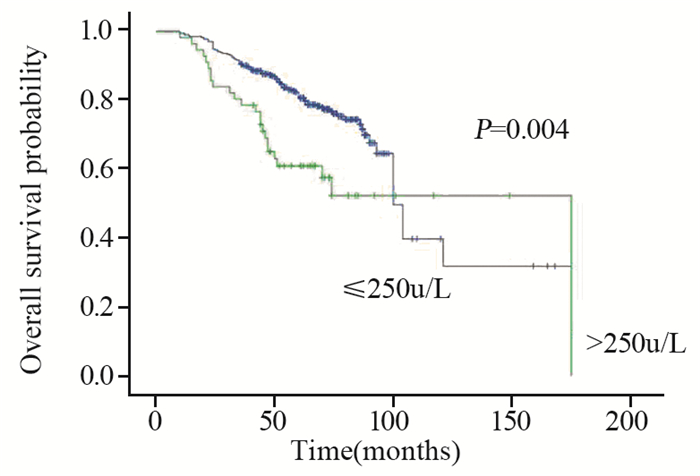
|
| 图 3 467例Ⅰ~Ⅲ期乳腺癌患者治疗后血清LDH不同水平的总生存曲线 Figure 3 Overall survival curves of 467 stageⅠ-Ⅲ breast cancer patients with different post-treatment serum LDH levels |
分期分层研究结果:(1)Ⅰ期患者:单因素分析中有统计学差异的因素:病理类型(其他类型)(P=0.036),治疗前LDH升高组(P=0.032),治疗后有复发转移(P=0.000)的患者OS缩短,且列入多因素分析结果差异均有统计学意义(P<0.05)。(2)Ⅱ期患者:单因素分析结果显示ER/PR受体状态阴性(P=0.005),治疗后LDH升高组(P=0.025),治疗后有复发转移(P=0.000),治疗后有骨转移(P=0.035)的患者OS缩短。多因素分析:治疗后有无复发转移是影响Ⅱ期患者OS的决定性因素。(3)Ⅲ期患者:单因素分析:ER/PR受体状态阴性(P=0.000),治疗后ALP升高组(P=0.002),治疗后有复发转移(P=0.000)的患者OS缩短。多因素分析有意义的因素:ER/PR受体状态及治疗后有无复发转移。
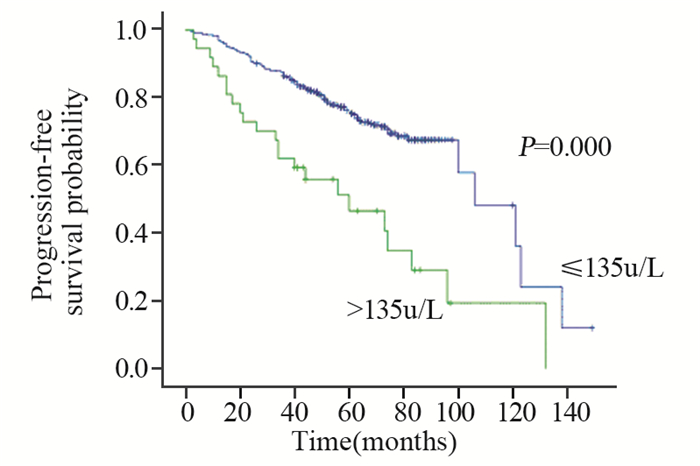
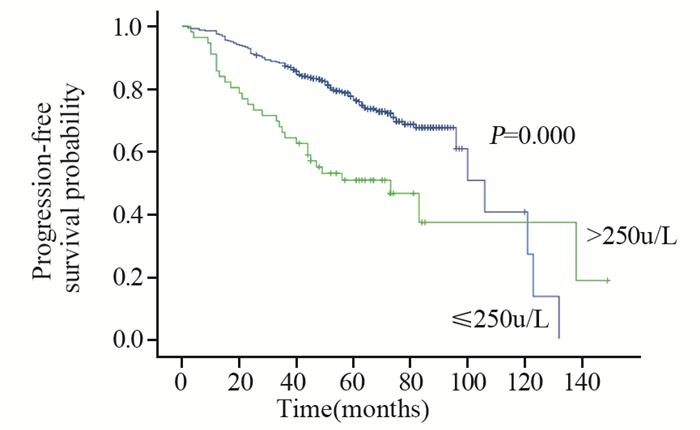
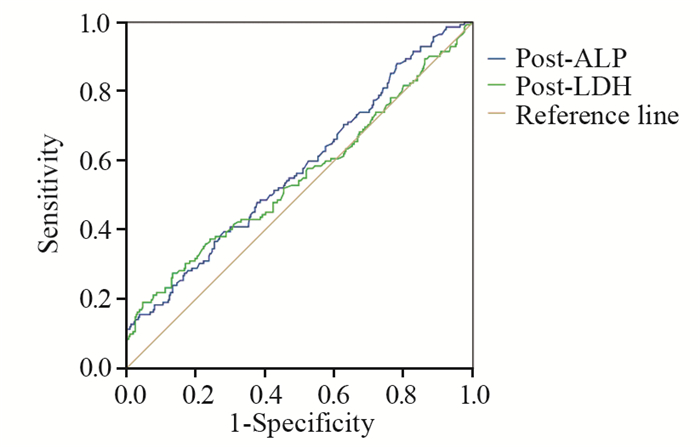
2.2.3 血清ALP及LDH水平与Ⅰ~Ⅲ期患者无进展生存期的相关性 2.2.3.1Ⅰ~Ⅲ期患者中位PFS时间106.25月(92.84~129.16)月,单因素分析:ER/PR受体状态阴性(P=0.001)、有家族遗传史(P=0.021)、治疗后ALP升高组(P=0.000)的患者PFS缩短,差异有统计学意义,见图 4。治疗后LDH升高组(P=0.000)的患者PFS缩短,差异有统计学意义,见图 5。多因素结果显示ER/PR受体状态阴性(P=0.005)、治疗后ALP升高组(P=0.000)、治疗后LDH升高组(P=0.009)为PFS的独立预后因素,差异有统计学意义,见图 6。RR分别为0.584(0.403~0.848)、2.567(1.606~4.105)、1.779(1.155~2.741)。
|
| 图 4 467例Ⅰ~Ⅲ期乳腺癌患者治疗后血清ALP不同水平的无进展生存期曲线 Figure 4 PFS curves of 467 stageⅠ-Ⅲ breast cancer patients with different post-treatment serum ALP levels |
|
| 图 5 467例Ⅰ~Ⅲ期乳腺癌患者治疗后血清LDH不同水平的无进展生存期曲线 Figure 5 PFS curves of 467 stageⅠ-Ⅲ breast cancer patients with different post-treatment serum LDH levels |
|
| ALP with an AUC of 57.6%(95%CI: 51.9%-63.3%) (sensitivity of 15.5% and specificity of 96.3%); LDH with an AUC of 55.2%(95%CI: 49.2%-61.2%) (sensitivity of 19.0% and specificity of 95.4%); AUC: area under the curve 图 6 Ⅰ~Ⅲ期乳腺癌患者治疗后ALP、LDH水平的ROC曲线 Figure 6 ROC curves of post-treatment serum ALP and LDH levels in stageⅠ-Ⅲ breast cancer patients |
(1)Ⅰ期患者:单因素分析所有因素差异无统计学意义。(2)Ⅱ期患者:单因素结果显示ER/PR受体状态阴性(P=0.015),治疗后LDH升高组(P=0.003)的患者PFS缩短。将两组因素列入多因素分析差异有统计学意义(P<0.05)。(3)Ⅲ期患者:单因素结果显示ER/PR受体状态为阴性(P=0.006),有家族遗传史(P=0.030),治疗后ALP升高组(P=0.000),治疗后LDH升高组(P=0.000)的患者PFS缩短。多因素分析:ER/PR受体状态、家族遗传史、治疗后ALP水平是PFS的预后因素(P<0.05)。
3 讨论有研究[5-8]认为LDH和ALP的高表达与恶性肿瘤的临床表现、治疗敏感度及预后相关。LDH及ALP都是血清酶,易于临床治疗过程中检测分析。但由于酶的稳定性及在检测中的差异化[9],对肿瘤预后价值报道不一。Xiao等[10]对临床标本中乳腺癌细胞株进行定量实时PCR分析,结果表明高水平LDH表达与细胞增殖呈正相关,而与乳腺癌转移和患者的OS及PFS呈负相关。Brown等[11]结果显示治疗前LDH有作为非转移性乳腺癌患者的OS预后因素的潜力,且LDH水平升高的患者较未升高者死亡风险增加1.42倍。本研究中结果亦表明Ⅰ~Ⅲ期患者治疗后高LDH水平为影响OS及PFS预后因素,且是影响PFS的独立预后因素。肿瘤代谢程度与预后相关,而治疗后的LDH水平不降低也提示治疗效果较差。本研究总体患者治疗后LDH升高组的复发转移率升高,多因素分析中治疗后LDH升高是复发转移的独立预后因素。进一步说明治疗后LDH可作为乳腺癌患者生存预后因素。由于目前乳腺癌常规化疗方案含有蒽环类药物,其中蒽环类化疗药物具有潜在心脏不良反应,而血清中LDH作为重要的心肌酶谱,临床多用于反应心脏损伤。那么化疗后患者LDH升高除了与乳腺癌复发转移相关外,是否还与因化疗后心脏损伤从而间接的影响患者预后相关。Amin等[12]研究表明接受含蒽环类药物化疗后心脏损伤相关酶LDH升高,而心脏相关疾病成为乳腺癌幸存者的重要死因[13]。若化疗后如出现心肌损伤,心肌酶谱早期表现主要是CK和CK-MB增高,晚期主要是LDH和α-HBDH增高为主。本研究化疗结束后1周之内即采取血液标本,多数患者为化疗后3天之内的血液标本,理论上说避开了因心肌损伤LDH升高的高峰期,但若化疗后确实存在潜在心肌损伤的患者血清LDH会不会呈持续性缓慢升高而最终影响生存,这一问题值得关注,且蒽环类药物的心脏毒性在化疗早期可能没有明显临床症状且血液指标也可能变化微妙,但心脏已有潜在的功能性或器质性改变,因此治疗后LDH升高组间接因心脏毒性而进一步影响患者预后值得进一步思考。
ALP是一种非特异性酶,有研究表明,在细胞核中的ALP可能与细胞增殖有关。Van等发现[14],非转移性乳腺癌ALP水平无显著性差异。然而,有研究得出的结果正好相反,转移性乳腺癌患者与非转移性患者相比,转移患者的ALP水平进一步升高(P<0.001)[15]。Choudhari等研究表明血清ALP水平可作为预测转移及区分乳腺癌有无转移的重要生物标志[16],与本研究结果相似。近几年关于ALP与乳腺癌预后的相关报道较少,但有很多研究显示[8, 17-19],碱性磷酸酶是多种恶性肿瘤的一个重要的预后因素。其他人发现ALP在恶性肿瘤出现转移时显著上升[20-21]。有研究证明ALP可预测乳腺癌肝转移[22-23]和骨转移[20]。Wang等[24]研究证实恶性肿瘤骨转移时ALP水平升高,其血清水平与骨受累部位的数量之间的良好相关性及骨转移病灶数量呈正相关性。
Chen等[25]研究显示,治疗前血清ALP、LDH水平是独立的预后参数可作为预测三阴乳腺癌生存的补充。本研究显示Ⅰ~Ⅲ期乳腺癌患者治疗后LDH为影响OS及PFS预后因素,其中治疗后LDH还是影响PFS的独立预后因素;治疗后ALP影响OS及PFS,且为PFS的独立预后因素之一。出现上述不同结果,可能原因是Chen的研究对象主要是三阴乳腺癌一种分子亚型的患者,由于病理技术原因,本研究的患者不能进行不同分子亚型分类的分层研究,且目前尚无针对LDH、ALP与乳腺癌分子分型的分层的对比研究,有待进一步探讨。
本研究还显示患者的激素受体状态、治疗后出现复发转移、治疗后出现肝脏转移都是乳腺癌患者的独立预后因素,与Le、Brown等研究结果相似[4, 11]。
综上所述,对本研究中467例Ⅰ~Ⅲ期乳腺癌患者回顾性分析表明:治疗后LDH水平与复发转移率关系密切,可作为其预测因素,治疗后LDH、ALP水平为影响OS及PFS预后因素,其中两者与PFS关系更为紧密。LDH及ALP作为乳腺癌血清学检测指标,易于检测、便于观察,具有进一步研究的临床意义。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [2] | Masoud V, Pagès G. Targeted therapies in breast cancer: New challenges to fight against resistance[J]. World J Clin Oncol, 2017, 8(2): 120–34. DOI:10.5306/wjco.v8.i2.120 |
| [3] | Pierga JY, Asselain B, Jouve M, et al. Effect of adjuvant chemotherapy on outcome in patients with metastatic breast carcinoma treated with first-line doxorubicin-containing chemotherapy[J]. Cancer, 2001, 91(6): 1079–89. DOI:10.1002/(ISSN)1097-0142 |
| [4] | Le Scodan R, Massard C, Jouanneau L, et al. Brain metastases from breast cancer: proposition of new prognostic score including molecular subtypes and treatment[J]. J Neurooncol, 2012, 106(1): 169–76. DOI:10.1007/s11060-011-0654-x |
| [5] | Teke Hü, Başak M, Teke D, et al. Serum Level of Lactate Dehydrogenase is a Useful Clinical Marker to Monitor Progressive Multiple Myeloma Diseases: A Case Report[J]. Turk J Haematol, 2014, 31(1): 84–7. DOI:10.4274/tjh |
| [6] | Kim SJ, Hong JS, Chang MH, et al. Highly elevated serum lactate dehydrogenase is associated with central nervous system relapse in patients with diffuse large B-cell lymphoma: Results of a multicenter prospective cohort study[J]. Oncotarget, 2016, 7(44): 72033–43. |
| [7] | Zhang M, Wei S, Su L, et al. Prognostic significance of pretreated serum lactate dehydrogenase level in nasopharyngeal carcinoma among Chinese population: A meta-analysis[J]. Medicine (Baltimore), 2016, 95(35): e4494. DOI:10.1097/MD.0000000000004494 |
| [8] | Wei XL, Zhang DS, He MM, et al. The predictive value of alkaline phosphatase and lactate dehydrogenase for overall survival in patients with esophageal squamous cell carcinoma[J]. Tumour Biol, 2016, 37(2): 1879–87. DOI:10.1007/s13277-015-3851-y |
| [9] | Breier M, Wahl S, Prehn C, et al. Targeted metabolomics identifies reliable and stable metabolites in human serum and plasma samples[J]. PLoS One, 2014, 9(2): e89728. DOI:10.1371/journal.pone.0089728 |
| [10] | Xiao X, Huang X, Ye F, et al. The miR-34a-LDHA axis regulates glucose metabolism and tumor growth in breast cancer[J]. Sci Rep, 2016, 6: 21735. DOI:10.1038/srep21735 |
| [11] | Brown JE, Cook RJ, Lipton A, Coleman RE. Serum lactate dehydrogenase is prognostic for survival in patients with bone metastases from breast cancer: a retrospective analysis in bisphosphonate-treated patients[J]. Clin Cancer Res, 2012, 18(22): 6348–55. DOI:10.1158/1078-0432.CCR-12-1397 |
| [12] | Amin KA, Mohamed BM, El-Wakil MA, et al. Impact of breast cancer and combination chemotherapy on oxidative stress, hepatic and cardiac markers[J]. J Breast Cancer, 2012, 15(3): 306–12. DOI:10.4048/jbc.2012.15.3.306 |
| [13] | Gernaat SAM, Ho PJ, Rijnberg N, et al. Risk of death from cardiovascular disease following breast cancer: a systematic review[J]. Breast Cancer Res Treat, 2017, 164(3): 537–55. DOI:10.1007/s10549-017-4282-9 |
| [14] | Van Hoof VO, Van Oosterom AT, Lepoutre LG, et al. Alkaline phosphatase isoenzyme patterns in malignant disease[J]. Clin Chem, 1992, 38(12): 2546–51. |
| [15] | Singh AK, Pandey A, Tewari M, et al. Advanced stage of breast cancer hoist alkaline phosphatase activity: risk factor for females in India[J]. 3 Biotech, 2013, 3(6): 517–20. DOI:10.1007/s13205-012-0113-1 |
| [16] | Choudhari A, Desai P, Indumati V, et al. Activities of serum Ada, GGT and alp in carcinoma breast-a case control study for diagnostic and prognostic significance[J]. Indian J Med Sci, 2013, 67(5-6): 123–9. |
| [17] | Xie Y, Wei ZB, Duan XW. Prognostic value of pretreatment serum alkaline phosphatase in nasopharyngeal carcinoma[J]. Asian Pac J Cancer Prev, 2014, 15(8): 3547–53. DOI:10.7314/APJCP.2014.15.8.3547 |
| [18] | Orsaria M, Londero AP, Marzinotto S, et al. Placental type alkaline phosphatase tissue expression in ovarian serous carcinoma[J]. Cancer Biomark, 2016, 17(4): 479–86. |
| [19] | Wu SJ, Lin YX, Ye H, et al. Prognostic value of alkaline phosphatase, gamma-glutamyl transpeptidase and lactate dehydrogenase in hepatocellular carcinoma patients treated with liver resection[J]. Int J Surg, 2016, 36(Pt A): 143–51. |
| [20] | Lyubimova NV, Kozharskaya GV, Portnoi SM, et al. Biochemical markers of bone metabolism in breast cancer[J]. Bull Exp Biol Med, 2014, 157(6): 769–72. DOI:10.1007/s10517-014-2663-1 |
| [21] | Wei RJ, Li TY, Yang XC, et al. Serum levels of PSA, ALP, ICTP, and BSP in prostate cancer patients and the significance of ROC curve in the diagnosis of prostate cancer bone metastases[J]. Genet Mol Res, 2016, 15(2). |
| [22] | Yu YQ, Li J, Liao Y, et al. The preoperative alkaline phosphatase-to-platelet ratio index is an independent prognostic factor for hepatocellular carcinoma after hepatic resection[J]. Medicine (Baltimore), 2016, 95(51): e5734. DOI:10.1097/MD.0000000000005734 |
| [23] | Kim JM, Kwon CH, Joh JW, et al. The effect of alkaline phosphatase and intrahepatic metastases in large hepatocellular carcinoma[J]. World J Surg Oncol, 2013, 11: 40. DOI:10.1186/1477-7819-11-40 |
| [24] | Wang Z, Lu Y, Qiao D, et al. Diagnostic and prognostic validity of serum bone turnover markers in bone metastatic non-small cell lung cancer patients[J]. J Bone Oncol, 2015, 4(3): 85–91. DOI:10.1016/j.jbo.2015.09.003 |
| [25] | Chen B, Dai D, Tang H, et al. Pre-treatment serum alkaline phosphatase and lactate dehydrogenase as prognostic factors in triple negative breast cancer[J]. J Cancer, 2016, 7(15): 2309–16. DOI:10.7150/jca.16622 |
 2017, Vol. 44
2017, Vol. 44


